腹腔镜下微波消融辅助治疗小肾癌临床疗效*
张自刚刘铁柱奚晓龙
腹腔镜下微波消融辅助治疗小肾癌临床疗效*
张自刚①刘铁柱①奚晓龙①
目的:研究腹腔镜下微波消融(MWA)辅助治疗小肾癌的临床疗效。方法:选取2012年5月-2014年10月应用腹腔镜下微波消融辅助治疗的小肾癌患者15例,其中不阻断肾蒂,肿瘤小于3 cm者直接行微波消融;肿瘤大于3 cm者于肿瘤周围行微波消融,形成无血供平面,再行肾部分切除术,记录手术时间、出血量、围术期Hb、SCr及患侧肾GFR变化,统计住院时间、术后并发症率,观察肿瘤预后。结果:所有患者均成功手术,无中转开放者。围术期Hb、SCr、患侧肾GFR与术前比较差异均无统计学意义(P>0.05)。手术时间(103±15)min,手术出血量(72±25)mL,术后住院时间(5±2)d。术后并发症率13.3%(2/15),其中1例发热,1例患侧疼痛不适,休息后自行缓解,无术后漏尿患者。所有患者术后随访平均18.7(6~32)个月,分别于术后1、3、6个月行增强CT,无肿瘤复发及死亡病例。结论:腹腔镜下微波消融辅助治疗小肾癌安全有效,出血少,术后恢复快,并发症少,有望成为T1期肾癌的有效治疗方式之一。
微波消融; 腹腔镜; 肾肿瘤
近年来,越来越多的小肾癌在体检时被人们发现,既往开放或腹腔镜下根治性肾切除术被认为是对侧肾功正常的肾癌治疗的常规术式。但对于无法行根治性肾切除及肾功能不全的患者,尽量保留较多的肾功能成为当下研究的热点。随着对肾功能保护逐渐重视及手术技术的提高,保留肾单位手术(Nephron Sparing Srugery,NSS)的应用范围越来越广。除了腹腔镜肾部分切除术外,微波,射频,冷冻消融技术逐渐兴起,2012年5月-2014年10月笔者应用腹腔镜下微波消融辅助治疗小肾癌15例,取得较好临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年5月-2014年10月本院收治的单侧小肾癌患者15例,其中男9例,女6例;平均年龄57岁;肿瘤大小2.1~3.9 cm,平均3.3 cm;肿瘤位于左侧8例,右侧7例。术前Hb(120±10)g/L,SCr(98±18)μmol/L,患侧肾GFR(35±7)mL/min。本研究入组所有患者均签署知情同意书并获得医院伦理委员会讨论通过。
1.2 入组标准 (1)病灶单发;(2)病灶最大直径≤4 cm;(3)所有肿瘤外向性生长,部分或大部分突出于肾脏表面,除外瘤栓及肾外转移者;(4)患者术前生化指标均无手术禁忌,Hb正常范围,SCr正常或略高于正常;(5)除外因各种合并症不能耐受手术者。排除标准为具有严重的心肺疾病及感染,不能耐受静脉麻醉者,各项生化指标存在异常,不适合行手术者。
1.3 方法 所有患者在术前均完善双肾超声,CT64排成像扫描及三维重建或MRI双肾检查,在术前对病灶进行评估。
微波治疗:所有患者均全身麻醉,健侧卧位,采用后腹腔镜入路,建立气腹。术中应用超声确定肿瘤边缘后,采用KY-2000型微波治疗仪,工作频率2450 MHz,输出功率0~100 W。内置水冷却循环系统,防止杆温过高。15 G植入式水冷微波天线,杆长18 cm,微波仪配有21 G测温针,在微波消融过程中实时监测治疗温度。治疗前,根据术前超声或CT增强及三维重建影像学检查,选择合适的穿刺路线,消毒、铺巾、局麻后,在穿刺点作一小切口,超声引导下用18 G活检针做穿刺活检,取部分组织送病理学检查。然后,沿活检针切口将微波针置入肾肿瘤内。根据肿瘤大小确定进针数量,通常病灶最大直径≤3.0 cm者,置入1支天线;病灶最大直径>3.0 cm,置入2支以上天线。待患者呼吸平稳后开始辐射微波,穿刺深度小于肿瘤直径约0.5 cm,以平均50 W(40~60 W)连续模式消融。平均5~8 min。病灶边缘1~2 mm 处植入测温针实时监测温度,以免烫伤周围组织。术毕退针时停止水冷循环充分凝固消融针道。手术无需阻断肾蒂。对于小于3 cm肿瘤,穿刺留取病理后直接微波消融。术后留取消融区域边缘组织行病理。肿瘤大于3 cm者于肿瘤周围边缘行微波消融,形成无血供平面,再行肾部分切除术。术后采用可吸收线间断缝合肾实质,生物蛋白胶喷涂止血。所有手术均为同一术者操作。留取手术中的资料,包括手术时间、术中出血等。评估单针式微波热疗系统联合腹腔镜治疗局限性肾癌的可行性和有效性。监测围手术期Hb、SCr,患肾GFR变化。
1.4 观察指标 记录患者手术前后Hb、SCr、患肾GFR及手术时间、术中平均出血量、术后住院时间、术后并发症发生率等。
1.5 统计学处理 采用SPSS 15.0统计软件分析数据,计量资料以(±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
本次入组15例患者手术均获成功,无中途转为开放及输血者。单纯消融的患者术中穿刺取病理活组织检查,所有患者术后肿瘤边缘病理检查均未发现瘤细胞。入组患者手术时间为(103±15)min,术中出血量为(72±25)mL,术后住院时间(5±2)d。入组患者手术前后的Hb、SCr、GFR比较差异均无统计学意义(P>0.05),见表1。本组患者术后出现1例发热,为术后第1天,体温最高达38.7 ℃,血象轻度升高,给予退热治疗,嘱多饮水后体温逐渐恢复正常,未再次发热。另有1例患侧腰疼,卧床休息,对症治疗后缓解,无后遗症。所有患者术后1、3、6个月复查增强CT,观片见微波消融病灶均完全坏死,切除病灶后残余肾脏无增强及肿瘤复发征象。平均随访18.7(6~32)个月,患者均无瘤生存。
表1 围术期生化指标变化(±s)
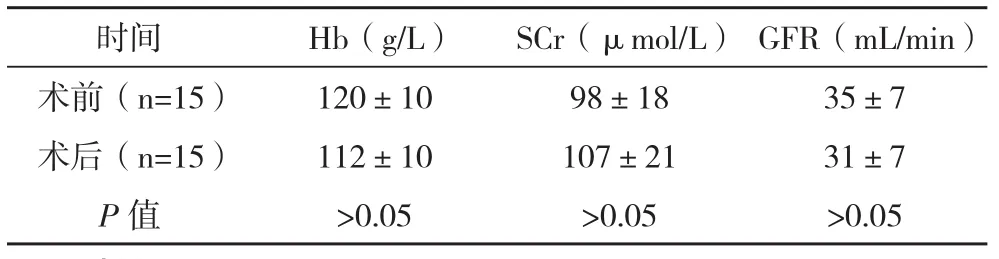
表1 围术期生化指标变化(±s)
时间Hb(g/L)SCr(μmol/L)GFR(mL/min)术前(n=15)120±1098±1835±7术后(n=15)112±10107±2131±7 P值>0.05>0.05>0.05
3 讨论
肾癌占人类恶性肿瘤的 3%,是泌尿系统第二常见的恶性肿瘤[1],随诊腹腔镜技术的发展与成熟以及人们对保留肾单位的重要性的认识,人们逐渐将腹腔镜及NSS应用于特定分期肾癌的治疗,相对于根治性肾切除术,保留肾单位手术并不增加肿瘤复发及转移的风险[2]。国际上一般将直径小于4 cm的早期肾癌称做“小肾癌”,对应肾癌分期T1a期。目前T1a期肾癌NSS的微创治疗方法有LPN、微波消融、冷冻消融、射频消融、高强度聚焦超声(海扶刀)等。传统的冷冻消融和射频消融已经被广泛应用于实质脏器肿瘤、骨科疾病和心律失常的治疗[3-6]。而微波消融是近年来新兴起的一种原位灭活肿瘤的治疗手段,其优点为肾功能损伤小、恢复快、复发率低等[7]。借助医学影像技术(CT、MRI、超声等)的引导对肿瘤靶区进行定位,通过微波探头发出的能量,利用高频电磁波的作用,使肿瘤内的带电粒子、水分子等极性分子物质高频振荡,相互摩擦生热,使消融区肿瘤组织发生凝固性坏死,高热能使肿瘤周围的血管组织凝固形成一个反应带,使之不能向肿瘤供血和有利于防止肿瘤转移。在我国被成功的应用于肝癌的治疗[8],小肝癌微波治疗5年生存率与手术切除相似[9-11]。由于其良好的前景,目前逐步应用骨肿瘤、肺肿瘤和甲状腺瘤等实体肿瘤的治疗[12-14]。Gervais等[15]对85例肾癌患者行经皮消融治疗,分组研究提示,所有直径小于3 cm的或者外生性生长的肿瘤均消融成功。对于直径大于3 cm的肿瘤多需要再次消融治疗,大于5 cm的肿瘤仅25%的患者消融成功。Park等[16]对78例患者行经皮或腹腔镜消融治疗,肿瘤的平均直径2.4 cm(1.0~4.2 cm),96.8%的患者无肿瘤复发,仅2例肿瘤直径大于3 cm的患者消融治疗不完全。本研究针对微波消融的范围,充分考虑到肿瘤的大小及位置因素,结合既往的研究结论,选择小于3 cm的T1a期肾癌行针刺微波消融,另外选取大于3 cm的T1a期肾癌行腹腔镜下微波消融辅助肾部分切除(LMAPN)。
LMA手术避免了传统开放手术的切口大、创伤大、出血多、手术时间长的缺点,本组患者应用LMA治疗符合一定条件的小肾癌,切口小,对于较小的T1a期肿瘤,行微波单针消融,利用微波热能传导使局部组织血管凝固,同时针道组织也局部凝固坏死,因此肿瘤组织中基本出血量很少,平均失血(72±25)mL,术后血Hb较术前平均值有所减少,平均值减少8 g/L,考虑术中出血所致。但统计学分析提示LMA治疗对患者Hb的变化无明显影响(P>0.05)。
LMA辅助肾部分切除术及单针肾肿瘤消融术无需阻断肾蒂,本研究中,对于小于3 cm的T1a期肿瘤,利用微波消融局部热效应直接将肿瘤消融,术后留取肿瘤边缘病理组织未发现肿瘤转移。对于大于3 cm的T1a期肿瘤,微波消融可以使肿瘤周围的血管组织凝固,在准备切除的肿瘤周围建立无血供平面,在不阻断肾动脉的情况下,行肾部分切除术治疗肾癌,所有病例均取得成功,术后随访未发现复发及肿瘤残余。这种治疗方法不阻断肾蒂,不会导致肾脏热缺血和缺血再灌注的损伤,对患者SCr及患肾GFR影响较传统手术明显改善,在本组试验中,所有患者术后SCr及患肾GFR与术前比较均有轻度降低,考虑可能为热量损伤及功能肾单位的减少导致,但统计学分析提示差异无统计学意义(P>0.05)。因此,该方法可作为肾功不全或孤立肾肿瘤患者的有效治疗方案。另外,对于大于3 cm的小肾癌,本组患者行LMA肾部分切除术,在阻断血运同时切除病灶,解决了单纯应用微波消融治疗较肾癌过程中可能会造成的肿瘤残余和复发的问题。需要指出的是,该方法对于远期SCr及肾脏GFR的影响尚待观察与评估。
微波治疗的并发症有漏尿,出血,发热等[17-18],个别患者有治疗侧腰疼[4]。近期漏尿可能与术中穿刺位置过深,损伤集尿系统有关,而迟发性漏尿是消融的后续热损伤效应引起的集尿系统损伤所致[19],留置双“J”管内引流尿液,多可自行愈合。微波消融探针局部热效应直接将组织凝固,针道出血较少。多为手术创面术中或术后迟发出血,表现为肾周血肿,据Castle等[20]报道,穿刺过程中还可能会导致肾周血肿和脾包膜的损伤。少量出血者可卧床休息,血肿自行吸收,如出血较多,可能需栓塞治疗。在此过程中可能伴或不伴有发热。本研究中LMA组术后出现1例发热,1例腰疼,无术后漏尿患者。可能与笔者选取的病例肿瘤均为外生性生长有关。肿瘤距离肾盂较远,尚未造成漏尿。
查阅近年来文献,有报道发现以微波热消融为主要技术手段的保留肾脏的手术对患者远期疗效更为有利[21-25]。2年内的生存率将近100%,而3年的内的生存率也在90%以上。但是也有研究提示不同的结果,Castle等[20]在一项针对微波治疗6例男性及4例女性小肾癌患者的研究中指出,术后平均随访17.9个月,复发率高达38%。分析原因可能与肿瘤病例的选择有关,该组病例肿瘤直径较大,其中50%的肿瘤侵犯了肾脏的集合系统而且肿瘤位置较深。本研究中两组患者预后均较好,术后1、3、6个月复查增强CT,未见肿瘤复发及转移征象。提示LMA治疗肾癌的疗效与严格选择适应证关系密切。本组试验针对T1a期肾癌进行研究,尚未扩展到T1b期肾癌的范围,提示针对T1aLMA短期疗效确切,但由于样本量尚少,随访期限较短,LMA远期效果(肿瘤残留,复发,SCr及GFR变化等)尚需循证医学证据。
既往多数相关研究均着眼于LMA对T1a期肾癌的疗效探讨,对于大于3 cm或4 cm的肿瘤的治疗效果讨论较少。但随着对肾肿瘤认识的加深和操作技术的成熟,LMA的适应证有望扩大并成为符合一定条件的T1期肾癌的有效治疗方式之一。
总之,腹腔镜下微波消融术治疗小肾癌安全有效,出血少,对肾脏功能及GFR影响小,并发症少,是一项具有光明前景的微创技术。但由于其开展例数较少,远期肿瘤生物学的疗效有待进一步的追踪及随访。
[1]叶定伟,张海.中国肾癌诊治现状和发展趋势[J].中华泌尿外科杂志,2014, 35(6):401-405.
[2] Crépel M, Jeldres C, Perrotte P, et al.Nephron-sparing surgery is equally effective to radical nephrectomy for T1bN0M0 renal cell carcinoma:a population based assessment [J].Urology, 2009,48(65):3.
[3]曾智明,朱广志.CT引导下射频消融术治疗肝癌的临床效果评价[J].中国医学创新,2014,11(26):24-26.
[4]张旭桥,姜升平,王晓晖,等.射频消融术治疗腰椎间盘突出症伴局限性高信号1例[J].中国医学创新,2014,11(9):129-130.
[5]宗其梅,黄卫斌.心房颤动射频消融术中转为规则房速的机制[J].中国医学创新,2012,9(13):156-158.
[6]孟斌,张红霞,陈风.射频消融慢径治疗不典型性房室结折返性心动过速的临床观察[J].中国医学创新,2010,7(26):26-27.
[7] Chen D Y, Uzzo R G.Optimal management of localized renal cell carcinoma:surgery,ablation,or active surveillance[J].J Natl Compr Canc Netw,2009,25(7):635-642.
[8]朱海涛.肝动脉化疗栓塞联合经皮微波刀消融治疗肝肿瘤[J].中国医学创新,2012,9(23):115-116.
[9]王旸,梁萍,于晓玲,等.超声引导经皮微波消融治疗肾肿瘤[J].中华超声影像学杂志,2009,18(1):52-54.
[10] Liang P, Wang Y.Microwave ablation of hepatocellular carcinoma[J]. Oncology, 2007, 72(Suppl 1):124-131.
[11] Liang P, Dong B W, Yu X L, et al.Prognostic factors for survival in patients with hepatocellular carcinoma after percutaneous microwave ablation[J].Radiology,2005,234(8):299-307.
[12]张余,柯晋.微波消融在骨肿瘤治疗中的作用[J].实用医学杂志,2013,29(21):3455-3457.
[13]安仲军, 谷有良,李东风,等.CT引导水冷循环微波消融在肺癌治疗方面的应用[J].局解手术学杂志,2010,19(1):38.
[14]奚淑芳,徐栋,王群江,等.甲状腺肿瘤微波消融33例临床分析[J].肿瘤学杂志,2013,19(11):897-899.
[15] Gervais D A, McGovern F J, Arellano R S, et al.Radiofrequency ablation of renal cell carcinoma:part 1, indications, results, and role in patient management over a 6-year period and ablation of 100 tumors[J].AJR Am J Roentgenol, 2005, 185(1):64-71.
[16] Park S, Anderson J K, Matsumoto E D, et al.Radiofrequency ablation of renal tumors:intermediate-term results [J].J Endourol, 2006, 20(8):569-573.
[17] Carraway WA, Raman J D, Cadeddu J A.Current status of renal radiofrequency ablation[J].Curr Opin Urol, 2009, 19 (2):143-147.
[18] Gillams A.Tumour ablation:current role in the liver, kidney, lung and bone[J].Cancer Imaging, 2008,58(8 A):S1-5.
[19]胡志全,苏耀,管维,等.微波消融治疗在小肾癌中的应用(附15例报告)[J].现代泌尿生殖肿瘤杂志,2010,2(1):7-9.
[20] Castle S M, Salas N, Leveillee R J.Initial experience using microwave ablation therapy for renal tumor treatment:18-month follow-up[J]. Urol,2011,77 (4):792.
[21] Yu J, Liang P, Yu X L, et al.US- guided percutaneous microwave ablation versus open radical nephrectomy for renal cell carcinoma:Intermediate-term results[J].Radiology, 2014, 270(3):880-887.
[22] Guan W, Bai J, Liu J, et al.Microwave ablation versus partial nephrectomy for small renal tumors:Intermediate- term results[J]. Journal of Surgical Oncology, 2012, 106(3):316-321.
[23] Carrafiello G, Dionigi G, Boni L, et al.Current role of interventions in metastatic kidney tumors:Single center experience[J].Updates in Surgery, 2011, 63(4):259-269.
[24] Bai J, Hu Z, Guan W, et al.Initial experience with retroperitoneoscopic microwave ablation of clinical T(1a) renal tumors[J].Journal of Endourology/Endourological Society, 2010, 24(12):2017-2022.
[25]盛林,翟伟明,董宝玮,等.微波热消融技术的临床应用进展[J].科技导报,2014,32(30):30-34.
Clinical Efficacy of Laparoscopic Microwave Ablation in the Treatment of Small Renal Carcinoma/
ZHANG Zi-gang,LIU Tie-zhu,XI Xiao-long.//Medical Innovation of China,2015,12(12):125-128
Objective:To assess the clinical efficacy of laparoscopic microwave ablation (LMA) in the treatment of small renal carcinoma.Method:From May 2012 to Oct 2014, the LMA was performed for 15 small renal carcinoma. The renal pedicle was not blocked during operation, microwave ablation was carried out for tumors smaller than 3cm,while laparoscopic microwave ablation partial nephrectomy(LMAPN) was performed for tumors 3-4 cm.The operationtime, blood loss, changes of Hb, SCr and GFR before and after operation, postoperative hospital stay, complication rates and tumor prognosis of these cases were recorded and analyzed.Result:All cases were operated successfully, no case was converted to laparotomy.There was no significant change of Hb, SCr and GFR after operations(P>0.05).The operation time was (103±15)min, the blood loss was (72±25)ml, the postoperative hospital stay was (5±2)d. The complication rate was 13.3%(2/15), with 1 case of fever and 1 case of pain with no case of urine leakage.Patients were followed up for 18.7(6-32)months.Enhanced CT was taken by 1 month,3 month and 6 month after operation,there was no tumor recurrence and death cases.Conclusion:LMA for small renal carcinoma is safe and effective with less bleeding,quick recovery and low complication rate.It is hopefully to become one of an effective way for treating T1 stage renal carcinoma.
Microwave ablation; Laparoscope; Renal tumor
10.3969/j.issn.1674-4985.2015.12.040
2014-11-22) (本文编辑:蔡元元)
吴阶平医学基金会临床科研专项资助基金(320.6750.13219)
①大庆油田总医院 黑龙江 大庆 163001
张自刚
First-author’s address:Daqing Oilfield General Hospital,Daqing 163001,China

