84例ⅢA-N2期非小细胞肺癌术前新辅助临床治疗结果分析
杨海堂 姚烽 赵洋 澹台冀瀓 赵珩
·临床研究与应用·
84例ⅢA-N2期非小细胞肺癌术前新辅助临床治疗结果分析
杨海堂 姚烽 赵洋 澹台冀瀓 赵珩
目的:探讨新辅助结合手术切除治疗ⅢA-N2期非小细胞肺癌的临床疗效。方法:收集2008年1月至2013年7月上海交通大学附属胸科医院收治的术前明确单侧纵隔淋巴结(且淋巴结短径≥1 cm)转移(ⅢA-N2期),经新辅助治疗后再手术的非小细胞肺癌(non-small cell lung cancer,NSCLC)91例患者。总结并分析经术前新辅助治疗的反应率以及患者的生存情况并分析影响预后的因素。结果:3年和5年总生存期(OS)分别为57.7%和34.2%;3年和5年无病生存期(DFS)分别为37.9%和30.5%。在OS和DFS方面,R0和R1组之间(P=0.118;P=0.369)、新辅助化疗和放化疗组之间(P=0.771;P=0.953)、临床反应和无反应组之间(P= 0.865;P=0.862)以及不同组织病理类型组之间(P=0.685;P=0.208)比较差异均无统计学意义。肺叶切除及术后病理性淋巴结降期的患者分别优于相应地扩大性切除(P=0.023;P=0.024)和未降期(P=0.036;P=0.025)的患者。单因素分析显示肺叶切除和术后病理性淋巴结降期为有利的预测因子。多因素分析显示,病理淋巴结降期为术后DFS的有利预测因子;无吸烟史及肺叶切除为OS的有利预测因子。结论:术前新辅助治疗ⅢA-N2期NSCLC是可行的,能有效地使肿瘤大小及淋巴结降期,预后较为满意;预测预后方面,术后病理性降期要比临床反应更有意义;可行根治性肺叶切除及有病理性淋巴结降期的患者预后更好。
非小细胞肺癌 纵隔淋巴结转移 新辅助治疗 降期 手术
肺癌是威胁人类健康最常见的恶性肿瘤之一,其发病率和死亡率在诸多恶性肿瘤中呈逐年上升趋势。对局部晚期非小细胞肺癌(locally advanced nonsmall cell lung cancer)而言,单纯手术治疗的效果并不理想,预后比较差。大量研究均表明根治性化放疗或术前新辅助治疗(neo-adjuvant therapy)的多学科综合治疗较单纯的手术切除能使该类患者获益[1-4]。然而对于这部分患者的最佳管理方法尚存在争议,目前多推荐以化放疗为主的多学科综合治疗。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)2015年第1版推荐该类患者(T1-3N2M0,ⅢA)的治疗方法为根治性化放疗或新辅助化疗/化放疗辅以手术切除(对于稳定的癌灶)[5]。术前诱导治疗被认为其可减少肿瘤负荷,降低肺癌患者的临床与病理分期以及消除微转移灶,进而提高晚期肺癌患者的手术机会和延长患者生存期[6-7]。先前的一些前瞻性研究纳入了较多的早期非小细胞肺癌(ⅠB~ⅢA-N1),容易混淆干扰新辅助治疗在局部晚期NSCLC中的真实作用[8-9]。因此,本研究回顾分析新辅助治疗结合手术的多学科治疗在ⅢA-N2期非小细胞肺癌中的可行性及预后。
1 材料与方法
1.1 临床资料
收集2008年1月至2013年7月上海交通大学附属胸科医院收治的术前明确单侧纵隔淋巴结(且淋巴结短径≥1 cm)转移经新辅助治疗后再手术的NSCLC患者。共收集91例符合条件的患者资料,失访7例,最终84例纳入分析。其中男性64例(76.2%),女性20例(23.8%),平均年龄55.4(30~72)岁。
1.2 方法
所有患者均术前病理明确单侧纵隔淋巴结转移,临床分期为C-T1-3N2M0的非小细胞肺癌。所有患者均术前行2个周期的铂类为主的诱导化疗或放化疗并于诱导治疗后3~5周行手术切除病灶。术后予以4个周期的化疗,对切缘阳性的同时辅以放疗。
新辅助治疗的临床反应根据治疗前后的影像学进行评估(WHO):完全缓解(complete response,CR);部分缓解(partial response,PR);病情稳定(stable dis⁃ease,SD),疾病进展(progressive disease,PD)。随访第1年按照每3个月随访1次,之后每6个月随访1次。生存及复发时间计算从明确病理诊断的日期开始。
1.3 统计学分析
应用SPSS 19.0统计软件进行数据统计学处理,组间计量数据比较采用t检验,率的比较采用χ2检验,采用Kaplan-Meier法绘制生存曲线并进行Log-rank检验。单因素分析结果有意义的变量(P<0.15)进入Cox比例风险模型进行多因素分析。P<0.05为差异具有统计学意义。
2 结果
患者临床资料见表1。行术前新辅助化疗(neo⁃adjuvant chemotherapy,CTx)有76例(90.5%);术前新辅助化放疗(neo-adjuvant chemoradiotherapy,CRTx)共8例(95%)。有吸烟史53例(60.5%),均为男性。PS评分(performance status)0分为31例(39.5%),1分为53例(60.5%)。平均术后住院时间为9.7(2~20)天;其中,CTx组比CRTx组的患者术后住院时间短(9.4 vs.12.0天,P=0.043)。

表1 84例ⅢA-N2期NSCLC患者手术及术后病理资料Table 1 Data on surgery and postoperative pathological staging
84例患者中,腺癌42例(50%),其次依次为鳞癌9例(34.5%);腺鳞癌7例(8.3%);大细胞癌5例(6.0%)。临床分期显示C-T2N2M0比例最高,达55例(65.5%);C-T1N2M0有4例(4.5%);C-T3N2M025例(29.8%)。新辅助治疗前后的影像学评估临床反应显示:CR 0例,PR 39例(46.4%),SD 43例(51.2%),PD 2例(2.4%)。
手术方式及术后病理分期见表1。标准肺叶切除术比例最高,为63例(75.0%);扩大性切除术21例(25.0%),其中包括袖状肺叶切除术3例,双肺叶切除14例,全肺切除4例。根治性切除(R0)75例(89.3%),镜下切缘阳性(R1)9例(9.7%),包括5例肺叶切除,3例双肺叶切除,1例全肺切除。术后病理分期以p-T1和p-T2为主,分别38例(45.2%)和40例(47.6%);p-T04例(4.8%),p-T32例(2.4%)。术后病理性淋巴结降期(pN2to pN0-1)38例(45.2%);未降期(pN2)46例(54.8%),包括14例(16.7%)单组N2阳性和32例(30.1%)多组N2阳性。
截至随访日期,共55例复发,包括35例局部复发,37例远处转移。胸外首个远处转移位点为:脑转移13例,骨转移9例,肝转移4例,5例不确定。共46例死亡,38例生存。生存的38例患者有8例EGFR基因突变,复发后行靶向治疗目前均生存。
3年和5年总生存期(OS)分别为57.7%和34.2%;3年和5年无病生存期(DFS)分别为37.9%和30.5%。在OS和DFS方面,R0和R1组之间(P= 0.118;P=0.369)、新辅助化疗和放化疗组之间(P= 0.771;P=0.953)、临床反应和无反应组之间(P= 0.865;P=0.862)以及不同组织病理类型组之间(P= 0.685;P=0.208)比较差异均无统计学意义。然而,肺叶切除及术后病理性纵隔淋巴结降期的患者分别优于相应的扩大性切除(P=0.023;P=0.024)(图1A,1B)和未降期(P=0.036;P=0.025)(图1C,1D)的患者。在去除9例R1切除的病例后,75例获得根治性切除的患者中,此差异更为明显:行标准肺叶切除术(平均生存时间48.9个月)的患者相比行扩大性切除(平均生存时间31.7个月)预后更好,OS(P=0.016)和DFS(P=0.022)差异也更加明显(图2)。单因素分析显示肺叶切除和术后病理性淋巴结降期均为OS和DFS预后有利的预测因子(表2)。多因素分析显示,病理淋巴结降期为术后DFS(HR 0.42,95%CI:0.20~0.80)的有利预测因子;无吸烟史及肺叶切除为OS(HR 0.54,95%CI:0.31~0.94)的有利预测因子(表3)。

图1 新辅助治疗后行不同手术方式及获得不同程度病理性淋巴结反应的患者生存结果进行比较Figure 1 Survival comparisons between patients performed with different surgical types and those with various pathologically nodal responses after induc⁃tion therapy

表2 相关变量的单因素分析结果Table 2 Univariate analysis of the association of baseline characteristics and treatment-related variables with DFS and OS(n=84)
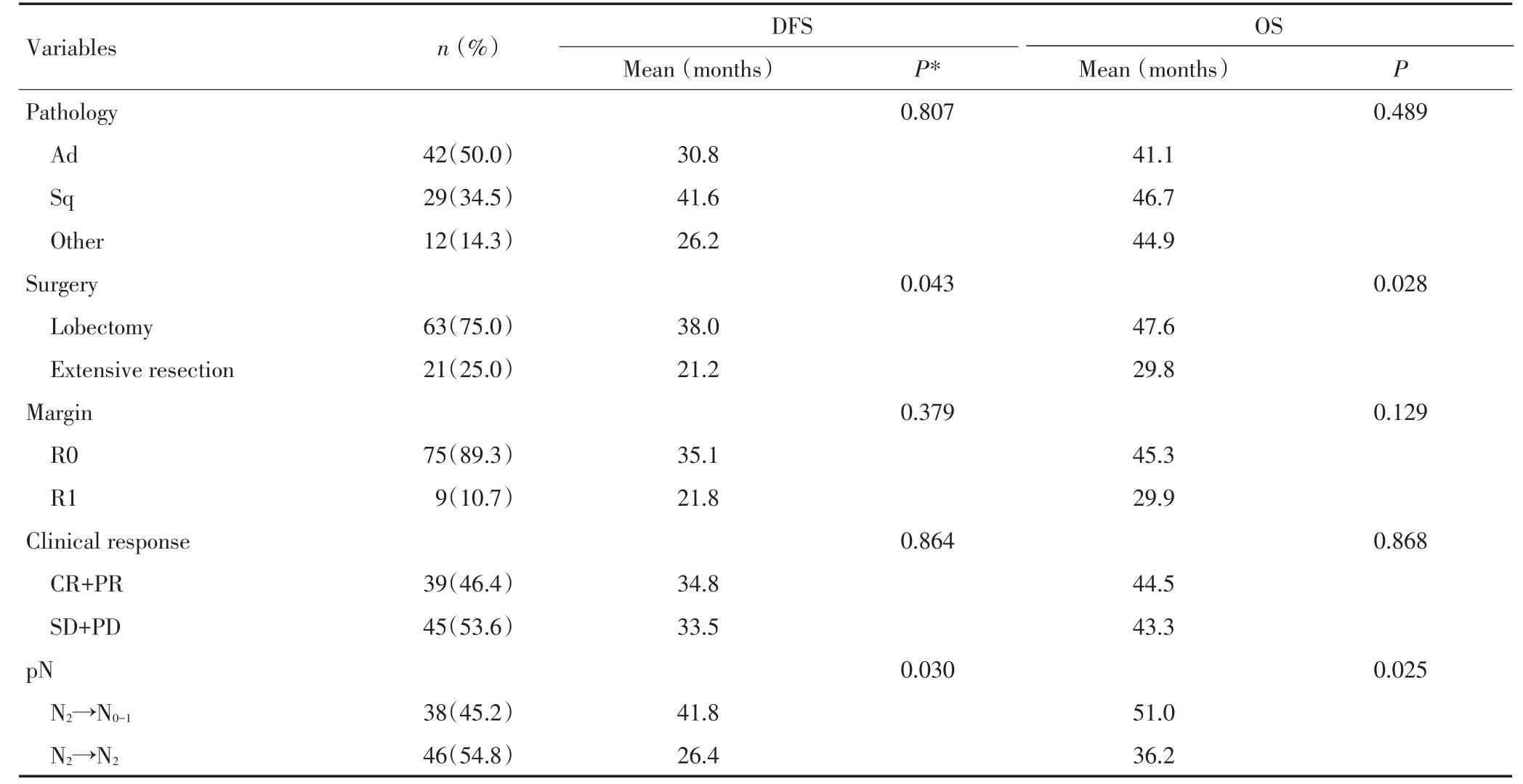
表2 相关变量的单因素分析结果(续表2)Table 2 Univariate analysis of the association of baseline characteristics and treatment-related variables with DFS and OS(n=84)
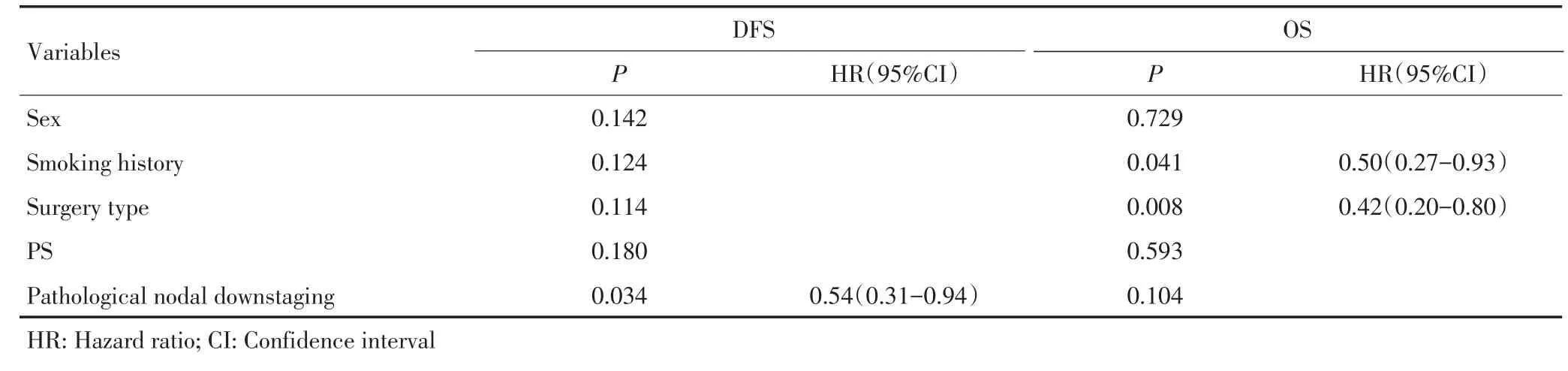
表3 Cox多因素分析Table 3 Cox multivariate analysis

图2 Log-rank法对新辅助治疗后行不同手术方式获得根治性切除的患者的生存结果进行比较Figure 2 Comparisons of survival between patients performed with vari⁃ous radical resections after induction therapy by log-rank methods
3 讨论
术前新辅助治疗的疗效评定主要有新辅助治疗前后的影像学评估CR以及术后病理学反应和纵隔降期。美国NCCN 2015年第1版提示对新辅助化疗后未出现进展的ⅢA-N2NSCLC患者可行手术切除[5]。先前的研究结果显示新辅助治疗后的临床反应率为25%~74%,新辅助治疗术后病理性降期率达19%~67%[3,10-13]。本研究结果显示新辅助化疗/化放疗能有效降低肿瘤负荷PR占46.4%,病理性纵隔淋巴结降期pN2-pN0-1达45.2%。然而相关研究表明,新辅助治疗前后临床反应率和病理反应率之间无明显相关性[2],而病理性降期能够很好的反映患者的预后[10,12]。本研究结果显示:临床反应(CR+PR)与无反应(SD+PD)组之间OS(P=0.865)和DFS(P=0.208)差异均无统计学意义。另外,病理反应也和预后密切相关,甚至有建议以此作为研究终点替代耗时较长、花费高昂的前瞻性研究[14]。本研究结果显示病理性降期组在OS(P=0.024)与DFS(P=0.025)方面均明显优于未降期组。Cox多因素分析显示病理性降期可预示更好的DFS结果(HR 0.54,95%CI:0.31~0.94)。然而Toyokawa等[15]一项Ⅲ期临床试验却发现病理反应及纵隔降期并未带来更好的生存获益,这可能与该试验中较低的完整切除率和较高的全肺切除率有关。
单纯外科切除对于伴有同侧纵隔淋巴结转移(ⅢAN2)的局部晚期非小细胞肺癌的效果较差。ⅢA-N2期NSCLC具有异质性,纵隔淋巴结受累的组数(单组或多组)、淋巴结大小(镜下浸润或明显浸润肿大)及有无融合均影响患者的预后[16]。目前多推荐多学科综合治疗,然而对于可切除的ⅢA-N2的患者,根治性化放疗和新辅助放化疗结合手术切除何者更能使患者获益目前尚未定论[17]。
最近,一项回顾性研究表明新辅助化放疗结合手术切除优于根治性化放疗,更有利于减少局部-区域复发和远处转移[4]。本研究回顾总结了新辅助结合手术切除的多学科综合治疗ⅢA-N2期NSCLC,结果表明:3年和5年OS分别为57.7%和34.2%,高于先前的前瞻性临床试验(5年OS为27%),可能与其较高全肺切除比例有关(16例术后死亡中有14例死于全肺切除)[18];本结果与其他一些研究相当[3,19]。
另外,本研究发现新辅助治疗后行标准肺叶切除(平均生存时间47.6个月)的患者要比行扩大性切除(平均生存时间29.8个月)预后好,在OS(P=0.023)和DFS(P=0.036)方面均有明显差异。Cox多因素分析显示新辅助后行肺叶切除是获得OS提高的预测因子(HR 0.54,95%CI:0.31~0.94)。与R1切除相比R0切除组预后较好(平均生存时间45.3 vs.29.9个月),但差异无统计学意义(P=0.118),这很大程度上与本研究中术后R1切除比例较低(9/84,10.7%)有关。行标准肺叶切除3年和5年OS分别为61.7%和42.8%。当去除R1病例数据后,这一差异更高:行标准肺叶切除(平均生存时间48.9个月)的患者要比行扩大性切除(平均生存时间31.7个月)预后更好,OS(P=0.016)和DFS(P=0.022)差异也更加显著。获得根治性标准肺叶切除的患者3年和5年OS更是分别高达64.1%和44.2%。以上结果表明,对于ⅢA-N2期NSCLC患者,新辅助结合手术治疗对于诱导治疗后预计能够行根治性肺叶切除手术的患者极为推荐,这与先前的一些研究相一致[18,20]。但本研究为单中心的回顾性研究且缺乏对照组,存在一定局限性。
新辅助治疗能够有效降低肿瘤负荷,降低病理分期,提高潜在的手术切除率。新辅助结合手术治疗ⅢA-N2期NSCLC可行性强,患者能够从诱导治疗后发生病理性降期及根治性肺叶切除中获益。
[1] Roth JA,Fossella F,Komaki R,et al.A randomized trial compar⁃ing perioperative chemotherapy and surgery with surgery alone in resectable stageⅢA non-small-cell lung cancer[J].J Natl Can⁃cer Instl,1994,86(9):673-680.
[2] Roth JA,Atkinson EN,Fossella F,et al.Long-term follow-up of patients enrolled in a randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stageⅢA non-small-cell lung cancer[J].Lung Cancer.1998,21(1):1-6.
[3] Ettinger DS,Wood DE,Akerley W,et al.Non-small cell lung cancer,version 1.2015[J].J Natl Compr Cancer Netw,2014,12 (12):1738-1761.
[4] Albain KS,Swann RS,Rusch VW,et al.Radiotherapy plus che⁃motherapy with or without surgical resection for stageⅢ nonsmall-cell lung cancer:a phaseⅢrandomised controlled trial[J]. Lancet,2009,374(9687):379-386.
[5] Lorent N,De Leyn P,Lievens Y,et al.Long-term survival of sur⁃gically stagedⅢA-N2 non-small-cell lung cancer treated with surgical combined modality approach:analysis of a 7-year pro⁃spective experience[J].Ann Oncol,2004,15(11):1645-1653.
[6] Ramnath N,Dilling TJ,Harris LJ,et al.Treatment of stageⅢnon-small cell lung cancer:Diagnosis and management of lung cancer,3rd ed:American College of Chest Physicians evidencebased clinical practice guidelines[J].Chest.2013,143(5 Suppl): e314-340.
[7] Kocher F,Pircher A,Mohn-Staudner A,et al.Multicenter phase II study evaluating docetaxel and cisplatin as neoadjuvant induc⁃tion regimen prior to surgery or radiochemotherapy with docetax⁃el,followed by adjuvant docetaxel therapy in chemonaive pa⁃tients with NSCLC stageⅡ,ⅢA andⅢB(TAX-AT 1.203 Tri⁃al)[J].Lung Cancer,2014,85(3):395-400.
[8] Darling GE,Li F,Patsios D,et al.Neoadjuvant chemoradiation and surgery improves survival outcomes compared with defini⁃tive chemoradiation in the treatment of stageⅢA N2 non-smallcell lung cancer[J].Eur J Cardiothorac Surg,2015,6.[Epub ahead of print].
[9] Donington JS,Pass HI.Surgical resection of non-small cell lung cancer with N2 disease[J].Thorac Surg Clin,2014,24(4):449-456.
[10]NSCLC Meta-analysis Collaborative Group.Preoperative chemo⁃therapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data[J].Lancet,2014,383 (9928):1561-1571.
[11]Koshy M,Fedewa SA,Malik R,et al.Improved survival associat⁃ed with neoadjuvant chemoradiation in patients with clinical stage IIIA(N2)non-small-cell lung cancer[J].J Thoracic Oncol,2013,8 (7):915-922.
[12]Askoxylakis V,Tanner J,Kappes J,et al.Trimodal therapy for stageⅢ-N2 non-small-cell lung carcinoma:a single center ret⁃rospective analysis[J].BMC cancer,2014,14:572.
[13]Katakami N,Tada H,Mitsudomi T,et al.A Phase 3 Study of In⁃duction Treatment With Concurrent Chemoradiotherapy Versus Chemotherapy Before Surgery in Patients With Pathologically Confirmed N2 StageⅢA Nonsmall Cell Lung Cancer(WJ⁃TOG9903)[J].Cancer,2012,118(24):6126-6135.
[14]Margaritora S,Cesario A,Galetta D,et al.Ten year experience with induction therapy in locally advanced non-small cell lung cancer(NSCLC):is clinical re-staging predictive of pathological staging[J]?Euro J Cardiothorac Surg,2001,19(6):894-898.
[15]Toyokawa G,Takenoyama M,Ichinose Y.Multimodality treat⁃ment with surgery for locally advanced non-small-cell lung can⁃cer with n2 disease:a review article[J].Clin Lung Cancer,2015, 16(1):6-14.
[16]Vansteenkiste J,Betticher D,Eberhardt W,et al.Randomized con⁃trolled trial of resection versus radiotherapy after induction che⁃motherapy in stageⅢA-N2 non-small cell lung cancer[J].J Tho⁃racic Oncol,2007,2(8):684-685.
[17]Van Meerbeeck JP,Van Schil PE,Senan S.Reply:Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stageⅢA-N2 non-small cell lung cancer[J].J Thoracic Oncol,2007,2(12):1138-1139.
[18]Peer M,Stav D,Cyjon A,et al.Morbidity and mortality after ma⁃jor pulmonary resections in patients with locally advanced stage IIIA non-small cell lung carcinoma who underwent induction therapy[J].Heart Lung Circ,2015,24(1):69-76.
[19]Betticher DC,Hsu Schmitz SF,Totsch M,et al.Prognostic factors affecting long-term outcomes in patients with resected stageⅢA pN2 non-small-cell lung cancer:5-year follow-up of a phaseⅡstudy[J].Br J Cancer,2006,94(8):1099-1106.
[20]Lim HJ,Lee HY,Lee KS,et al.Predictive factors for survival in stageⅢA N2 NSCLC patients treated with neoadjuvant CCRT followed by surgery[J].Cancer Chemother Pharmacol,2015,75 (1):77-85.
(2015-04-28收稿)
(2015-05-21修回)
(编辑:杨红欣)

杨海堂 专业方向为胸部肿瘤外科的治疗。
E-mail:xyxm8889@163.com
欢迎订阅Cancer Biology&Medicine
Cancer Biology&Medicine作为肿瘤领域学术交流的平台,向国际学术界展示中国肿瘤防治研究成果,向国内肿瘤学相关专业人员介绍全球肿瘤学前沿进展。以肿瘤临床医师、基础研究人员、相关交叉学科专业人员及医学生为读者对象。
刊登稿件范畴:肿瘤表观遗传学、肿瘤干细胞生物学、分子与临床免疫学、肿瘤预防与流行病学、肿瘤标志物、肿瘤影像学、肿瘤临床试验、肿瘤靶向治疗、肿瘤生物治疗、肿瘤个体化医学与多学科综合治疗。栏目设置:述评、论著、综述、小型综述、临床指南、会议报道、病例报告、读者来信等,目前已被PubMed、PubMed Cen⁃tral、EMBASE、SCOPUS、BIOSIS Previews、DOAJ等国际数据库收录,学术与编辑质量获得国际认可。
订阅相关信息:
·主管单位:中国科学技术协会 主办单位:中国抗癌协会 主编:郝希山 刊期:季刊
·国际刊号ISSN:2095-3941 国内刊号CN:12-1431/R 邮发代号:6-173
·国内订阅价格:28元/册;全年价格:112元/4册
·国外订阅价格:50 USD/册;全年价格:200 USD/4册
·地址:天津市河西区体院北环湖西路天津市肿瘤医院C座3层 邮编:300060
·网址:www.cancerbiomed.org 邮箱:editor@cancerbiomed.org 电话:022-23522919
Clinical outcomes of neo-adjuvant therapy followed by surgical resection in 84 patients withⅢA-N2non-small cell lung cancer
Haitang YANG,Feng YAO,Yang ZHAO,Jicheng TANTAI,Heng ZHAO
Department of Thoracic Surgery,Shanghai Chest Hospital of Shanghai Jiaotong University,Shanghai 200030,China
Heng ZHAO;E-mail:h_zhao28@163.com
Objective:This work presents the therapeutic advantage of induction therapy in patients withⅢA-N2non-small cell lung cancer(ⅢA-N2NSCLC).Methods:ⅢA-N2NSCLC patients with ipsilateral mediastinal lymph node metastasis(>1 cm as shown by CT scan)who were admitted in our hospital between January 2008 and July 2013 were retrospectively analyzed.The response rates and survival outcomes of patients were presented and the prognostic factors were analyzed.Results:The 3-and 5-year overall survival (OS)rates were 57.7%and 34.2%,respectively,and the 3-and 5-year disease-free survival(DFS)rates were 37.9%and 30.5%,respectively.No significant differences in OS and DFS were observed between R0 and R1 resections(P=0.118;P=0.369),between groups who received neo-adjuvant chemo-radiotherapy and chemotherapy(P=0.771;P=0.953),between cases with and without clinical response(P=0.865;P=0.862),and among groups of different histological subtypes(P=0.685;P=0.208).However,patients with standard lobectomy or pathological nodal downstaging exhibited better OS(P=0.023 and P=0.024,respectively)and DFS(P=0.036 and P= 0.025,respectively)than those who had extensive resections or persistent N2.Univariate analysis predicted better OS and DFS for both standard lobectomy and pathological nodal donwstaging.In addition,Cox multivariate analysis revealed that only pathological nodal downstaging could be considered as a favorable prognostic factor for DFS,while non-smoking and standard lobectomy are the corresponding variables for OS.Conclusion:Neo-adjuvant therapy with platinum-based doublet is feasible and useful in tumor and pathological nodal downstaging,which potentially improved resectability and survival rates in patients withⅢA-N2NSCLC.Performing lobectomy or pathological nodal downstaging following induction therapy improved the patients'survival rate.
non-small cell lung cancer,mediastinal nodal metastasis,neo-adjuvant therapy,downstaging,surgery
10.3969/j.issn.1000-8179.20150467
上海交通大学附属胸科医院胸外科(上海市200030)
赵珩 h_zhao@163.com

