氧化应激在脓毒症所致胃肠动力障碍中的作用机制及厚朴酚干预作用的实验研究
苗 彬,张淑文,王 红,齐文杰,王 超,胡 岚,黄光伟
·作者须知·
氧化应激在脓毒症所致胃肠动力障碍中的作用机制及厚朴酚干预作用的实验研究
苗彬,张淑文,王红,齐文杰,王超,胡岚,黄光伟
目的:研究氧化应激在脓毒症所致胃肠运动障碍小鼠模型中的作用机制以及厚朴酚对其干预作用。方法:采用尾静脉注射内毒素(LPS)的方法制备脓毒症所致胃肠运动障碍小鼠模型。60只小鼠随机分为4组,对照组、模型组、厚朴酚干预组和莫沙必利干预组。厚朴酚干预组在注射LPS后30 min尾静脉注射厚朴酚15 μg/kg。莫沙必利干预组则以相同方式注射莫沙必利1.5 mg/kg。造模后12 h分别测定各组小肠传输速率、小肠平滑肌肌条自主收缩频率以及波幅。提取小肠肌条组织测定超氧化物歧化酶(SOD)活力、丙二醛(MDA)和一氧化氮(NO)含量。并以RT-PCR法测定分泌型一氧化氮合酶(iNOS)mRNA表达。结果:造模12 h后,脓毒症模型组小肠传输速率和小肠肌条自主收缩频率和波长较对照组明显减慢(P<0.05),厚朴酚和莫沙必利干预可以明显增加小肠传输速率(P<0.05),并且明显增加小肠肌条收缩频率和波长(P<0.05)。与对照组相比,模型组小肠组织SOD活力明显降低(P<0.05),MDA和NO水平显著增高(P<0.05),提示脓毒症时小肠处于过度氧化应激状态。RT-PCR结果显示注射LPS后0.5 h大鼠小肠组织iNOS mRNA的表达较对照组显著增强。结论:过度氧化应激、iNOS mRNA表达抑制是脓毒症所致胃肠运动障碍的重要发生机制。厚朴酚可以改善脓毒症所致胃肠运动障碍。拮抗氧化应激可能是其产生这一作用的机制。
脓毒症;胃肠功能障碍,厚朴酚;氧化应激;
脓毒症时胃肠道动力减退的发生机制目前仍未完全阐明。内毒素(LPS)打击下肠道局部的过度激活的炎症反应引发炎性因子、胃肠动力抑制性递质以及氧自由基的大量释放,可能是导致胃肠道动力障碍的重要原因[1]。而一氧化氮(NO)作为胃肠运动的主要抑制性递质之一,在脓毒症介导的胃肠动力障碍的过程中扮演着重要的角色[2]。
本实验观察了厚朴酚对脓毒症小鼠肠道组织氧自由基代谢的影响,以及厚朴酚对分泌型一氧化氮合酶(iNOS)的调控作用,探索了脓毒症时胃肠道运动功能障碍的发生机制以及厚朴酚的作用。
1 材料与方法
1.1实验材料健康成年雄性小鼠(沙鼠),体质量50~55 g,购自首都医科大学动物部,在首都医科大学动物室空调房间喂养,温度25℃,湿度60%,饲料为北京动物中心提供的标准饲料,饮水为瓶装自来水。莫沙必利标准品(99.5%),购自成都大西南制药股份有限公司。厚朴酚标准品(98%),购自上海研生生化试剂有限公司。超氧化物歧化酶(SOD)试剂盒,丙二醛(MDA)试剂盒,NO试剂盒均购自南京建成生物工程研究所。
1.2动物分组及模型制备和干预动物随机分为4组,分别为厚朴酚干预组、莫沙必利干预组、模型组和正常对照组,每组10只。采用尾静脉注射LPS 4 mg/kg的方法制备脓毒症小鼠模型。厚朴酚干预组:注射LPS后30 min尾静脉注射厚朴酚15 μg/kg。莫沙必利干预组:注射LPS后30 min尾静脉注射莫沙必利1.5 mg/kg。
1.3小肠碳末推进百分率测定于造模12 h后,将12%炭末混悬液0.2 mL/10 g灌胃。20 min后处死动物。剖开腹腔,分离肠系膜,剪取上端至幽门,下端至回盲部的肠管。轻轻将肠管拉直,准确量取幽门至碳末推进前沿的长度以及小肠总长度。按照公式:(从幽门部到碳末推进前沿的推进距离/沙鼠小肠总长)×100%计算小肠碳末推进百分率。
1.4离体小肠肌条收缩功能检测造模12 h后,处死动物,腹部正中切口切取一段小肠放入KRB (Krebs-bicarbonate solution)液中浸泡冲洗后,制备环行肌肌条(8 mm长,2 mm宽)。将肌条一端扣牢于浴槽中,另一端通过连接张力换能器,浴槽中持续供给95%O2和5%CO2的混合气体,且保持37℃的恒温。张力换能器信号输入BL-410电生理记录仪。调整张力(0.5~1.5 g)使肌条处于最适长度,肌条温育1 h后,以0.1M氨甲酰胆碱刺激肌条,开始记录肌条收缩波的波幅和波长。
1.5小肠组织SOD活力和MDA、NO含量的测定取小肠组织解冻称重;用冷生理盐水制成10%组织匀浆,3000 r/min离心10 min,取上清待测。采用酶还原法测定NO含量。黄嘌呤氧化酶法测定SOD活力。硫代巴比妥酸法定MDA水平。
1.6小肠组织中iNOS-mRNA表达逆转录程序:42℃保温60 min,95℃5 min,4℃1~5 min。扩增产物的定量分析:1.2%琼脂糖凝胶电泳,凝胶成像系统(quantity one software,bio-rad laboratories US)进行定量分析和照相。以目的基因条带光密度值与内对照β-actin条带光密度值的比值表示目的基因相对表达量。
2 结果
2.1大体观察发现脓毒症模型动物腹腔少量渗出,小肠肠壁充血,轻度扩张,肠蠕动与正常对照相比减弱。
2.2小肠动力学改变造模12 h后,脓毒症模型组的小肠传输速率和肌条节律性收缩的波幅和频率均较对照组明显下降。而厚朴酚干预组较脓毒症模型组明显增加。莫沙必利组也较脓毒症模型组明显增加。见图1、表1。
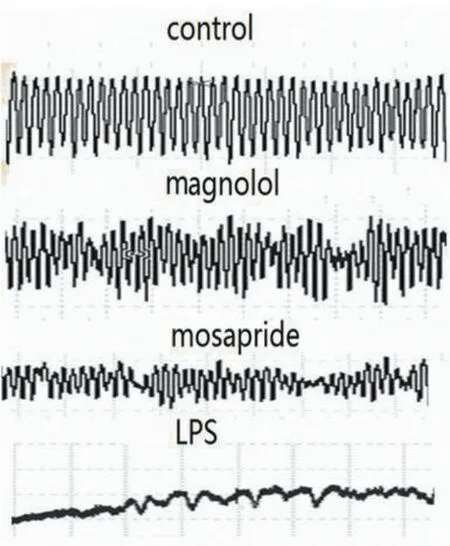
图1 厚朴酚和莫沙必利干预对脓毒症小鼠小肠肌条收缩的影响

表1 厚朴酚和莫沙必利对脓毒症小鼠小肠传输速率和自发性节律性收缩(波幅和频率)的影响(n=10)
2.3厚朴酚对于脓毒症大鼠小肠组织SOD活力和MDA、NO含量的影响与对照组相比,脓毒症模型组小鼠小肠组织SOD活力降低,NO和MDA含量显著增高。厚朴酚干预可以明显增加小肠组织SOD活力,降低NO以及MDA含量,见表2。
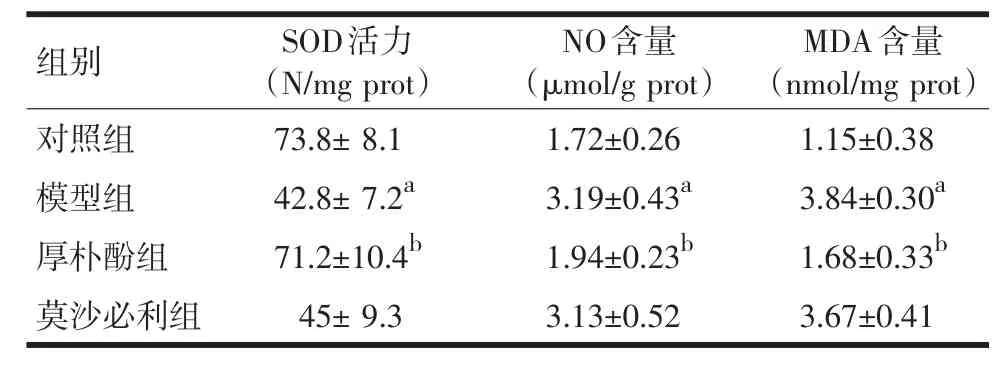
表2 厚朴酚和莫沙必利对于小肠组织SOD和MDA、NO含量的影响n=10
2.4iNOSmRNA表达RT-PCR结果显示,注射LPS后2小时小鼠小肠组织iNOS mRNA的表达显著增强(0.51±0.21 vs 0.15±0.12,aP<0.01)。厚朴酚能够明显下调iNOS mRNA的表达(0.25±0.14 vs 0.51±0.21,bP<0.01)。而莫沙必利干预后,iNOS mRNA的表达变化不显著。脓毒症模型组小鼠小肠组织iNOS mRNA的表达显著增强。厚朴酚能够下调iNOS mRNA的表达。见图2。

图2 iNOS mRNA RT-PCR电泳图
3 讨论
脓毒症时,胃肠功能障碍将导致细菌移位,加重病情甚至出现多脏器衰竭。厚朴酚(magnolol,5',5-二烯丙基-2,2'-联苯二酚)是从厚朴中提取的一种含有酚羟基的生物活性物质,具有抗炎、抗氧化、抗凝等多种药理作用[3]。研究表明,厚朴酚有干预休克和感染打击下的细胞因子调控[4],修复胃肠动力障碍的作用。现代药理学研究表明,厚朴具有抗菌、抗病毒、抗肿瘤和中枢抑制、抗过敏等作用[5]。在一些研究中,厚朴对家兔、豚鼠、小鼠离体肠管有促动作用[6]。本研究中采用小肠传输速率、小肠肌条自主收缩频率以及波幅,全面评价脓毒症对胃肠动力学的影响。结果显示,脓毒症大鼠模型表现出显著的小肠传输速率减慢、小肠肌条的收缩力减弱等小肠动力障碍的特点。而厚朴酚干预可以显著改善脓毒症介导的小肠动力障碍。本研究结果表明,厚朴有改善脓毒症所致胃肠运动障碍的功能。
研究显示,由氧自由基介导的氧化应激损伤是严重创伤、休克、脓毒症等危重病的重要病理生理特征之一[7]。强烈的氧化应激可通过脂质过氧化、蛋白变性和DNA破坏等机制引发组织细胞受损和器官功能障碍。NO是已知的胃肠运动抑制性神经递质,脓毒症时,胃肠功能障碍可能与其大量释放有关[8]。本研究中,厚朴酚能够显著提高脓毒症小鼠小肠组织SOD活力,降低MDA和NO水平,提示厚朴酚能有效抑制脓毒症导致的肠道氧化应激水平,降低氧自由基的活性。NO是以L-精氨酸(L-Arg)为底物,由一氧化氮合酶(NOS)催化生成的,NOS分为原生型NOS(cNOS)和诱导型NOS(iNOS),研究已证实由iNOS介导产生的NO对于内毒素导致的胃肠动力障碍具有重要作用[9],本研究显示,厚朴酚可以显著抑制脓毒症大鼠小肠组织iNOS mRNA的表达。
脓毒症时胃肠动力障碍与LPS和肠道组织的氧化应激等因素有关。厚朴酚干预可以抑制肠道的氧化应激反应。研究发现,厚朴酚具有清除1,1-二苯基-2-苦味肼基自由基活性,结果证实了厚朴酚具有抗氧化作用[10]。通过与经典的抗氧剂(抗坏血酸)相比较,厚朴酚对H2O2的清除作用要明显强于前者,这说明厚朴酚是潜在的氧自由基清除药物。近来发现厚朴酚能够通过抑制叔丁基氢过氧化物诱导的氧化应激,减少细胞内ROS生成、防止GSH的缺失并进而保护细胞内抗氧化防御系统以及抑制脂质过氧化等从而发挥肝细胞保护作用[11-12]。另外,有报道显示厚朴酚抑制脂质过氧化能力是维生素E的1000倍[13],是谷胱苷肽的5000倍,而且能够有效抑制氧自由基的活性。
此外我们对比研究了厚朴酚和莫沙必利的胃肠促动作用异同。厚朴酚和莫沙必利在促进脓毒症小鼠胃肠传输率和小肠平滑肌收缩频率和波长中具有相同的作用。Okamura等的研究也发现,在动物试验中,莫沙必利显著增高胃壁及小肠肌肉的电刺激收缩波幅,增加了收缩期波峰的数量及收缩周期的推进速度[14-15]。但是两者修复脓毒症时的胃肠功能损伤,促进胃肠运动的机制是不一样的。莫沙必利是通过促使胃肠壁内肽能神经元释放乙烯胆碱,增强胃肠平滑肌收缩的波长和频率的,而厚朴酚的作用机制尚未完全明了。
[1]Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome, and associated costs of care[J].Crit Care Med,2001,29(7): 1303-1310.
[2]Torihashi S,Ozaki H,Hori M,et al.Resident macrophages activat⁃ed by lipopolysaccharide suppress muscle tension and initiate in⁃flammatory response in the gastrointestinal muscle layer[J].Histo⁃chem Cell Biol,2000,113(2):73-80.
[3]de Winter BY,van Nassauw L,de Man JG,et al.Role of oxidative stress in the pathogenesis of septic ileus in mice[J].Neurogastro⁃enterol Motil,2005,17(2):251-261.
[4]Yang TC,Zhang SW,Sun LN,et al.Magnolol attenuates sepsis-in⁃duced gastrointestinal dysmotility in rats by modulating inflammato⁃ry mediators[J].World J Gastroenterol,2008,14(48):7353-7360.
[5]Zhao C,Liu ZQ.Comparison of antioxidant abilities of magnolol and honokiol to scavenge radicals and to protect DNA[J].Biochim⁃ie,2011,93(10):1755-1760.
[6]Zhen YH,Fang R,Ding C,et al.Efficacy of specific IgY for treat⁃ment of lipopolysaccharide-induced endotoxemia using a mouse model[J].J Appl Microbiol,2011,111(6):1524-1532.
[7]Jeong SI,Kim YS,Lee MY,et al.Regulation of contractile activity by magnolol in the rat isolated gastrointestinal tracts[J].Pharma⁃col Res,2009,59(3):183-188.
[8]Kajita S,Ito C,Kawamura R,et al.Pharmacological characteriza⁃tion of a novel 5-HT4 receptor agonist,TS-951,in vitro[J].Phar⁃macology,2001,63(1):8-16.
[9]Shen JL,Man KM,Huang PH,et al.Honokiol and magnolol as multifunctional antioxidative molecules for dermatologic disorders [J].Molecules,2010,15(9):6452-6465.
[10]Feldstein AE,Miller SM,El-Youssef M,et al.Chronic intestinal pseudoobstruction associated with altered interstitial cells of cajal networks[J].J Pediatr Gastroenterol Nutr,2003,36(4):492-497.
[11]Beckett EA,Ro S,Bayguinov Y,et al.Kit signaling is essential for development and maintenance of interstitial cells of Cajal and electrical rhythmicity in the embryonic gastrointestinal tract[J]. Dev Dyn,2007,236(1):60-72.
[12]Roskoski R,Jr.Signaling by Kit protein-tyrosine kinase--the stem cell factor receptor[J].Biochem Biophys Res Commun,2005, 337(1):1-13.
[13]Horvath VJ,Vittal H,Lorincz A,et al.Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in mu⁃rine diabetic gastroparesis[J].Gastroenterology,2006,130(3): 759-770.
[14]Kong CW,Tsai K,Chin JH,et al.Magnolol attenuates peroxida⁃tive damage and improves survival of rats with sepsis[J].Shock, 2000,13(1):24-28.
[15]Gonzalo S,Grasa L,Arruebo MP,et al.Lipopolysaccharide-in⁃duced intestinal motility disturbances are mediated by c-Jun NH2-terminal kinases[J].Dig Liver Dis,2011,43(4):277-285.
(收稿:2014-11-26修回:2015-07-12)
(责任编辑张淑坤屈振亮)
计量单位的具体要求
组合单位符号中表示相除的斜线多于1条时应采用负数幂的形式表示,组合单位中斜线和负数幂亦不可混用,如ng/kg/min应采用ng·kg-1·min-1的形式,不宜采用ng/kg-1·min-1的形式。量的符号一律用斜体字,如吸光度(旧称光密度)的符号为斜体字“A”。在叙述中应先列出法定计量单位数值,括号内写旧制单位数值;如果同一计量单位反复出现,可在首次出现时注出法定与旧制单位换算系数,然后只列法定计量单位数值。血压仍以mmHg表示。参量及其公差均需附单位,当参量与其公差的单位相同时,单位只写一次,如:“750.4 ng/L±18.2 ng/L”可以写作“(750.4±18.2)ng/L”。
Magnolol Pretreatment Prevents from Sepsis-induced Intestinal Dysmotility by Corrective Oxidative Stress
MIAO Bin,ZHANG Su-wen,WANG Hong,et al.Department of Infection Medicine,Capital University of Medicine Affiliated Beijing Friendship Hospital,Beijing(100050),China
ObjectiveTo investigate the mechanism by which magnolol treatment prevents from sepsis-in⁃duced dysmotility in LPS-treated mice and role of oxidative stress.MethodsSepsis was induced by intrave⁃nous tail vein injection of LPS.Sixty mice were divided into four groups:the magnolol-treated septic group,the mosapride-treated septic group,the placebo-treated septic group,and the placebo-treated sham-operated group. Intestinal transit and circular smooth muscle contraction were measured 12 h after LPS injection,and the mRNA levels of iNOS were determined by RT-PCR.NO content,superoxide dismutase(SOD)activity,and malondialde⁃hyde(MDA)concentration were detected using commercial kits.ResultsIntestinal transit and muscular con⁃tractility were significantly lower in the LPS-treated group than in the control group.In LPS-treated animals, magnolol pretreatment significantly accelerated intestinal transit(P<0.05),increased circular muscle contrac⁃tion(P<0.05).In addition,NO concentration and iNOS expression were significantly increased in the LPS-treated group compared with the control group(P<0.05).Furthermore,SOD activity was significantly re⁃duced and MDA concentration was significantly increased in the LPS-treated group compared with the control group(P<0.05).Magnolol pretreatment prevented the sepsis-induced increase in NO concentration,iN⁃OS expression,and MDA concentration,and de⁃crease in SOD activity in LPS-treated animals(P<0.05).ConclusionThe laboratory results suggest⁃ed that magnolol treatment can prevent from sep⁃sis-induced intestinal dysmotility by regulating oxidative stress.
Sepsis;intestinal dysmotility;magnolol;oxidative stress
Q95-33;R631
A
1007-6948(2015)04-0369-04
10.3969/j.issn.1007-6948.2015.04.010
国家自然科学基金(81173411);北京市科技计划(Z141100002114004);北京市自然科学基金(7152044)
首都医科大学附属北京友谊医院感染内科(北京 100050)
苗彬,E-mail:miaobin0105@126.com

