盐胁迫对2株深色有隔内生真菌(DSE)生长及营养代谢的影响
邓 勋,宋小双,尹大川,宋瑞清
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040;2.东北林业大学 林学院,黑龙江 哈尔滨 150040)
盐胁迫对2株深色有隔内生真菌(DSE)生长及营养代谢的影响
邓 勋1,宋小双1,尹大川2,宋瑞清2
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040;2.东北林业大学 林学院,黑龙江 哈尔滨 150040)
采用菌物学、生物化学等方法,对樟子松根部深色有隔内生真菌(DSE)D011和D014的分类地位进行分子验证,并从菌株生长和营养代谢的角度研究了DSE对盐胁迫的响应。结果表明:1)菌株D011和D014的ITS序列分别与Phialocephala. fortinii(D011)和P.helvetica(D014)相似度达到95%, GenBank登录号分别为KF973196和KF973192;2)在NaCl和Na2SO4胁迫条件下,DSE菌株D011和D014的生长和营养代谢与盐浓度呈明显的相关性,不同盐浓度条件下差异显著(p<0.05),在CNaCl≤0.4 mol/L和CNa2SO4≤0.2 mol/L 的低中浓度盐胁迫条件下,D011和D014菌丝生长和对碳、磷相对利用率受抑制程度均较低,生长速率同对照相比相差不大,随着盐胁迫浓度的增高(CNaCl≥0.5 mol/L和CNa2SO4≥0.3 mol/L),菌株生长受到明显抑制,代谢缓慢。菌株间比较,DSE菌株D014的耐盐性好于菌株D011。
深色有隔内生真菌;樟子松;盐胁迫;菌丝生长;营养代谢
化学药剂的过度使用会导致土壤微生态环境破坏、苗木长势不良以及有害生物的抗药性等问题,因此现代林业的发展要求减少化学药剂的使用,以降低对生态环境的破坏。在当前提倡的土壤保健和植物保健技术等土壤生物修复和生态调控理念中,通过引入植物根际有益微生物,可以改善土壤环境,促进苗木生长,提高植物抗逆性。
深色有隔内生真菌(DSE)是植物根部的内生菌,在高寒、干旱、污染土壤以及盐碱环境等极端和逆境环境下均可与宿主植物形成互惠的共生关系,在促进植物生长、改善矿物质吸收、防治病害生物、提高植物抗逆性等方面作用显著,同其他根际益生菌[1]相比,其共生结构更具优势。DSE在相对极端的环境中的普遍存在及其对此类环境的适应,得到了大多数研究结果[2-4]的支持。真菌细胞壁中的黑色素可增强细胞壁的机械强度,赋予细胞抗热、抗辐射的能力,在极端温度和干旱条件下保护DSE菌丝,扩大它们的生态位,DSE在宿主的逆境耐受中所起的作用依赖于宿主植物的整体适应性和DSE在宿主生长或营养方面提供的有益促进。DSE从植物根部延伸出的粘质菌丝可帮助植物在干旱环境中维持水分和营养的运输,同时可以耐受干旱和高温环境的胁迫[5-8],这在宿主自身耐旱能力[9]基础上可进一步增强其抗逆性。
樟子松Pinus sylvestrisvar.mongolica是我国北方主要造林树种,在生态建设、环境修复方面发挥重要作用[10-11]。本研究对从樟子松根部分离得到的深色有隔内生真菌在盐胁迫条件下的生长和营养代谢研究,为进一步研究DSE与樟子松的互作机制提供理论基础。
1 材料与方法
1.1 试验菌株
深色有隔内生真菌D011和D014分离自黑龙江省大庆市樟子松根部,初步鉴定为Phialocephala fortinii(D011)和P.helvetica(D014),属于Phialocephala fortiniis.l.-Acephala applanataspecies complex (PAC) ,为典型的针叶树种根部深色有隔内生真菌,保存于东北林业大学森林微生物实验室。
1.2 试验用培养基
1)基础培养基为PDA和PD培养基。
2)不同盐浓度培养基:NaCl浓度分别设置为 0.1、0.2、0.3、0.4、0.5、0.6、0.7 和 0.8 mol/L,Na2SO4浓度分别设置为0.1、0.2 、0.3 、0.4 和0.5 mol/L。
不同盐浓度PDA平板培养基的制备:将高压湿热灭菌(121 ℃,20 min)的PDA培养基晾至50℃左右时,分别加相应量的NaCl和Na2SO4溶液制成不同浓度盐含量的PDA培养基后倒平板。
不同盐浓度PD培养基的制备:将PD培养基分装于250 mL的三角瓶内,每瓶100 mL,同时加入相应量的NaCl和Na2SO4溶液制成不同浓度盐含量的PD培养基,高压湿热灭菌(121℃,25 min),备用。
1.3 菌株D011和D014分类地位的分子生物学验证
运用ITS1和ITS4引物进行PCR扩增(ITS1,5′-TCCGTAGGTGAACCTGCGG-3′;ITS4,5′-TCCTCCGCTTATTGATATGC-3′), 引 物 由 上海生工生物公司合成。PCR反应体系:10X PCR buffer 5 μL,dNTPS 5 μL,ITS1 引物 5 μL,ITS4 引物 5 μL,Taq 酶 0.75 μL,DNA 模板 2.5 μL,ddH2O 26.75 μL,总体积50 μL。PCR反应条件:94 ℃预变性 5 min,94 ℃变性 30 s,56 ℃退火 45 s,72 ℃延伸2 min,30个循环,72 ℃补平10 min。将未纯化PCR产物直接测序,对测序结果在GenBank中核酸数据库序列进行Blast分析,确定其分类地位,同时提交序列获得基因登录号,采用MEGA5.0软件中的邻接法对ITS区域(ITS1+ 5.8S +ITS2)构建系统进化树,进行亲缘关系和系统发育分析[12]。
1.4 盐胁迫下菌丝生长的测定
取在PDA培养基培养10 d的内生真菌菌落边缘直径5 mm的菌饼分别接种于不同盐分浓度的培养皿中,以不含盐PDA平板作为对照,置于25℃恒温箱内培养。每个处理3次重复,NaCl处理数为2×9×3,Na2SO4处理数为2×6×3。每天采用十字交叉法测量菌落直径,连续测量17 d,其中菌丝生长速率(mm/d)为第2天菌落直径减第1天菌落直径。
1.5 盐碱胁迫下菌丝生物量的测定
在不同盐浓度的PD培养基中,每瓶接入直径10 mm的菌饼2片,置于恒温摇床(25 ℃,150 r/min)上培养。以不含盐的PD培养作为空白对照。每个处理3次重复。NaCl处理数为2×9×3,Na2SO4处理数为2×6×3。10 d后将培养液中的菌丝体过滤,用去离子水冲洗,置于80 ℃烘箱烘至恒质量,干燥器内冷却后称菌丝体干质量。
1.6 盐碱胁迫下菌株营养代谢的测定
碳和磷是菌丝生长代谢所必需的营养元素,发酵液中的碳和磷含量可反映菌株生长及代谢有关情况。以初始灭菌PD培养基中碳和磷含量为100%,计算各个处理10 d内碳和磷的相对消耗量。发酵液碳含量通过对可溶性糖含量来反映。在液体培养10 d后,取滤除菌丝的发酵液,每瓶吸取发酵液10 mL备用,并测定发酵液中可溶性糖和磷含量。糖含量的测定采用蒽酮比色法[13],磷含量的测定采用钼锑抗比色法[14]。
1.7 数据统计及分析方法
运用SPSS13.0软件、采用Duncan方法对试验数据进行单因素方差分析,运用Excel2007进行菌株生长曲线非线性拟合,其中Y代表菌落直径(mm),X代表培养时间(d),用origin8.0作图。
2 结果与分析
2.1 菌株D011和D014分类地位的分子生物学验证
深色有隔内生真菌D011和D014是从黑龙江省大庆盐碱地区樟子松根部分离得到的菌株,在PDA培养基上生长。菌株D014形成圆形黑色菌落,背部黑色,气生菌丝较少,菌落边缘有辐射状纹沟,呈树枝状,深入培养基;菌株D011菌落灰黑色,背部黑色,菌落全缘细密,边缘菌丝深入培养基,均未见分生孢子(见图1)。通过测定两菌株的ITS序列,并对其分类地位进行验证,D011和D014的ITS序列PCR产物长度分别为526 bp和538 bp,使用MEGA5.0软件的邻接法构建系统进化树,D011和D014与P. fortinii和P.helvetica序列相似率高达95%,将序列提交到GenBank,获得基因登录号,分别为KF973196和KF973192(见图2)。

图 1 D011和D014菌落形态Fig. 1 Colonial morphology of D011 and D014
2.2 盐胁迫对深色有隔内生真菌生长模式的影响
NaCl胁迫:对2种DSE在不同浓度NaCl培养基上生长的菌落直径做连续测定,并对数据作非线性拟合,结果表明,2种DSE在不同NaCl处理下的菌落直径增长均为典型“S” 生长曲线,但不同菌种在不同浓度的NaCl处理下表现出不同的生长特性(见图3、 4、 5、 6)。在轻度NaCl胁迫条件(CNaCl≤0.3 mol/L)下,D011和D014的生长受到抑制较小,同对照差异不明显;随着浓度的增高,在中度NaCl胁迫条件(0.4 mol/L≤CNaCl≤0.6 mol/L)下,经过短暂的适应期后,菌丝开始缓慢生长,菌落形态同时受到影响,菌丝较为稀疏;在重度NaCl胁迫(CNaCl≥0.7 mol/L)下,2株DSE的生长均受到明显抑制,17 d后其菌落直径分别为20.0 mm和20.5 mm。比较2个DSE生长曲线和菌落直径测定结果,D014对NaCl胁迫的耐受性好于D011。非线性拟合方程结果显示,各类型曲线R2>0.9,表明结果可信度较高(见表1)。

图2 D011和D014遗传进化树分析Fig.2 Genetic evolutionary tree of D011 and D014

图3 不同浓度NaCl胁迫下D011的生长曲线Fig.3 Growth curves of D011 in different NaCl concentrations
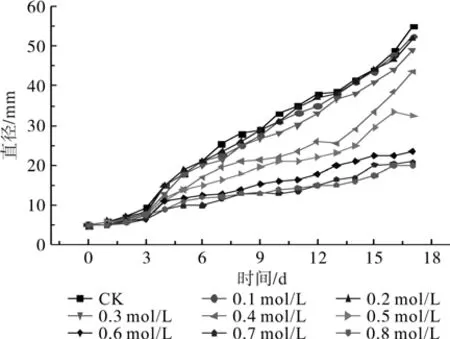
图4 不同浓度NaCl胁迫下D014的生长曲线Fig.4 Growth curves of D014 in different NaCl concentrations

图5 不同浓度NaCl胁迫下D011的生长情况Fig.5 Growth of D011 with different NaCl concentrations

图6 不同浓度NaCl胁迫下D014的生长情况Fig.6 Growth of D014 with different NaCl concentrations

表1 NaCl胁迫DSE菌株的生长曲线拟合方程Table 1 Growth models fitting of DSE with different NaCl concentrations
Na2SO4胁迫:对2株DSE在不同浓度Na2SO4培养基上生长的菌落直径做连续测定,并对数据作非线性拟合。2株DSE在不同Na2SO4处理下的菌落直径增长表现出不同的生长特性(见图7、8、9、10)。在低浓度胁迫(CNa2SO4≤ 0.2 mol/L) 下,D011和 D014生长基本呈“S”型曲线,其中D014菌落生长曲线同对照相比,差异不显著(p>0.05),而D011对Na2SO4胁迫更加敏感,与对照相比,差异显著(p<0.05)。随着胁迫程度的加深,在CNa2SO4≥0.3 mol/L时,2株菌生长受到抑制,在重度Na2SO4胁迫(CNa2SO4≥0.4 mol/L)下,菌落几乎停止生长,17 d后D011和D014在CNa2SO4=0.5 mol/L条件下,菌落直径分别为18.5 mm和20.5 mm。该结果表明,轻中度Na2SO4胁迫(CNa2SO4≤0.2 mol/L)对D011和D014生长几乎无影响,偏重度Na2SO4胁迫对DSE生长具有明显的抑制作用,同时影响菌落形态,菌丝较为稀疏。菌株间比较,菌株D014比D011表现出更强的Na2SO4胁迫耐受性。非线性拟合方程结果显示,各类型曲线R2>0.9,表明结果可信度较高(见表2)。

图7 不同浓度Na2SO4胁迫下D011的生长曲线Fig.7 Growth curves of D011 with different Na2SO4 concentrations

图8 不同浓度Na2SO4胁迫下D014的生长曲线Fig.8 Growth curves of D014 with different Na2SO4 concentrations

图9 不同浓度Na2SO4胁迫下D011的生长情况Fig.9 Growth of D011 with different Na2SO4 concentrations

图10 不同浓度Na2SO4胁迫下D014的生长情况Fig.10 Growth of D014 with different Na2SO4 concentrations

表2 Na2SO4胁迫DSE菌株的生长曲线拟合方程Table 2 Growth models of DSE with different Na2SO4 concentrations
2.3 盐胁迫对深色有隔内生真菌生长速率的影响
NaCl胁迫:不同的NaCl浓度对2种DSE的生长速度影响不同(见图11),随着 NaCl浓度的升高,2种DSE生长速度都有明显的下降趋势,但不同的菌株其生长速度降低的趋势不同。当NaCl 浓度为0.8 mol/L时,D011和D014生长速率降至最低,分别为0.91 mm/d和0.88 mm/d,与对照相比存在极显著差异(p<0.01),菌落稀疏,生长缓慢。菌株间单因素方差分析表明:在中低浓度条件(CNaCl≤0.6 mol/L)下D014比D011更容易适应NaCl的胁迫,生长较好,差异显著(p<0.05);而在高浓度条件(CNaCl≥0.7 mol/L)下,二者差异不显著(p>0.05)。
Na2SO4胁迫:不同浓度Na2SO4对DSE的生长速率影响不同,随着Na2SO4浓度的升高,2种DSE生长速率有明显的下降趋势(见图12)。当Na2SO4浓度为0.5 mol/L时,生长速率降至最低,分别为0.79 mm/d和0.91 mm/d,与对照相比差异极显著(p<0.01),表明DSE的生长受到了强烈的抑制。菌株间单因素方差分析表明,在中轻度Na2SO4胁迫(CNa2SO4≤ 0.2 mol/L)下,D014和D011生长速率之间差异显著(p<0.05),D014更容易适应Na2SO4胁迫;而在高浓度条件(CNa2SO4≥0.3 mol/L)下,二者差异不显著(p>0.05)。
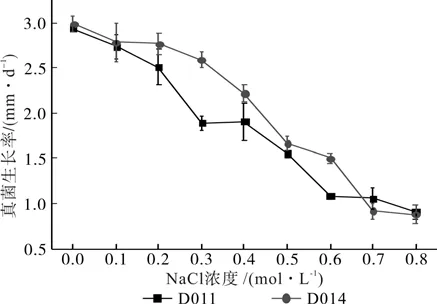
图11 不同浓度NaCl胁迫下DSE的生长率Fig.11 Growth rates of DSE with different NaCl concentrations

图12 不同浓度Na2SO4胁迫下DSE的生长率Fig.12 Growth rates of DSE with different Na2SO4 concentrations
2.4 盐胁迫对深色有隔内生真菌生物量的影响
NaCl胁迫:不同浓度NaCl对2种DSE生物量均有不同程度的影响,生物量与NaCl浓度呈负相关(见图13)。其中0.1~0.3 mol/L NaCl浓度下,生物量在本区间内下降不明显,表明在轻度NaCl胁迫条件下,2种DSE生长所受影响较小,但是菌丝形态受到严重影响,这与平板试验结果相吻合。随着NaCl浓度(CNaCl≥0.4 mol/L)的增高,DSE生长受到抑制,生物量较低,NaCl浓度为0.8 mol/L时,D011和D014生物量为0.05 g/100mL和0.08 g/100mL,基本停止生长。菌株间单因素方差分析表明,不同浓度条件下,D011和D014生物量差异不显著(p>0.05)。

图13 不同浓度NaCl胁迫下菌丝的生物量Fig.13 Biomass yields of DSE with different NaCl concentrations
Na2SO4胁迫:不同浓度Na2SO4对2种DSE生物量有较为显著的影响,生物量与Na2SO4浓度呈负相关(见图14)。中轻度胁迫下2株DSE生物量与重度胁迫下菌株生物量之间存在着显著差异(p<0.05)。在中轻度Na2SO4胁迫(CNa2SO4≤0.2 mol/L)下,菌丝生长受抑制程度较低,随着胁迫程度(CNa2SO4>0.2 mol/L)的加深,2株DSE生物量下降速率加快。在Na2SO4浓度为0.5 mol/L条件下,2株DSE生物量分别为0.05 g/100mL和0.02 g/100mL,真菌生长受到了严重的抑制,生长停止。菌株间单因素方差分析表明,不同浓度条件下,D011和D014生物量差异不显著(p>0.05)。
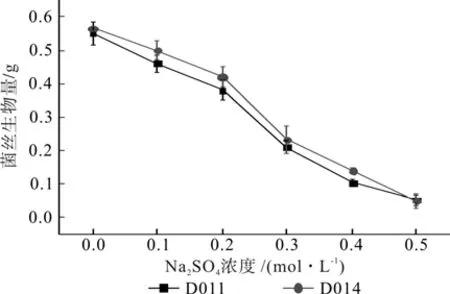
图14 不同浓度Na2SO4胁迫下菌丝的生物量Fig.14 Biomass yields of DSE with different Na2SO4 concentrations
2.5 盐胁迫对深色有隔内生真菌碳源利用的影响
NaCl胁迫:DSE对碳相对利用率随着NaCl胁迫程度的加重而下降(见图15)。不同盐浓度单因素方差分析表明,DSE对碳利用率差异显著(p<0.05)。在CNaCl≤0.3 mol/L时,D011和D014对碳元素相对利用率受NaCl胁迫影响较低;当CNaCl>0.4 mol/L时,碳相对利用率快速下降;当CNaCl=0.8 mol/L时,碳相对利用率接近0,此时DSE几乎停止生长。菌株间单因素方差分析表明,不同浓度条件下,D011和D014碳利用率差异显著(p<0.05),菌株D014表现好于菌株D011。

图15 不同浓度NaCl胁迫下碳元素相对利用率Fig.15 Relative utilization rates of C with different NaCl concentrations
Na2SO4胁迫:DSE对碳相对利用率随着Na2SO4胁迫程度的加重而下降(见图16)。不同盐浓度单因素方差分析表明,DSE对碳利用率差异显著(p<0.05)。在中轻度Na2SO4胁迫(CNa2SO4≤0.2 mol/L)下,DSE对碳的利用率较高,中轻度Na2SO4胁迫下DSE对碳吸收影响不大;当CNa2SO4>0.2 mol/L时,DSE对碳的利用快速下降;当CNa2SO4=0.8 mol/L时,碳元素相对利用率接近1%。菌株间单因素方差分析表明,不同浓度条件下,D011和D014碳利用率差异显著(p<0.05),菌株D014表现好于菌株D011。
2.6 盐胁迫对深色有隔内生真菌磷利用的影响
NaCl胁迫:同碳利用规律相同,DSE对磷相对利用率随着胁迫程度的加重而下降(见图17)。在中轻度NaCl胁迫(CNaCl≤0.3 mol/L)下,DSE对磷利用率比重度胁迫要高;当CNaCl>0.4 mol/L时,DSE对磷元素相对利用率快速下降,后接近于0,菌丝生长受到抑制。菌株间单因素方差分析表明,不同浓度条件下,D011和D014碳利用率差异显著(p<0.05),菌株D014好于菌株D011。
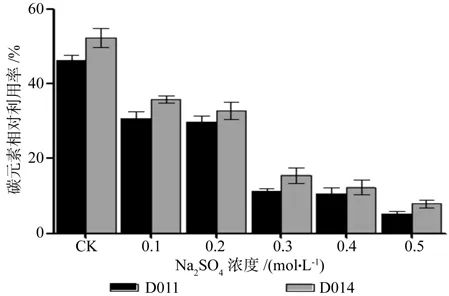
图16 不同浓度Na2SO4胁迫下碳元素相对利用率Fig.16 Relative utilization rates of C with different Na2SO4 concentrations

图17 不同浓度NaCl胁迫下磷元素相对利用率Fig.17 Relative utilization rates of P with different NaCl concentrations
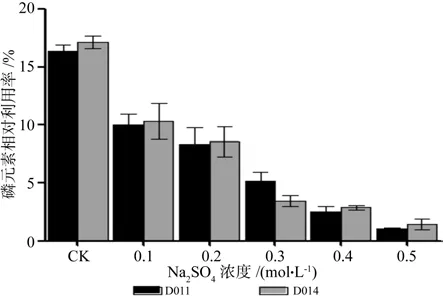
图18 不同浓度Na2SO4胁迫下磷元素相对利用率Fig.18 Relative utilization rates of P with different Na2SO4 concentrations
Na2SO4胁迫:DSE对磷相对利用率随着胁迫程度的加深而下降(见图18)。在中轻度胁迫(CNa2SO4≤0.2 mol/L)下,DSE对磷利用率相对较低;当CNa2SO4>0.2 mol/L时,菌丝体对磷元素相对利用率快速下降;当CNa2SO4=0.8 mol/L时,菌丝生长缓慢,磷元素相对利用率为2%左右。菌株间单因素方差分析表明,不同浓度条件下,D011和D014碳利用率差异显著(p<0.05),菌株D014好于菌株D011。
3 结论与讨论
通过对深色有隔内生真菌(DSE)D011和D014在不同程度盐胁迫下的生长和营养代谢的变化研究得出以下结论:
1)通过测定ITS序列,对D014和D011的分类地位进行了分子生物学验证,2株DSE分别 与P. fortinii(D011) 和P.helvetica(D014)相似度达到95%以上,序列提交后,D011和D014的GenBank登录号分别为:KF973196和KF973192。
2)D011和 D014对 NaCl和 Na2SO4均 表现出较好的耐盐性,当CNaCl≤0.4 mol/L和CNa2SO4≤0.2 mol/L时,菌株生长及营养代谢受抑制程度较低;在高浓度胁迫条件下,菌株生长受到明显抑制。
3)在盐胁迫条件下,D011和D014均能利用外界营养成分(碳和磷),但随着胁迫程度的加深,利用率降低。
4)在菌丝生长和营养代谢方面,菌株间比较,菌株D014对盐胁迫的耐受性均好于菌株D011。
利用有益微生物与植物的共生关系,提高植物的抗逆性,进行土壤环境修复改良,是近年研究的热点问题。在益生菌提高植物耐盐性研究方面,外生菌根菌如Suillus bovinus、S. luteus、Boletus luridus[15]、Laccaria bicolor和Hebeloma crustuliniforme[16]对一定浓度的盐胁迫有较强的耐受性,并且可以显著提高针叶树种的耐盐碱能力,Picea glauca和Pinus banksiana的实生苗在接种S. tomentosus、L. bicolor和H. crustuliniforme后,明显提高了2种针叶树在盐胁迫土壤上的存活率和生长量。不同菌根菌对不同树种的耐盐效果不同[17],与对照相比,针叶树种受到胁迫的伤害明显减少。深色有隔内生真菌(DSE)是植物根际的内生菌,主要特征是菌丝颜色较深,具有明显隔膜,定殖于健康植物根的表皮、皮层甚至维管束组织的细胞内或细胞间隙,形成共生体,而不引起植物病变[18-19]。同外生菌根菌相同,DSE是植物根际的益生菌,其生态功能包括提高植物养分吸收能力、提高植物对干旱和温度等逆境胁迫的抗性、抑制病原菌,防治根部病害、诱导植物产生系统抗性、抵御叶部病害和茎部病害的发生等。针叶树根部深色有隔内生真菌主要类群为Phialocephala fortiniis.l.-Acephala applanata species complex (PAC),在提高植物抗逆性方面也发挥了重要作用。目前对于DSE在矿山生态修复、重金属污染土壤修复等方面均有深入的研究。真菌的生长以及营养代谢受到环境及多方面的因素影响,Nagarajan等研究发现,适量浓度的盐对菌根真菌细胞代谢有促进作用,但是盐的含量过高,会影响细胞物质的代谢,甚至抑制菌丝的生长[20]。本文研究结果表明,在中轻度盐胁迫下,D011和D014生长较好,对碳和磷的利用率下降不十分明显,具有良好的耐盐性,该结果可以为今后开发适应逆境条件用于提高植物生长势的植物根部保健剂提供基础数据。
[1]刘幸红,牛赡光,段春华,等. 坚强芽孢杆菌 Bf-02 对核桃炭疽病的防治效果[J]. 经济林研究,2012,30(4):126-128.
[2]刘茂军,张兴涛,赵之伟. 深色有隔内生真菌(DSE)研究进展 [J]. 菌物学报 ,2009, 28(6): 888-894.
[3]Li-qin Wu, Ya-li Lv, Zhi-xia Meng. The promoting role of an isolate of dark septate fungus on its host plantSaussurea involucrataKar. et Kir [J]. Mycorrhiza, 2010, 20:127-135.
[4]Postma J W M, Olsson P A, Falkengren-Grerup U. Root colonisation by arbuscular mycorrhizal, fine endophytic and dark septate fungi across a pH gradient in acid beech forests[J]. Soil Biol. Biochem., 2007, 39:400-408.
[5]Addy H D, Piercey M M, Currah R S. Microfungal endophytes in root [J]. Canadian Journal of Botany, 2005, 83: 1-13.
[6]Barrow J R, Aaltonen R E. Evaluation of the internal colonization ofAtriplex canescens(Pursh) Nutt. roots by dark septate fungi and the in fluence of host physiological activity [J]. Mycorrhiza,2001, 11(4):199-205.
[7]Barrow J R. Atypical morphology of dark septate fungal root endophytes of Bouteloua in arid southwestern USA rangelands [J].Mycorrhiza, 2003,13(5): 239-247.
[8]Raimam M P, Albino U, CruzM F. Interaction among free-living N- fixing bacteria isolated fromDrosera villosavar.villosaand AM fungi (Glomus clarum) in rice (Oryza sativa)[J]. Applied Soil Ecology, 2007, 35:25-34.
[9]陈博雯,刘海龙,蔡 玲,等. 干旱胁迫对油茶组培苗与实生苗内源激素含量的影响[J]. 经济林研究,2013,31(2):60-64.
[10]邓 勋,宋瑞清,尹大川,等.高效木霉菌株对樟子松枯梢病的抑制机理[J].中南林业科技大学学报,2012,32(11):21-27.
[11]张文泉,闫 伟. 樟子松愈伤诱导及植株再生的初步研究[J].中南林业科技大学学报,2012,32(11):37-41.
[12]杨立宾,宋瑞清,邓 勋,等.致病疫霉生防木霉菌株筛选鉴定及生物学特性[J].东北林业大学学报,2013,41(7):118-122.
[13]鲍士旦. 土壤农化分析(3版)[M]. 北京:中国农业出版社,2000: 264-270.
[14]邹 琦. 植物生理学试验指导(1版)[M].北京:中国农业出版社 ,2000:111-112.
[15]Tang M, Sheng M, Chen H. In vitro salinity resistance of three ectomycorrhizal fungi[J]. Soil Biology and Biochemistry, 2009,41: 948-953.
[16]Bois G, Bigras F J, Bertrand A,et al. Ectomycorrhizal fungi affect the physiological responses ofPicea glaucaandPinus banksianaseedlings exposed to an NaCl gradient[J]. Tree Physiology, 2006, 9: 1185-1196.
[17]Nguyen H, Calvo Polanco M, Zwiazek J J. Gas exchange and growth responses of ectomycorrhizalPicea mariana,Picea glauca, andPinus banksianaseedlings to NaCl and Na2SO4[J].Plant Biol., 2006, 8(5):646-652.
[18]Jumpponen A. Dark septate endophytes: are they mycorrhizal? [J].Mycorrhiza, 2001, 11:207-211.
[19]Piercey M M, Graham S W, Currah R S. Patterns of genetic variation inPhialocephala fortiniiacross a broad latitudinal transect in Canada [J]. Mycol. Res., 2004, 108:955-964.
[20]Nagarajam G, Natarajan K. The use of Box-Behnken design of experiments to study in vitro salt tolerance byPisolithus tinctorius[J]. World Journal of Microbiology and Biotechnology 1999,15: 197-203.
Effects of salt stress on growth and nutritional metabolism of two dark septate endophyte (DSE)
DENG Xun1, SONG Xiao-shuang1, YIN Da-chuan2, SONG Rui-qing2
(1. Forestry Protection Institute of Heilongjiang Forestry Academy, Harbin 150040, Heilongjiang, China;2. College of Forestry, Northeast Forestry University, Harbin 150040, Heilongjiang, China)
By adopting mycology, biochemistry methods, the molecular evidence for taxonomic status ofPinus sylvestrisvar.mongolicaroots dark septate endophytic (DSE) D011, D014 was conducted. And from the perspective of strains growth and nutrition metabolism,the response of DSE fungi to salt stress was studied. The results show that (1) The ITS sequence similarity of D011 and D014 compared to that ofPhialocephala. fortiniiandP. helveticawere above 95%, the GenBank number of D011 and D014 are: KF973196 and KF973192; (2) Under the stresses of NaCl, and Na2SO4, the growth and nutritional metabolism of DSE were signi ficantly correlated to salt concentrations, under low salt concentration stress (CNaCl≤ 0.4 mol/L andCNa2SO4≤ 0.2 mol/L ), the inhibitions on strain growth and utilization rates of carbon and phosphorus were lower, and had no signi ficant different compared to the control; Under the high salt concentration stress (CNaCl≥ 0.6 mol/L andCNa2SO4≥ 0.3 mol/L) , the inhibitions on strain growth and utilization rates of carbon and phosphorus were higher. DSE strain D014 had a better salt tolerance than D011.
dark septate endophyte;Pinus sylvestrisvar.mongolicasalt; salt stress; mycelium growth; nutritional metabolism
S791.253;S718.52+1
A
1673-923X(2015)05-0001-08
10.14067/j.cnki.1673-923x.2015.05.001
2014-01-19
国家自然科学基金项目(31200484,31170597);国家“十二五”科技攻关项目专题(2012BAD19B0801);黑龙江省森工总局项目(SGZJY2010014,SGZJY2012016);“948”项目(2009-4-39)
邓 勋,研究员,博士
宋瑞清,教授,博士;E-mail:songrq1964@163.com
邓 勋,宋小双,尹大川,等. 盐胁迫对2株深色有隔内生真菌(DSE)生长及营养代谢的影响[J].中南林业科技大学学报,2015, 35(5):1-8.
[本文编校:谢荣秀]

