异丙肾上腺素对乳鼠窦房结细胞自动节律和钠钙交换电流的影响
项国剑,张建成,陈 茜,魏国良,魏芝雄,李 泱
2.福建省立医院 心内科,福州 350001;
3.解放军总医院 老年心血管病研究所,北京 100853
心脏的正常生理活动由窦房结细胞的自发性搏动调控,细胞膜上各种离子通道的复杂活动是构成窦房结细胞电生理机制的基础[1-3]。关于窦房结细胞在心脏起搏活动中离子通道的活动机制是近年来的研究热点,但目前对于乳鼠窦房结细胞的膜片钳研究在国内只见于个别学者报道[4]。目前认为,心脏的起搏活动是窦房结的两种机制共同作用的结果,即“膜钟(membrane voltage clock)”和“钙钟(calcium clock)”[5]。膜钟主要由起搏电流组成,它可引起窦房结细胞膜电位的变化,引发电压依赖性钙通道开放,使Ca2+内流,造成细胞内Ca2+浓度增加,触发肌浆网大量释放Ca2+,使细胞内Ca2+瞬间增高称为钙瞬变,同时激活钠钙交换体(sodium-calcium exchanger,NCX)正向转运模式(3个 Na+进入细胞,1个 Ca2+出 细胞)产 生 NCX 电 流(Na+/Ca2+current,INCX)。INCX是起搏电流产生和维持的一个重要组成,其在舒张末期产生内向电流,可引发动作电位[6]。INCX在窦房结起搏中的作用虽然受到关注,但该电流对窦房结节律的影响尚不清楚,另外异丙肾上腺素(isoproterenol,ISO)可显著增加细胞内Ca2+释放及钙火花频率,激发窦房结细胞活动,但ISO对NCX活动影响的研究还存在矛盾[7-8]。因此,本研究采用全细胞膜片钳技术记录了窦房结细胞自发性动作电位(action potentials,AP)和INCX,观察ISO对其影响。
1 材料与方法
1.1 动物 新生24h内Wistar大鼠乳鼠,雌雄不拘,SPF级,[斯贝福(北京)实验动物科技有限公司,许可证号:SCXK(京)2014-0002]。
1.2 试剂 DMEM细胞培养基、PBS磷酸盐缓冲液(美国Thermo公司);FBS胎牛血清(美国Invitrogen公司);胰蛋白酶1∶250、氯化镍(美国Sigma公司);HEPES(美国Amresco公司);盐酸ISO(美国Sigma公司)。
1.3 钠 钙 交 换 体 电 流 的 细 胞 外 液 (mmol/L):NaCl 140;MgCl21.0;CaCl21.0;KCl 4;HEPES 10;Glucose 5;pH值用NaOH调至7.4。记录钠钙交换体的电极内液(mmol/L):KCl 130;MgCl21.0;EGTA 5;HEPES 10;Glucose 10;Na2ATP 5。pH值用KOH 调至7.2。
1.4 窦房结细胞急性分离与培养 参照文献[9]。取乳鼠12只,仰卧位固定四肢,沿胸骨右缘剪开并去除胸前壁,暴露心脏,置于解剖显微镜下分离心包膜,轻拨移右心耳,看清上腔静脉,于界嵴中部静脉窦侧、上腔静脉根部取约1.0mm×1.0mm×1.0mm的组织块,立即置于预冷的不含血清的DMEM培养基中,冲洗2次。将所取下的组织块剪碎成0.2~0.6mm3乳糜状,加入30~50倍组织块体积的0.08%胰酶,轻柔吹打0.5min,静置沉淀后弃上清液,加入同体积的0.08%胰酶,置于37℃水浴中轻轻振荡3~5min,再次吹打0.5min,沉淀后吸取上清液,用等体积的含15%胎牛血清DMEM培养液终止消化,重复消化3~5次至基本消化成单细胞为止。将细胞悬液用400目金属滤网过滤后,940r/min离心7min,弃上清液。将离心后的细胞用含15%胎牛血清的DMEM培养液重悬,接种于培养皿内,后置培养皿于37℃、体积分数为0.05的CO2孵箱中培养90min,采用差速贴壁技术去除成纤维细胞,分离得到较纯化的窦房结细胞,并分装于培养皿内继续培养,每天换液1次。24h后于倒置显微镜下观察细胞形态并以手按计数器计数细胞收缩频率。
1.5 膜片钳形成及参数 将Axon-700B膜片钳放大器(美国 MDC公司)与计算机连接。应用Digidata 1440A数模转换器(美国MDC公司)采集刺激信号及电压输入信号,此过程均由pCLAMP10.2软件控制。GG-17玻璃毛坯经pp-83微电极拉制仪(日本NARISHIGE公司)拉制成入液电阻为2.0~5.5MΩ的电极。调节三维微操纵器进行细胞封接,使封接电阻达1GΩ以上,采用脉冲式负压抽吸法吸破细胞膜形成全细胞记录模式。利用全细胞膜片钳技术记录方法,在电流钳模式下记录AP,在电压钳模式下记录电流。测定细胞膜电容时,施以0.4V/s的 斜 坡 刺 激。电 流 值I以 电 流 密 度(pA/pF)表示以消除细胞间的误差。信号经截止频率为1kHz的四阶贝塞尔低通滤波器滤波,采样率为5kHz。为消除膜电容的充放电影响,串联电阻补偿90%~95%以消除电压偏差,液接电位补偿校正至小于2mV,慢电容补偿约为85%~90%。细胞膜电容计算方程:

1.6 干扰电流的排除 于细胞外液加入BaCl2200μmol/L阻断IK1,多非利特(Dofetilide,Dof)5nmol/L阻 断IKr,CdCl2100μmol/L 阻 断ICa,L,TTX 100μmol/L阻断INa。
1.7 统计学处理 数据处理采用pCLAMP 9.2处理,采用Spss 15.0软件进行统计学处理。数据以±s表示。多组间数据比较用ANOVA方差分析,组间两两比较用SNK-q检验。以P<0.05为差别有统计学意义。
2 结 果
2.1 培养细胞生长状况 分离培养后的窦房结细胞呈大小不等、圆形、清亮的单细胞悬浮于培养液中,4h后开始贴壁生长,后胞体逐渐增大,约17h后可见散在细胞开始搏动,48h后贴壁的搏动细胞逐渐增多,偶见融合成片的细胞进行同步搏动。于倒置显微镜下,随机选取10个视野,观察镜下细胞形态,在分离培养的乳鼠窦房结中可见梭形、三角形、多边形等3种形态的细胞,计算各形态细胞所占比例,再取平均值,即可得到该种形状细胞所占比例。通过细胞计数发现,梭形细胞比例最高,达(56.2±3.0)%,三 角 形 及 多 边 形 细 胞 分 别 为(28.2±3.0)%和(15.6±2.1)%(图1)。
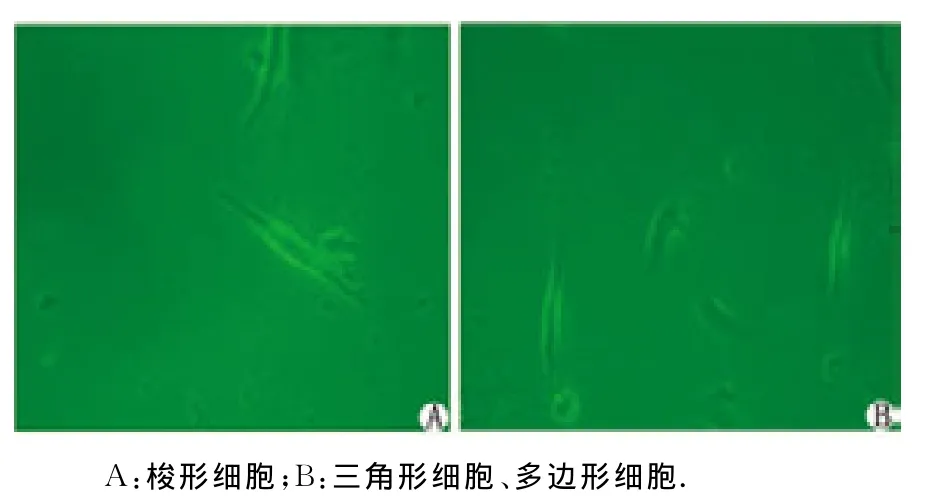
图1 乳鼠窦房结分离培养后3种细胞形态( ×100)Fig 1 Three cellular types after disassociating and culturing sino-atrial node in newborn rats( ×100)
2.2 搏动频率观察 分别选取梭形细胞、三角形细胞和多边形细胞各10个观察搏动频率,结果发现,梭形细胞的搏动频率为(147.9±9.9)min-1,三角形细胞的搏动频率为(56.5±7.8)min-1,多边形细胞搏动频率为(6.3±1.8)min-1。梭形细胞较其他两形细胞快,差别有统计学意义(P<0.01,图2)。
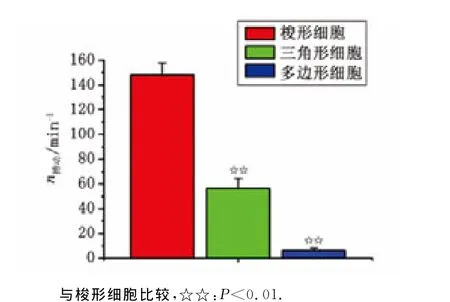
图2 乳鼠窦房结3种细胞搏动次数Fig 2 The beating rates of three kinds of cells in newborn rats’sino-atrial node.
2.3 自发性AP及ISO的作用 以ISO用药前的细胞AP次数为对照组,在电流钳模式下记录梭形细胞AP。结果发现,在无任何电流刺激下,梭形细胞可记录到自发性AP;于细胞外加入1.0μmol/L ISO后,细胞AP的发生频率明显增加,从(147.9±9.9)min-1增 加 至 (278±11.2)min-1(图3)。
2.4 窦房结细胞INCX电流 应用电压钳模式研究通道电流密度,钳制电位为-60mV,预先给予+80mV,500ms的方波刺激,紧接着以斜坡电压脉冲从+80mV以90V/s的速度去极化至-120mV,此后恢复到-60mV,记录到在去极化电压下外向电流,而超极化电压下内向电流,应用5mmol/L NiCl2阻断该电流[10],记录用药前、后的电流值,并将原始电流减去Ni2+作用后剩余电流值,即为INCX(图4)。
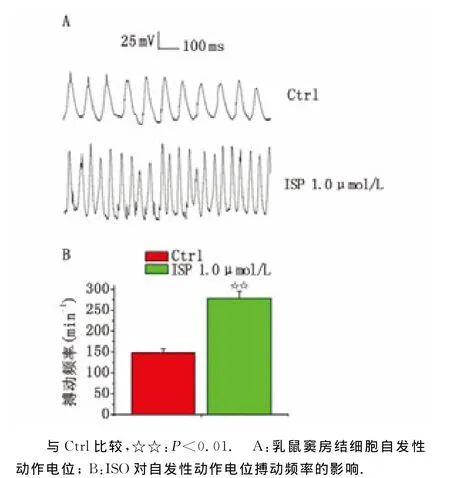
图3 ISO对乳鼠窦房结细胞自发性动作电位的影响Fig 3 The effect of ISO on spontaneous action potential in newborn rats’sino-atrial node cells.
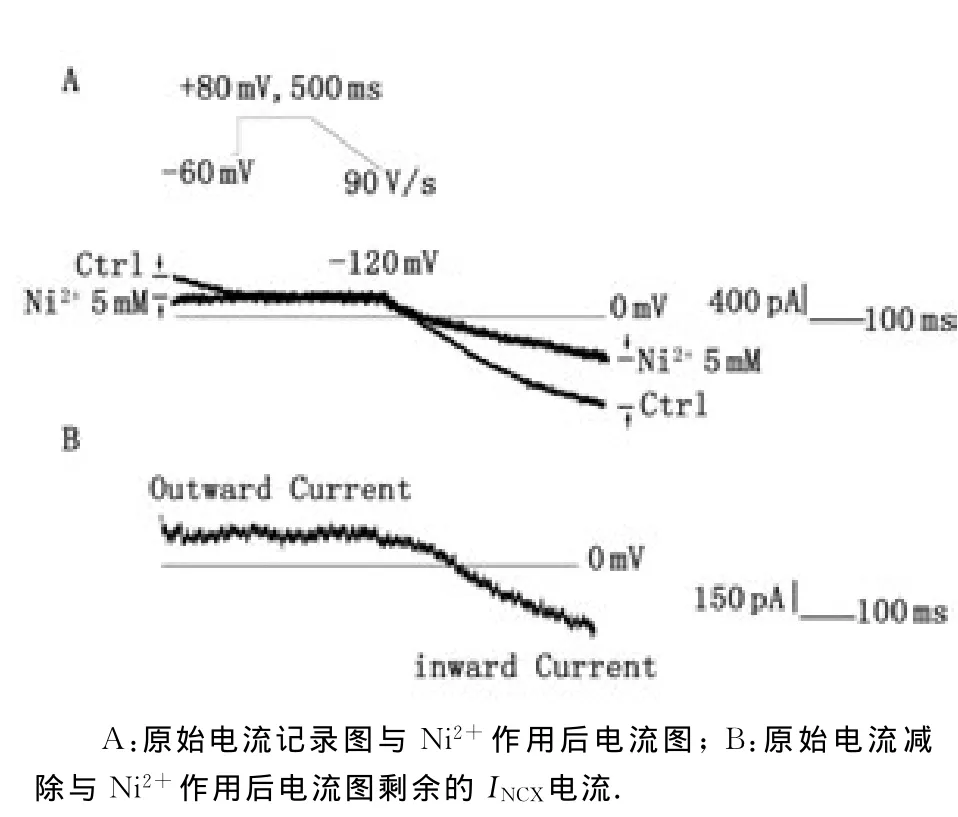
图4 乳鼠窦房结细胞INCX电流Fig 4 INCXin newborn rats’sino-atrial node cells
2.5 ISO对INCX电流的作用 以用药前INCX为空白对照组,于细胞外加入1.0μmol/L ISO。结果显示,ISO可使+80mV起始时外向INCX密度从(0.52±0.03)pA/pF增加至(0.72±0.04)pA/pF(n=10,P<0.05),平 均 增 加 约 36.7%;而-120mV时内向电流从(-3.26±0.02)pA/pF增加至(-7.81±0.06)pA/pF(n=10,P<0.01,图5)。
2.6 ISO对INCX影响的电压依赖性和浓度依赖性
将电流密度差值与相应电位作图,即得INCX电流的I-V曲线。以用药前INCX为空白对照组相对比,在负于-20mV时,ISO可使INCX内向电流显著增加,在大于0时,ISO可使INCX外向电流升高明显(图6A)。于细胞外液分别加入0.1,0.5,1.0,5.0,10.0μmol/L ISO,将用药前INCX电流密度作为标准化基线值,将其他ISO不同浓度作用后各电流密度与之比较,取相对值,可见INCX电流随ISO呈现浓度增加而依赖性升高(图6B)。
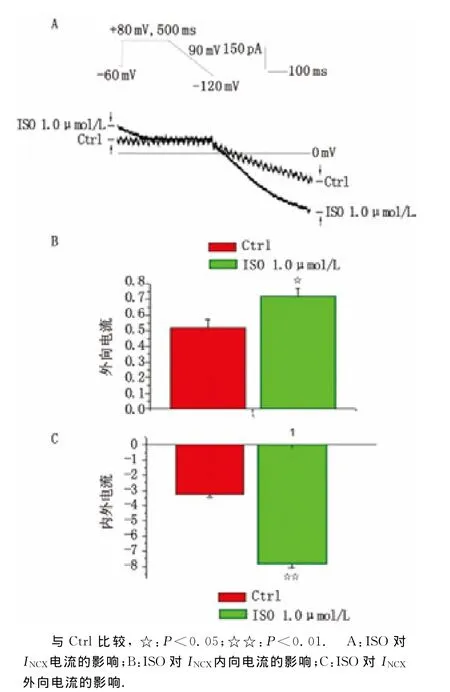
图5 ISO对乳鼠窦房结细胞INCX电流的影响Fig 5 The increasing effect of ISO on INCXin newborn rats’sino-atrial node cells.
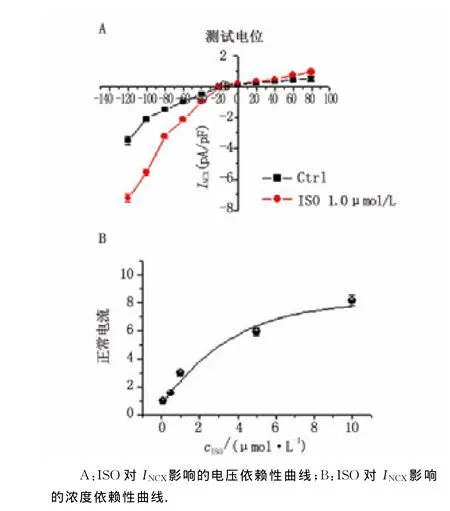
图6 ISO对INCX影响的电压和浓度依赖性Fig 6 The voltage-and concentration-dependent fashion of ISO on INCX
3 讨 论
近年来,以Ca2+释放为特征的“钙钟”在窦房结起搏活动中的作用成为研究热点,国内外有不少关于“膜钟”和“钙钟”的发生和作用机制的研究证据表明,“膜钟”(膜上离子通道周期激活和失活引起)和“钙钟”(节律性肌浆网Ca2+释放引起)共同参与调节窦房结的自律性[11]。文献显示,在胚胎干细胞分化的心肌细胞中,钠钙交换体在起搏活动中起着重要的作用[12]。2009年,Maltsev等在计算机模拟兔窦房结模型中,发现有钠钙交换体电流的参与,能使起搏活动更加稳定,且不易诱发节律失常或电活动终止[13]。
本实验发现,在乳鼠窦房结细胞上存在较大的INCX电流,该电流分为内向和外向二部分,在不同的刺激电压下其大小不同:在更正的电压下其外向电流更大,而在更负的电压下其内向电流增加明显。该电流的变化将直接影响窦房结细胞的自发性AP和起搏频率,这为该电流在心脏起搏活动中的作用提供了实验依据。2006年,Lakatta等提出INCX是窦房结细胞起搏产生和维持的一个重要组成[14],其在舒张末期产生内向电流,最终导致膜AP的产生。Lyashkov等研究发现,NCX在窦房结上的数量分布多于心房及心室肌[15]。Bogdanov等发现,抑制细胞内钙释放将限制心脏起搏细胞的自发跳动频率[16]。
目前,对于ISO是否能直接影响钠钙交换体活动还没有定论。有部分研究证实,β肾上腺素可以加强 NCX 的作用[17-18];另有学者研究发现,β肾上腺素受体/cAMP通路具有下调NCX的作用[19]。本实验发现,在ISO的作用下,INCX内向及外向电流均显著升高,且此作用呈电压依赖性及浓度依赖性特征,提示β肾上腺素受体激动可能通过调节INCX电流的大小,从而影响窦房结的自动去极化过程和起搏频率,同时ISO可能通过NCX产生正性变时作用。然而,ISO增加INCX电流是否存在频率依赖性,以及INCX电流是否受频率的影响还有待进一步研究。
[1]Mangoni M E,Nargeot J.Genesis and regulation of the heart automaticity[J].PhysiolRev,2008,88(3):919-912.
[2]Lakatta E G,Maltsev V A,Vinogradova T M.A coupled system of intracellular Ca2+clocks and surface membrane voltage clocks controls the timekeeping mechanism of the heart’s pacemaker[J].CircRes,2010,106(4):659-673.
[3]Kojima A,Kitagawa H,Omatsu-Kanbe M,etal.Inhibitory effects of sevoflurane on pacemaking activity of sinoatrial node cells in guinea-pig heart[J].BrJPharmacol,2012,166(7):2117-2135.
[4]王泽文,宋治远,姚 青.HCN4基因修饰大鼠MSCs体外诱导获得的心脏起搏样细胞动作电位检测[J].第三军医大学学报,2007,29(22):2139-2141.
[5]Gao Z,Chen B,Joiner M L.Ifand SR Ca2+release both contribute to pacemaker activity in canine sinoatrial node cells[J].JMolCellCardiol,2010,49:33-40.
[6]David A E,Elisabetta C.Beating to time:calcium clocks,voltage clocks,and cardiac pacemaker activity[J].AmJ PhysiolHeartCircPhysiol,2009,296(3):H561-H562.
[7]Mani S K,Egan E A,Addy B K,etal.Beta-adrenergic receptor stimulated ncx1upregulation is mediated via a CaMKII/AP-1 signaling pathway in adult cardiomyocytes[J].JMolCell Cardiol,2010,48:342-351.
[8]Joung B,Tang L,Maruyama M,etal.Intracellular calcium dynamics and acceleration of sinus rhythm by beta-adrenergic stimulation[J].Circulation,2009,119:788-796.
[9]汪艳丽,刘如秀,刘 宇,等.用于膜片钳研究的乳鼠窦房结细胞的分离与鉴定[J].南方医科大学学报,2013,3:189-223.
[10]Einsley J,Regina D,Alexander K.etal.β-Adrenergic regulation of a novel isoform of NCX:sequence and expression of shark heart NCX in human kidney cells[J].AmJPhysiol HeartCircPhysiol,2009,296:1994-2006.
[11]David A E,Elisabetta C.Beating to time:calcium clocks,voltage clocks,and cardiac pacemaker activity[J].AmJ PhysiolHeartCircPhysiol,2009,296(3):561-562.
[12]Zahanich I,Sirenko S G,Maltseva L A,etal.Rhythmic beating of stem cell-derived cardiac cells requires dynamic coupling of electrophysiology and Ca cycling[J].JMolCell Cardiol,2011,50(1):66-76.
[13]Maltsev V A,Lakatta E G.Synergism of coupled subsarcolemmal Ca2+clocks and sarcolemmal voltage clocks confers robust and flexible pacemaker function in a novel pacemaker cell model[J].AmJPhysiolHeartCircPhysiol,2009,296:594-615.
[14]Lakatta E G,Vinogradova T,Lyashkov A,etal.The integration of spontaneous intracellular Ca2+cycling and surface membrane ion channel activation entrains normal automaticity in cells of the heart’s pacemaker[J].AnnNYAcadSci,2006,1080:178-206.
[15]Lyashkov A E,Juhaszova M,Dobrzynski H,etal.Calcium cycling protein density and functional importance to automaticity of isolated sinoatrial nodal cells are independent of cell size[J].CircRes,2007,100(12):1723-1731.
[16]Bogdanov K Y,Maltsev V A,Vinogradova T M,etal.Membrane potential fluctuations resulting from submembrane Ca2+releases in rabbit sinoatrial nodal cells impart an exponential phase to the late diastolic depolarization that controls their chronotropic state[J].CircRes,2006,99:979-987.
[17]Han X,Ferrier G R.Contribution of Na+-Ca2+exchange to stimulation of transient inward current by isoproterenol in rabbit cardiac Purkinje fibers[J].CircRes,1995,76:664-674.
[18]Perchenet L,Hinde A K,Patel K C,etal.Stimulation of Na+/Ca2+exchange by the beta-adrenergic/protein kinase A pathway in guinea pig ventricular myocytes at 37C[J].Pfl gersArch,2000,439:822-828.
[19]Nabauer M,Morad M.Modulation of contraction by intracellular Na+via Na+/Ca2+exchange in single shark(Squalus acanthias)ventricular myocytes[J].JPhysiol,1992,457:627-637.

