不同植物油体蛋白及其油体贮藏最适温度关联研究
曾艳玲 曾晓峰 谭晓风 张党权 贺舍予,3 杨 亚
(经济林培育与保护省部共建教育部重点实验室(中南林业科技大学)1,长沙 410004)
(林业生物技术湖南省重点实验室2,长沙 410004)
(中南林业科技大学食品科学与工程学院3,长沙 410004)
不同植物油体蛋白及其油体贮藏最适温度关联研究
曾艳玲1,2曾晓峰1谭晓风1,2张党权1,2贺舍予1,3杨 亚1
(经济林培育与保护省部共建教育部重点实验室(中南林业科技大学)1,长沙 410004)
(林业生物技术湖南省重点实验室2,长沙 410004)
(中南林业科技大学食品科学与工程学院3,长沙 410004)
以仁用杏、油桐、花生、大豆、芝麻和油茶种子为试材,研究不同植物油体蛋白的组分差异,并结合其脂肪酸成分含量分析不同温度下油体贮藏效果。结果表明,前3种植物油体蛋白组分较多,而后3种植物油体蛋白组分相对较少;植物油体蛋白组分越多,油体差异个体也越多,同时某组分油体蛋白基因表达量越多,其对应大小的油体也越多;在4℃冷藏条件下植物油体均能达到一个较长时间保鲜的效果,但并不是温度越低油体贮藏效果越好,脂肪酸成分和油体蛋白综合影响植物油贮藏效果。
植物油体 油体蛋白 贮藏 温度 脂肪酸
油体蛋白是包被在油体外部的一层磷脂和蛋白质镶嵌而成的半单位膜[1],能够在种子脱水时维护油体结构稳定,促进种子萌发,并在种子发芽时提供脂酶结合位点[2-4]。Jacks等[5]通过对花生种子油体的分离和反复蛋白清洗,发现了油体中蛋白质的存在。Yastsu等[6]首次从植物种子中成功分离到油体蛋白。Vance等[7]采用分子克隆技术获得玉米种子分子质量为16.5 ku油体蛋白的cDNA克隆和序列,开启了植物种子油体蛋白结构与功能的研究[7]。目前,油体蛋白基因已从许多植物中克隆获得,其中包括玉米、拟南芥、大豆、油菜、胡萝卜、芝麻、向日葵、棉花、水稻、小麦、油茶和油桐[8-14]。近年来,国内外报道了较多关于油体蛋白的研究,尤其是利用油体蛋白融合蛋白表达外源蛋白的研究,这将在改善种子油脂品质的提高和生产外源蛋白的实际应用中起到十分重要的作用[15-16]。Hang[17]将玉米的油体蛋白基因转入油菜,玉米油体蛋白基因的mRNA仅在转基因油菜成熟种子中存在,表达量为种子总蛋白的1%,表达产物90%定位在油体上。植物种子油体蛋白表达定位,易于提取纯化等特性为应用基因工程生产外源重组蛋白研究提供新的途径。Parmenter等[18]将222 bp水蛭素基因插入拟南芥油体蛋白基因的3’端,构建以拟南芥油体蛋白基因启动子驱动的植物表达载体,用农杆菌介导的叶盘法转化油菜,经检测转基因油菜种子,证实拟南芥油体蛋白-水蛭素融合蛋白在油菜油体中表达,表达产物具有生物学活性,表达量为种子总蛋白的1%[18]。目前,利用油菜油体植物表达系统生产水蛭素已经进入商业化阶段。但是,植物油体蛋白与油脂贮存相关研究却鲜少报道。本研究选取仁用杏、油桐、花生、大豆、芝麻和油茶等经济植物,研究其油体蛋白的差异及不同温度贮存下油体变化,为后期开发油体植物表达系统奠定基础。
1 材料与方法
1.1 材料与试剂
油茶和油桐种子:本实验室选育优良品种;花生、大豆和芝麻:市售;仁用杏种子:国家林业局泡桐研究开发中心提供。丙烯酰胺、甲叉双丙烯酰胺、过硫酸胺:美国Amerosco公司。
1.2 主要仪器与设备
FOSSSCINO ST310油脂萃取系统:诺斯高斯分析仪器苏州有限公司;G6890A气相色谱仪(FID检测器):美国安捷伦科技公司。
1.3 方法
1.3.1 植物种子油体蛋白的提取[19]
取油茶种仁1 g放入研钵中,加6 mL体积的Buffer(缓冲液)A(10 mmol/L PBS,2mmol/L二硫苏糖醇(DTT),0.6 mol/L Sucrose),研磨成匀浆后转入离心管中,添加等体积 Buffer B(10 mmol/L PBS+0.4蔗糖),冷冻离心收集上层油体重新悬浮于6 mL的 Buffer C(5 mmol/L PBS+0.1蔗糖),此时为油体的粗提物 T1,液面上覆以等体积 Buffer D(10 mmol/L PBS+0.25蔗糖 +2 mol/L NaCl),冷冻离心收集上层油体重新悬浮于6 mL 9 mol/L尿素中,室温60 r/min振荡10 min,液面上覆以等体积10 mmol/L的PBS,再次冷冻离心收集上层油体,悬浮于少量Buffer A中,此时为油体提取物T2在4℃下保存备用。油体提取物中加入2倍体积的冰丙酮,置于-20℃下1 h,可直接沉淀油体提取物中的蛋白组分。取250μL的 T2油体提取物,加750μL氯仿/甲醇(1∶2)混合物,超速冷冻离心 5min,取中间的蛋白层,即纯化的油体蛋白,-70℃冰箱中保存。
1.3.2 油体贮藏效果
为了检验不同植物油体蛋白在不同温度下维持油体稳定性的效果,本试验将新鲜的油体提取物T2分别置于37、25、4和-20℃下16 h后,在放大400倍的光学显微镜下观察油体完整度。
1.3.3 油脂提取
参照GB/T 14772—2008中的索氏抽提法。
1.3.4 脂肪酸成分测定
脂肪酸成分测定釆取碱式甲酯化法测定[20]。
2 结果与讨论
2.1 不同植物油体蛋白SDS-PAGE电泳分析
根据不同植物种子中油体蛋白SDS-PAGE电泳结果分析(图1),仁用杏、油桐、花生、大豆、芝麻和油茶等6种植物油体蛋白均有多条谱带,分子量大小介于12~80 ku之间,说明这6种植物的油体大小也存在多级化。仁用杏油体中至少存在14条不同蛋白组分,其中15、25和40 ku左右蛋白的表达量远远大于其他蛋白;油桐油体中至少存在10条不同蛋白组分,其中13、18、26、35和50 ku左右蛋白条带浓粗;花生油体中至少存在10条不同蛋白组分,其中15、30和70 ku左右蛋白表达量大于其他蛋白;大豆油体中至少存在4条不同蛋白组分,其中25 ku左右蛋白表达量最为明显;芝麻油体中至少存在4条不同蛋白组分,其中13 ku左右蛋白表达量较为明显;油茶油体中至少含有6条不同的蛋白组分,其中14.4和18.4 ku左右蛋白的表达量远远大于其他蛋白。这些浓粗的蛋白条带甚至有可能是多条分子量接近的蛋白组分重叠而成。

图1 植物种子中油体蛋白SDS-PAGE电泳图
2.2 不同植物油体大小差异
不同植物油体大小差异较大,同一植物油体也存在大小差异(见图2)。对仁用杏、油桐、花生、大豆、芝麻和油茶这6种油料植物的油体整体比较而言,花生的油体最大,其最大油体直径可达2 mm左右,而大豆油体相对最小,其最大直径仅约0.5 mm左右。对照图1,花生分子质量为70ku左右油体蛋白表达量较高,而大豆分子量为25 ku左右油体蛋白表达量较高,这说明植物油体大小可能与油体蛋白的大小以及油体蛋白的表达量相关。而油体蛋白组分多元化可能是导致每种植物都存在多种大小不一油体的原因之一。
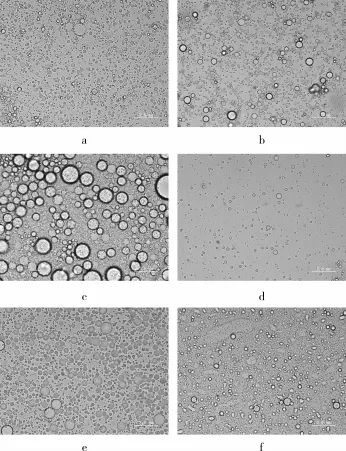
图2 植物种子中油体显微图(×400)
2.3 不同植物油体在不同温度下贮藏效果

图3 植物油体在不同温度下贮藏16 h后显微观测(×400)
不同植物油体最适贮藏温度有较大差异,并不是通常人们所认为的温度越低最适合保存(表1)。由图3可见,仁用杏和油茶油体提取物在37℃保存16 h,油体出现较明显的聚合现象,油脂容易变质;25℃保存16 h,虽然油体有轻微聚合,但是仍然保存着较多的大小不一的完整油体,但油茶大的油体组分存留较少;4℃保存16 h,油体保存较为完整,与新鲜提取出的油体差异不大;-20℃保存16 h,虽然油体保存较为完整,但却有轻微的聚合现象,且油茶大的油体组分明显减少。油桐油体在37、25、4和-20℃条件下贮藏16 h效果与仁用杏油体相似,但是油桐油体在-20℃条件下保存16 h后聚合现象更为明显。花生油体在37℃和25℃保存16 h,均存在较明显的聚合现象,但是25℃贮藏条件下还存在少数较大的油体,这是4℃和-20℃保存16 h后都不再存在的组分,这可能说明70 ku左右花生油体蛋白在常温下稳定性最好,而-20℃保存16 h,花生油体也存在轻微的聚合现象。大豆油体在4℃和-20℃条件下保存16 h完整度最好,37℃和25℃保存16 h后较大的油体几乎都不存在了。芝麻油体在-20℃条件下保存16 h完整度最好;4℃条件下虽然贮藏16 h效果也较好,但是大的油体组分较少;37℃和25℃保存16 h后芝麻油体均出现了不同程度的聚合现象,且油体密度明显减少。
2.4 油脂成分与油体贮藏效果相关分析
不同植物油体在不同温度下贮藏效果存在明显差异,这可能与其油体蛋白的大小多少有关,并且与该植物所含脂肪酸成分有较大关系。根据表1可以看出,在4℃冷藏条件下,试验植物油体保存状态均良好;在油体蛋白组分数量相当的情况下,多不饱和脂肪酸含量高的植物油体在-20℃冷冻条件下更容易发生聚合现象;在饱和脂肪酸成分含量相当的情况下,则表现出油体蛋白组分数量越多在冷冻条件下越容易发生聚合现象。
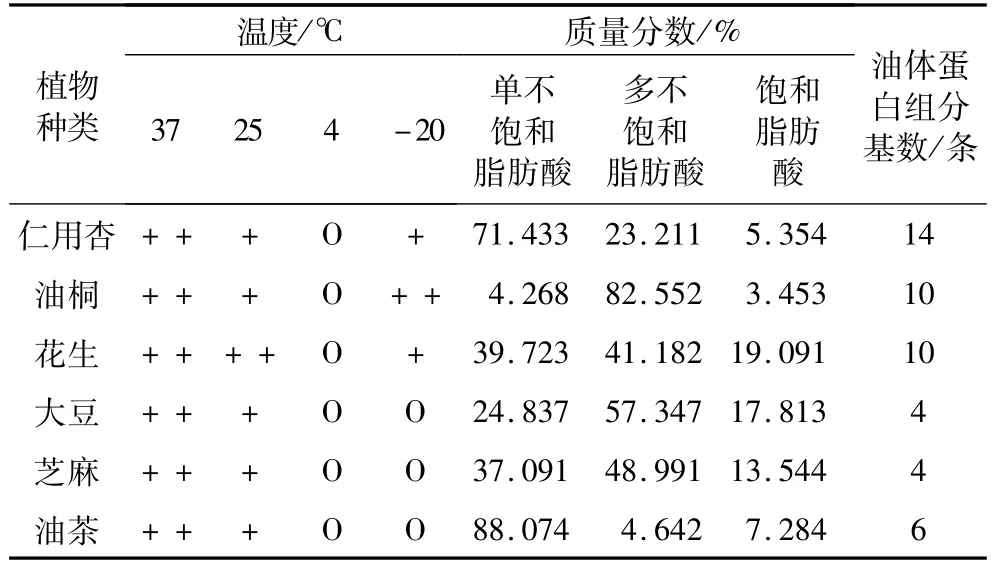
表1 植物油体在不同温度下贮藏16 h后综合分析
3 结论
3.1 油体大小与油体蛋白的大小以及油体蛋白的表达量密切相关,油体蛋白大小组分越多,油体大小差异个体也越多,同时某组分油体蛋白表达量越多,其对应大小的油体也越多。
3.2 植物油无论是食用油还是工业用油,在4℃冷藏条件下均能达到一个较长时间保鲜的效果。
3.3 油体蛋白组分数量相当的情况下,多不饱和脂肪酸含量高的植物油体在-20℃冷冻条件下却更容易发生聚合现象,这一结果似乎与生活常识有悖,这说明可能是因为多元化的因素导致了这一现象,如与其相关的脂酶种类、催化最适温度,蛋白质变性等等,具体原因还需进一步科学验证。
[1]Jason T C Tzen,Anthony H C Huang.Surface Structure and Properties of Plant Seed Oil Bodies[J].The Journal of Cell Biology,1992,117(2):327-335
[2]Anthony H,Huang C.Oil bodies and oleosins in seeds[J].Annual Review of plant physiology and plant Molecular Biology,1992,43:177-200
[3]Jason T C Tzen,Anthony H C Huang.Lipids,Proteins,and Structure of Seed Oil Bodies from Diverse Species[J].Plant Physiology,1993,101(1):267-276
[4]Rongda Qu,Anthony H CHuang.Oleosin 18 KD on the Surface of Oil Bodies in Maize:genomic and CDNA sequences and the deduced protein structure[J].The Journal of Biological Chemistry,1990,265(4):2238-2243
[5]Jacks T J,Yatsu L Y,Alschul AM.Isolation and characterization of peanut sphereosomes[J].Plant Physiology,1967,42(4):585-597
[6]Yatsu L Y,Jacks T J.Spherosome membranes[J].Plant Physiology,1972,49(6):937-943
[7]Vance VB and Huang AHC.The major protein from lipid bodies of maize:Charaterization and structure based on cDNA cloning[J].Journal of Biology Chemistry,1987,262(23):11275-11279
[8]K Lee,Huang A H.Genes encoding oleosins in maize kernel of inbreds Mo17 and B73[J].Plant Molecular Biology,1994,26(6):1981-1987
[9]W Edwards,C H Shaw,D J Murphy,et al.Cloning and characterisation of an oleosin gene from Brassica napus[J].Plant Molecular Biology,1992,19(3):443-53
[10]Kalinski,Jane M Weisemann,et al.Molecular Cloning of a Protein Associated with Soybean Seed OilBodies That Is Similar to Thiol Proteases of the Papain Family[J].The Journal of Biochemisty,1990,265(23):13343-13348
[11]Peter J Eastmond.Cloning and Characterization of the Acid Lipase from Castor Beans[J].The Journal of Biochemisty,2004,279(44):45540-45545
[12]D Wayne Hughes,Helen Y C Wang,Clenn A Calau.Cotton(Gossypium hirsutum)MatP6 and MatP7 Oleosin Genes[J].Plant Physiology,1993,101:697-698
[13]胡芳名,谭晓风,仇键,等.油茶种子表达的主要储藏蛋白基因及其分析[J].中南林学院学报,2005,25(4):24-26,45
[14]龙洪旭,谭晓风,陈洪,等.油桐油体蛋白基因的克隆及序列分析[J].中南林业科技大学学报,2010,30(4):31-38
[15]Liu JH,Selinger L B,Cheng K J,et al.Plant seed oilbodies as an immobilization matrix for a recombinant xylanase from the rumen fungus Neocallimastix patriciarum[J].Molecular Breeding,1997,3:463-470
[16]盖玉红,王旺,金潇,等.大豆24 ku油体蛋白基因与aFGF融合转化红花的研究[J].中国中药杂志,2013,38(12):1898-1903
[17]A H CHang,Lee W S.Maize oleosin is correctly targeted to seed oil bodies in Brassica napus transformend with the maize oleosin gene[J].Proceeding of the National Academy of Sciences U SA.1991,88(14):6181-6185
[18]Parmenter D L,Boothe J G,Moloney M M.Production of biologically active hirudin in plant seeds using oleosin partitioning[J].Plant Molecular Biology,1995,29(6):1167-1180
[19]Pascale Jolivet,Emeline Roux,Sabined Andrea,et al.Protein compositin of oil bodies inArabidopsis thalianaecotype WS[J].Plant Physiology and Biochemistry,2004(42):501-509
[20]王小艺,曹一博,张凌云,等.油茶生长发育过程中脂肪酸成分的测定分析[J].中国农学通报,2012,28(13):76-80.
Correlation Between Plant Oleosin and the Optimum Temperature for Oil Storage
Zeng Yanling1,2Zeng Xiaofeng1Tan Xiaofeng1,2Zhang Dangquan1,2He Sheyu1,3Yang Ya1
(Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees(Central South University of Forestry and Technology),Ministry of Education1,Changsha 410004)(Hunan Provincial Key Laboratory of Forestry Biotechnology2,Changsha 410004)(College of Food Science and Engineering,Central South University of Forestry and Technology3,Changsha 410004)
Kernel apricot,Vernicia fordii,Arachis hypogaea,Glycine max,Cortex cinnamomiandCamellia oleiferahave been chosen as material to research the oleosin components in the paper.The effects of the oil body storage were analyzed under different temperatures as well as the content of the fatty acid composition.The results showed that the oleosin components of the first 3 plants were more than those of the latter 3 ones;the oleosin components changed along with the increasing in different oil bodies.At the same,the oleosin genes expressed a positive correlation along with the corresponding oil bodies.When storaged under 4℃ or less,the all tested plant oil could be preserved better,but lower temperature was not always the better storage temperature.Not only oleosin but also fatty acid compositions affect the storage of plant oil.
plant oil,body oleosin,storage,temperature,fatty acid
S379
A
1003-0174(2015)04-0056-05
湖南省科技厅一般项目(2011FJ3219),湖南省自然科学基金(14JJ2104),中南林业科技大学校重点青年基金(QJ2011008A)
2013-12-05
曾艳玲,女,1980年出生,博士,经济林栽培育种及林业生物技术
曾晓峰,男,1979年出生,讲师,经济林产品加工利用

