多模态MRI影像对胶质瘤患者诊断和分级的应用价值
高兴锋
北京市健宫医院影像科 北京 100054
胶质瘤是神经胶质瘤的简称,是起源于神经间胶质、神经元的一类肿瘤的总称,是最常见的原发性脑肿瘤,占颅内肿瘤50%左右,占神经系统肿瘤的36%[1]。临床上胶质瘤分为四级,Ⅰ~Ⅱ级为低级别胶质瘤,其中Ⅰ级为良性,Ⅱ级为良、恶性交界性肿瘤;Ⅲ~Ⅳ级胶质瘤通常为恶性。胶质瘤患者的预后与肿瘤分级密切相关,分级越高,预后越差,生存期越短。目前,手术切除治疗是治疗该病主要的方式,但肿瘤分级是影响手术方式选择的重要因素。因此,对胶质瘤患者进行及时正确的诊断和分级对治疗方案的选择和预后评价十分重要。本研究通过常规MRI检查的基础上增加扩散张量成像(diffusion tensor imaging,DTI)方法,旨在探讨多模态MRI影像对胶质瘤患者诊断和分级的应用价值。
1 资料和方法
1.1 研究对象 以2011-02—2014-09我院术后病理确诊为胶质瘤的84例患者为研究对象,所有患者术前未接受化疗、放疗或其他治疗,男55例,女29例;年龄16~67岁,平均(43.6±13.5)岁。根据WHO肿瘤分类及分级标准[2],低级别胶质瘤24例(星形细胞瘤I级5例,星形细胞瘤II级15例,少突胶质细胞瘤II级4例);高级别肿瘤60例(间变性-少突胶质细胞瘤III级7例,间变性-星形细胞瘤III级13例,胶质母细胞瘤Ⅳ级40例)。
1.2 研究方法
1.2.1 检查方法及参数设置:所有患者均行MRI普通及增强扫描,扩散张量成像(diffusion tensor imaging,DTI)扫描。MRI检查方法:检查仪器为美国GE Signa HD 3.0T超导型MR扫描仪和头颅8通道相控阵线圈,常规轴位、矢状位、冠状位及增强扫描。T1FLAIR扫描参数:TR/TE为2000ms/22ms;FSE-T2WI扫 描 参 数:TR/TE为4500ms/100ms;T2FLAIR扫描参数:TR/TE为9000ms/140ms;增强扫描注射0.1mmol/kg的马根维显(Gd-DTPA),然后立即行常规轴位、矢状位、冠状位扫描。DTI扫描使用SSE-EPI成像序列,行轴位扫描。DTI参数设置:TR为10 000ms,TE最小,b值取0及1000s/mm2,层厚4mm。术前对所有患侧肿瘤部位和健侧对应部分应用DTT重建主要白质纤维束行走,评价脑白质纤维束,标准为移位、浸润和破坏[3]。
1.2.2 图像处理及观察指标:主要观察病变部位、数目、大小、形态、信号强度、瘤周水肿及强化程度。DTI图像在ADW4.2工作站处理后,获得ADC图及FA图,测定ADC值和FA值,选定感兴趣区,分别测定瘤瘤体部分、瘤周水肿带和对侧同层面脑白质区所对应的ADC值和FA值,本研究主要测定肿瘤瘤体部分、瘤周水肿带与对侧脑白质区的比值得到相对FA(relative FA,rFA)和相对ADC(relative ADC,rADC)。
1.3 统计学分析 应用SPSS 20.0进行数据分析,计量资料以均数和标准差表示,组间比较独立样本t检验;有序资料比较采用秩和检验;相关分析使用Spearman相关。检验水准α=0.05,所有检验均为双侧检验。
2 结果
2.1 胶质瘤MRI表现、ADC图、FA图信号表现 84例患者的MRI检查结果中,69例为单发,15例多发;病变部位:额叶23例,颞叶14例,枕叶14例,顶叶16例,颞叶和顶叶交界区8例,额叶和顶叶交界区9例。所有患者的T2WI表现为稍高或高信号;T1FLAIR信号:53例表现为等/低信号,31例表现为混杂信号。33例呈信号不均匀,出现坏死囊变区。增强扫描发现62例呈不规则形,且出现强化;65例出现占位效应,伴有不同程度的水肿带;瘤周水肿带、坏死囊变区未见强化。低级别胶质瘤的ADC图上呈低信号,瘤周轻度水肿呈高信号,FA图上瘤体为低信号,瘤周水肿表现为等信号或者稍低信号,分界清晰。高级别胶质瘤的ADC图上肿瘤实质部分呈等/稍高信号,坏死囊变部分为高信号,瘤周水肿为高信号,FA图上瘤体呈等/稍高信号,坏死囊变部分为低信号,瘤周水肿为等信号或者稍低信号,分界不清晰。10例出现推移,48例出现浸润,22例出现破坏。
2.2 2组rADC、rFA值比较 对2组的rADC、rFA值比较,可以发现,2组肿瘤瘤体部分和瘤周水肿带的rFA值差异无统计学意义(P>0.05),2组肿瘤瘤体部分和瘤周水肿带的rADC值差异有统计学意义(P<0.05),且低级别胶质瘤的肿瘤瘤体部分和瘤周水肿部分的rADC值高于高级别胶质瘤患者同部位的rADC值;对2组的组内rADC、rFA值比较,发现2组组内肿瘤瘤体部分和瘤周水肿部分的rADC、rFA值差异均有统计学意义(P<0.05),且瘤周水肿部分的rADC、rFA值高于肿瘤瘤体部分的rADC、rFA值。见表1、表2。
表1 2组肿瘤瘤体、瘤周水肿rADC、rFA值比较 (±s)
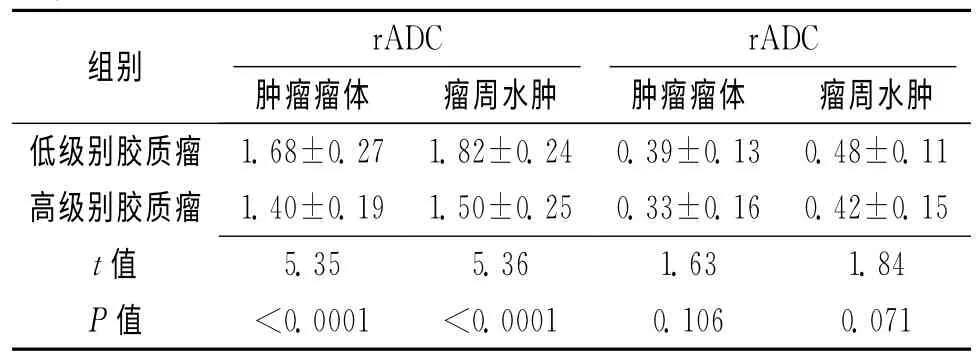
表1 2组肿瘤瘤体、瘤周水肿rADC、rFA值比较 (±s)
组别rADC rADC肿瘤瘤体 瘤周水肿 肿瘤瘤体 瘤周水肿低级别胶质瘤1.68±0.27 1.82±0.24 0.39±0.13 0.48±0.11高级别胶质瘤 1.40±0.19 1.50±0.25 0.33±0.16 0.42±0.15 t 值5.35 5.36 1.63 1.84 P值 <0.0001 <0.0001 0.106 0.071
表2 2组组内肿瘤瘤体、瘤周水肿rADC、rFA值比较 (±s)
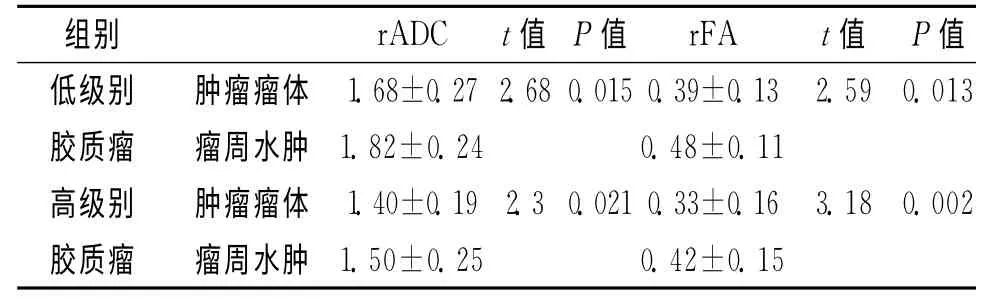
表2 2组组内肿瘤瘤体、瘤周水肿rADC、rFA值比较 (±s)
组别 rADC t值P值 rFA t值 P值低级别 肿瘤瘤体1.68±0.27 2.68 0.015 0.39±0.13 2.59 0.013胶质瘤 瘤周水肿1.82±0.24 0.48±0.11高级别 肿瘤瘤体 1.40±0.19 2.3 0.021 0.33±0.16 3.18 0.002胶质瘤 瘤周水肿1.50±0.25 0.42±0.15
2.3 2组的脑白质纤维束DTT表现 瘤纤维束形态三维成像表现为推移、浸润及破坏,低级别胶质瘤中9例表现为推移,13例表现为浸润,2例表现为破坏,高级别胶质瘤中1例表现为推移,35例表现为浸润,24例表现为破坏,2组的瘤纤维束形态三维成像表现差异有统计学意义(P<0.05)。
2.4 rADC、rFA值与病理分级的关系 测定rADC、rFA值,术后病理确定胶质瘤级别,计算rADC与病理分级之间的相关系数为-0.722(P<0.05),rFA与病理分级之间的相关系数为0.134(P>0.05)。
3 讨论
不同级别的胶质瘤治疗手段不同,低级别胶质瘤患者5年生存期可达80%,而高级别胶质瘤的术后生存时间一般较短,Ⅳ级胶质瘤患者5a生存期常不到5%,所以,正确诊断和分级可以指导制定临床治疗方案,这对改善患者的预后很重要。
目前,影像学检查是胶质瘤的主要检查方法,MRI平扫和增强扫描不能准确判断胶质瘤的良恶性,无法对肿瘤及周围组织的病变做定量分析,同时也不能够准确判断肿瘤侵犯脑组织的确切范围。每种单模态检查都有局限性,而DTI通过多种参数和图像后处理来反映不同组织的扩散特性,弥补了常规MRI的不足[4-5]。
本研究综合考虑个体间年龄、体质量、病程以及肿瘤的大小和发病部位等,选用rADC、rFA值进行研究,这可以消除ADC、FA值得较多影响因素[6]。有研究认为,ADC值与细胞密度密切相关,ADC值越低细胞密度越大,而细胞构成是决定肿瘤级别的重要因素之一,所以ADC值可以用来反映肿瘤的分级诊断。在DTI检测中,FA能够反映水分子与细胞亚结构间的交互作用,健康人的FA较大,但当脑白质结构发生变化时,FA值会降低。FA值可以鉴别正常脑组织与肿瘤瘤体强化区,坏死囊变区,瘤周水肿带,但无法鉴别肿瘤本身的肿瘤瘤体强化区,坏死囊变区,瘤周水肿带无法鉴别。
本研究结果显示,2组肿瘤瘤体部分和瘤周水肿带的rFA值差异无统计学意义(P>0.05),与Piyapittayanan[7]研究结果一致,说明FA值在胶质瘤分级中的价值不明显;但rFA值在同级别胶质瘤的肿瘤瘤体部分和瘤周水肿带间差异有统计学意义的(P<0.05),说明FA对于区别胶质瘤的肿瘤瘤体部分和瘤周水肿带有一定的指导意义。2组肿瘤瘤体部分和瘤周水肿带的rADC值差异有统计学意义(P<0.05),且低级别胶质瘤的肿瘤瘤体部分和瘤周水肿部分的rADC值高于高级别胶质瘤患者同部位的rADC值;对2组的组内rADC值比较,发现2组组内肿瘤瘤体部分和瘤周水肿部分的rADC值差异有统计学意义(P<0.05),且瘤周水肿部分的rADC值高于肿瘤瘤体部分的rADC、rFA值。这与Li[8]、LEE[9]的研究结果一致的。这说明在胶质瘤病变区细胞密度低,细胞坏死或囊变,间质中自由水分子弥散运动较强,从而导致ADC值升高,同时也提示ADC可以用于区分肿瘤瘤体部分和瘤周水肿带。
本研究DTT三维纤维束成像结果显示,低级别胶质瘤瘤周纤维束主要表现为推移和轻度浸润,说明纤维束较少被破坏,高级别胶质瘤瘤周纤维束主要表现为浸润和破坏,说明纤维束破坏较多,且2组比较差异显著(Z=-4.24,P<0.05),说明纤维束受破坏程度与肿瘤恶性程度呈正相关,与Chen Y[10]的研究结果一致。本文结果显示rADC值与病理分级呈负相关,这提示rADC值越低,肿瘤的分级就越高,恶性程度越强。与Andrea[11]研究结果一致。
综上,rADC值的测定有助于对胶质瘤的诊断和分级,rFA值的测定则有助于同级别胶质瘤的肿瘤瘤体部分和瘤周水肿带区别,DTT三维纤维束成像结果可以用于指导临床治疗方案,对评价患者预后有重要作用,多模态MRI影像对胶质瘤患者诊断和分级的有重要的临床价值。
[1]Dolecek TA,Propp JM,Stroup NE,et al.CBTRUS Statistical report:primary brain tunlors and central nervous system tumors diagnosed in the united states in 2005-2009[J].Neuro Oncol,2012,14(5):21-49.
[2]Nishi N,Kawai S,Yonezawa T,et al.Early appearance of high grade glioma on magnetic resonance imaging[J].Neuro Med Chir(Tokyo),2009,49(1):8-12.
[3]胡鸿博,刘鹏飞.磁共振弥散张量成像及纤维束成像对脑胶质瘤分级的诊断价值[J].磁共振成像,2011,2(2):118-122.
[4]Muthusami P,Basti RS,Thomas B,et al.Glioma progression as revealed by diffusion tensor metrics[J].Neurol India,2012,60(3):355-357.
[5]Lee HY,Na DG,Song IC,et a1.Diffusion-tensor imaging for glioma grading at 3-T magnetic resonance imaging:analysis of fractional anisotropy and mean diffusivity[J].J Comput Assist Tomogr,2008,32(2):298-303.
[6]Kalleberg K,Goldmann T,Menke J.Glioma infiltration of the corpus callosum:early signs detected by DTI[J].J Nenrooncol,2013,112(2):217-222.
[7]Piyapittayanan S,Chawalparit O,Tritakarn SO,et al.Value of diffusion tensor imaging in differentiating high-grade from lowgrade gliomas[J].J Med Assoc Thai,2013,96(6):716-21.
[8]Li SW,Tian SY,Li ZX,et a1.Application of diffusion tensor imaging in the preoperative grading of astrocytoma[J].Radiology Practice,2007,22(4):234-237.
[9]LEE E J,LEE S K,AGID R,et al.Preoperative grading of presumptive low-grade astrocytomas on MR imaging:Diagnostic value of minimum apparent diffusion coefficient[J].AJNR Am J Neuroradiol,2008,29(10):1 872-1 877.
[10]Chen Y,Shi Y,Song Z.Differences in the architecture of lowgrade and high-grade gliomas evaluated using fiber density index and fractional anisotropy[J].J Clin Neurosci,2010,17(7):824-829.

