脑出血后血肿状态对神经功能损伤的动物实验性研究
何国林 陈湛愔 梁余航 陈逢俭 林海峰 唐龙冲 陈奕奕
广东湛江中心人民医院神经内科 湛江 524037
动物实验研究发现脑出血后血肿内血液沿着血管外周间隙(VRS)以及神经纤维间隙向外扩展,这一现象与血肿周围微出血有关[1]。研究还发现血肿内有形成分(红细胞)和无形成分沿着这两间隙向远端扩展情形不同;血肿沿着血管外间隙以及神经纤维间隙扩散,导致血肿形态不同,是血肿消散、吸收的途径之一[2]。因而,我们推测血肿不同状态在组织间隙扩展能力不同,可能对脑出血后神经功能损伤有不同影响。本研究采用加入抗凝剂(低分子肝素钠)和促凝剂(6-氨基己酸)的大鼠自体动脉血建立脑出血模型,对比研究发现急性期血肿扩大、血肿液化有益于减轻脑出血组织水肿以及神经功能损伤。现分析如下。
1 资料和方法
1.1 实验动物以及分组 清洁级SD 大鼠75 只,体质量(250±10)g,随机分成3组:促凝组、抗凝组、正常对照组,每组25只,每时间点5只,常规饲养。
1.2 脑出血动物模型制备 脑出血动物模型采用经顶部入路预置管二次注射自体动脉血建立大鼠尾状核脑出血模型[3]。促凝组大鼠自体动脉血加入6-氨基己酸(0.1mg/1g体质量),抗凝组大鼠自体动脉血加入低分子肝素钠(0.4IU/1g 体质量),对照组不加抗凝剂、促凝剂,注血量为50μL。
1.3 大鼠神经功能缺损评分 (Zealonga)5 分制评分法0分为无神经损伤症状;1分为不能伸展对侧前爪;2分为向外侧划圈;3 分为向对侧倾倒;4 分为不能自发行走,意识丧失);计算大鼠血肿容积(采用Mias2000图像分析系统分别测量每个层面血肿面积,并计算出血肿容量)。
1.4 实验大鼠造模后不同时间点 (1h、6h、12h、24h、3 d)进行神经功能缺损评分并计算均数分值;相应时间点大鼠脑组织系列切片(片厚2mm),分别计算大鼠血肿容积。同期进行脑组织血肿病理切片染色(HE 染色),观察出血病灶周围组织水肿病理变化。
1.5 统计学分析 采用SPSS 19.0统计软件对每组大鼠神经功能缺损评分以及血肿大小容积进行方差分析(ANOVA),分析每组大鼠神经功能缺损与血肿容积相关性差异,对比观察各组大鼠脑组织出血病灶周围水肿变化特点。
2 结果
2.1 各组不同时间点血肿容积统计分析 1h时间点各组大鼠血肿容积大小比较显示无明显差别(P>0.05);6h、12 h、24h时间点实验大鼠血肿容积大小依次为抗凝组大于正常组大于促凝组;3d时间点各组间比较差异无统计学意义(P>0.05)。见表1。
表1 不同时间点各组大鼠血肿容积比较 (±s)
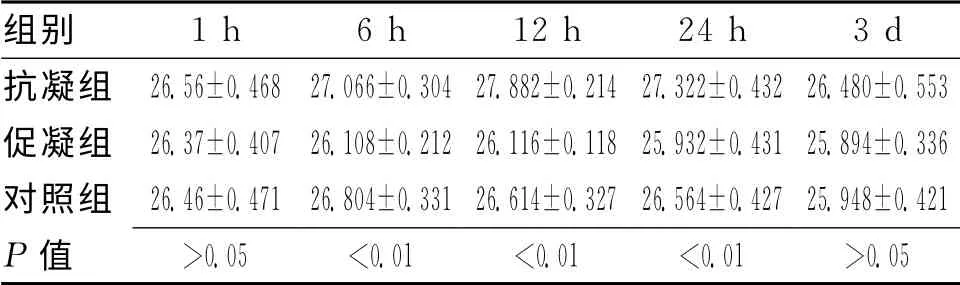
表1 不同时间点各组大鼠血肿容积比较 (±s)
组别1h 6h 12h 24h 3d抗凝组 26.56±0.468 27.066±0.304 27.882±0.214 27.3 22±0.432 26.480±0.553促凝组 26.37±0.407 26.108±0.212 26.116±0.118 25.932±0.431 25.894±0.336对照组 26.46±0.471 26.804±0.331 26.614±0.327 26.564±0.427 25.948±0.421 P值 >0.05 <0.01 <0.01 <0.01 >0.05
2.2 各组不同时间点神经功能损伤评分比较 1h各组大鼠神经功能损伤比较显示无明显差别(P>0.05);6h、12h、24h时间点促凝组大于抗凝组与正常组,差异有统计学意义(P<0.05);3d时间点各组间比较差别不明显(P>0.05)。见表2。
表2不同时间点各组大鼠神经功能损伤评分比较 (±s)
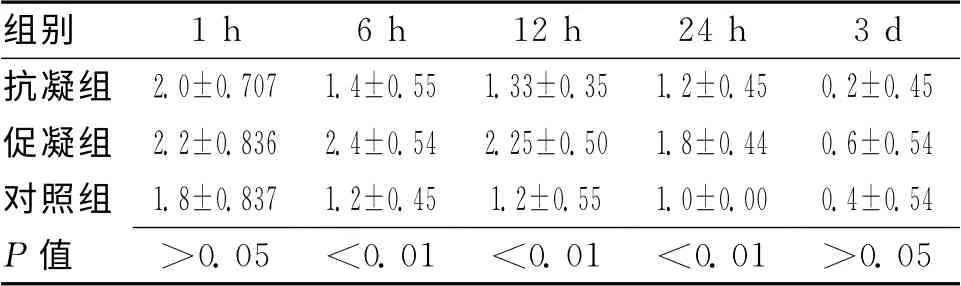
表2不同时间点各组大鼠神经功能损伤评分比较 (±s)
组别1h 6h 12h 24h 3d抗凝组 2.0±0.707 1.4±0.55 1.33±0.35 1.2±0.45 0.2±0.45促凝组 2.2±0.836 2.4±0.54 2.25±0.50 1.8±0.44 0.6±0.54对照组 1.8±0.837 1.2±0.45 1.2±0.55 1.0±0.00 0.4±0.54 P 值 >0.05 <0.01 <0.01 <0.01 >0.05
2.3 病灶周围组织水肿严重程度比较 1h时间点各组大鼠脑出血病灶周围水肿差别不明显,水肿轻;随时间延长,水肿逐渐加重,各组表现不同,相同时间点血肿周围组织水肿严重程度依次为促凝组、正常组、抗凝组,主要时间点(6h、24h)结果见图1。血肿周围组织病理结果:6h时间点可见病灶周围出现水肿,24h时间点血肿周围组织水肿差别明显,促凝组血肿周围组织水肿程度最重。
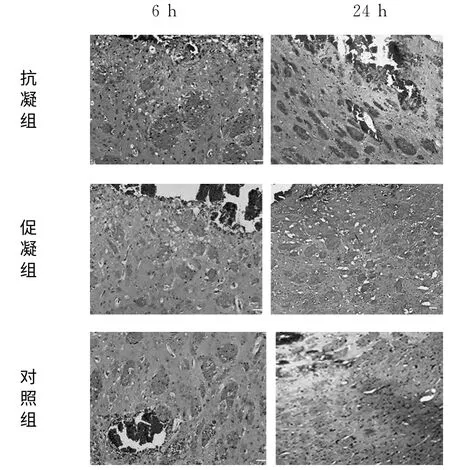
图1 6h、24h时间点血肿周围脑组织水肿结果比较(HE染色,×200)
3 讨论
脑出血后局部脑组织损伤源于血肿压迫、血肿血液分解产生的毒物以及细胞产生的损伤因子。脑出血后,血肿对周围组织压迫导致脑组织细胞缺血、缺氧,产生水肿,导致组织损伤。另一方面,血肿与周围组织存在压力差,在压力差作用下,血液渗入血管外周以及神经纤维外周间隙,通过这些间隙向远端扩展,是脑出血后发生的一种自我保护性病理生理机制,有研究称此为“管涌现象”[4]。这种现象的产生导致血肿压力减轻,对周围组织压迫作用减弱,有益于减轻脑组织损伤。本实验研究发现各组大鼠脑出血后1h,病灶周围局部出现水肿,并逐渐加重,3d时间点水肿最明显。6~24 h时间点抗凝组血肿容积明显大于其他2组,但神经功能损伤评分却小于促凝组和对照组,说明神经损伤比其他组轻。原因是抗凝组大鼠血肿不易凝固,血肿沿血管外间隙以及神经纤维间隙向远端扩展,血肿容积大,血肿与周围组织压力差小,局部压迫作用小,因而对局部脑组织损伤小。本研究病灶周围病理结果发现抗凝组水肿比其他组轻,说明脑出血后短时间内对血肿的抗凝有利于血肿在血管外间隙以及神经纤维间隙流动,可以减轻局部水肿引起的神经损伤。
脑出血后血液中的活性物质以及红细胞破碎后释放的各种生化物质对血肿周围的正常组织会产生有害作用[5-7]。缩短这些物质在局部存留时间,有利于减轻这些产物对脑组织的损伤。实验中3组大鼠脑出血模型构建1h以及3d时间点神经功能损伤评分差别不大,而6h至24h时间点结果显示:促凝组脑水肿比其他组重,并且神经功能损伤评分高于其他组。可能原因为抗凝组大鼠血肿凝固时间延长,血液流动性增加,血肿沿血管外间隙以及神经纤维间隙向外扩展,导致毒性物质局部作用时间缩短,损伤程度轻,而促凝组血肿扩散慢,毒性物质局部滞留时间长,对组织损伤重。1h以及3d时间点血肿状态相似,血肿在血管外间隙以及神经纤维外周间隙扩散差别不大,各组病灶周围水肿表现相似,神经损伤差别不明显,说明血肿状态对组织损伤有一定影响。
脑出血后血液溢出血管进入脑组织间隙,发生出血、凝血、纤溶等一系列变化[8-10],每个阶段血液的性状不同,血管外间隙以及神经纤维外周间隙扩展会有不同特点,对局部脑组织损伤作用有差别。脑出血即时,血肿内的血液在凝固前性状并无明显变化,出血后凝血机制被激活,血液开始凝固,此时的血液流动性差,向外扩展慢。脑出血48h后,由于此时纤溶系统被激活,血块逐渐被溶解液化而重新恢复流体特性,3d后达高峰,血管外间隙以及神经纤维外周间隙扩展重新出现,毒性物质向远端扩散,局部浓度减低,毒性作用减弱,因而组织损伤减轻。本实验通过加入抗凝剂和促凝剂干预血肿状态,发现3组大鼠脑出血1h以及3d时间点,因血肿状态差别不大,组织损伤以及血肿容积差别不大。而6~24h时间点,血肿状态不同,对局部组织损伤不同,说明干预脑出血后血肿状态对脑组织损伤有不同影响。
本研究3组实验大鼠均为50μL 混合自体动脉血构建的脑出血模型,便于不同组别比较,对不同剂量自体动脉血构建脑出血模型未做研究。50μL自体动脉血构建的脑出血模型,与人体30mL脑出血相当。实际上,在临床病人脑出血治疗中,小于30mL脑出血,一般不用止血药治疗,临床研究也显示止血治疗并不能改善神经功能损伤结果,其原因不很清楚,本研究结果对此可提供解释帮助。研究显示脑出血早期促凝后,血肿沿血管外间隙以及神经纤维间隙扩散减弱,对神经损伤有害无益,增强血肿扩展有益于减轻神经损伤。当然,不同大小血肿,血肿不同状态对组织损伤程度不同,需做进一步系统研究。
[1]吕田明,陆兵勋,李中秋,等.大鼠脑出血血肿周围组织内的环状出血现象及其病理机制探讨[J].中华老年心脑血管病杂志,2005,7(6):417-418.
[2]何国林,陈湛愔,陈逢俭,等.动物实验性脑出血血肿内红细胞管涌现象研究[J].中华老年心脑血管病杂志,2013,15(1):86-88.
[3]何国林,陆兵勋,吕田明,等.经顶部入路预置管二次注射自体动脉血建立大鼠尾状核脑出血模型的可行性研究[J].国际脑血管病杂志,2010,18(3):211-213.
[4]吕田明,陆兵勋,尹恝,等.脑出血血肿形成过程中的管涌现象[J].中华老年心脑血管病杂志,2007,9(7):489-491.
[5]Naff NJ,Wemmer J,Hoenig-Rigamonti K,et al.A longitudinal study of patients with venous malformations[J].Neurology,1998,50(6):1 709-1 714.
[6]Goldstein L,Teng ZP,Zeserson E,et al.Hemin induces an irondependent,oxidative injury to human neuron-like cells[J].Neurosci Res,2003,73(1):113-121.
[7]Levy YS,Streifler JY,Panet H,et al.Hemin-induced apoptosis in PC12and neuroblastoma cells:implications for local neuronal death associated with intracerebral hemorrhage[J].Neurotox Res,2002,4(7/8):609-616.
[8]Brott T,Broderick J,Kothari R,et al.Early hemorrhage growth in patients with intracerebral hemorrhage[J].Stroke,1997,28(1):1.
[9]Lee KR,Colon GP,Betz AL,et al.Edema from intracerebral hemorrhage:the role of thrombin[J].Neurosurg,1996,84(1):91.
[10]张学勤,左大鹏,王秋萍,等.急性脑卒中血浆纤溶状态的动态观察[J].中风与神经疾病杂志,1997,14(1):16.

