大肠癌不同发展阶段相关基因甲基化定量分析的临床意义
王群英 陈燕萍 叶晓华⋆ 杨小云 丁进 姜洋
·基础研究·
大肠癌不同发展阶段相关基因甲基化定量分析的临床意义
王群英 陈燕萍 叶晓华⋆ 杨小云 丁进 姜洋
目的 通过进行大肠癌患者相关基因甲基化定量分析,探讨相关基因甲基化水平与大肠癌发生、发展的关系。方法 采用实时荧光定量PCR技术检测大肠癌组、癌前病变组(结肠腺瘤)及正常对照组的APC、p16及大肠癌特异性基因Vimentin基因甲基化水平。结果 大肠癌组中APC、p16及Vimentin基因甲基化阳性率比较癌前病变(结肠腺瘤)和正常肠黏膜组显著升高,其差异有统计学意义(P<0.05);大肠癌组中肿瘤组织的APC、p16及Vimentin基因甲基化阳性率比癌旁及正常黏膜组织显著升高,其差异有统计学意义(P<0.05)。结论 APC、p16及Vimentin基因甲基化参与了大肠癌的发生发展,且利用实时荧光定量PCR对相关基因甲基化进行定量分析可能预测大肠癌早期发生。
荧光定量 甲基化 大肠癌
Objective To investigate the relationship between methylation of relevant genes and the development of colorectal cancer and to assess the value of early diagnosis based on quantitative analysis of methylation of colorectal cancer-related genes. Methods Fluorogenic quantitative polymerase chain reaction (PCR) was applied to detect APC,p16,and colorectal cancer-specific Vimentin gene methylation in colorectal cancer,precancerosis and healthy control groups,respectively. The levels of APC,p16 and Vimentin methylation in different tissues of patients with colorectal cancer were also quantified. Results The methylation rates of the APC,p16 and Vimentin in colorectal cancer group were significant up-regulated compared to those in precancerosis and healthy control groups (P<0.05). Moreover,similar results were also obtained for the levels of APC,p16 and Vimentin methylation in the malignancy,pericarcinomatous and normal tissues in colorectal cancer group (P<0.05). Conclusions The methylation of APC,p16 and Vimentin is involved in the carcinogenesis of colorectal cancer. Quantitative analysis of methylation of colorectal cancer-related genes using fluorogenic quantitative PCR may be used for early diagnosis of colorectal cancer.
【Kew words】 Fluorogenic quantitative Methylation Colorectal cancer early diagnosis of colorectal cancer.
大肠癌是人类主要恶性肿瘤之一,在我国一些大城市呈上升趋势[1]。阐明大肠癌发病的分子机制对进一步筛选大肠癌分子靶点和治疗疾病具有重要意义。肿瘤相关基因的CpG岛甲基化所致基因转录失活已成为肿瘤表观基因组学研究的重点内容。但限于检测方法或技术,目前对基因甲基化主要采取定性的检测和研究。本文拟以此为切入点,通过对细胞修复基因以及大肠癌特异性表达基因甲基化程度的定量检测[3],探讨其甲基化程度与大肠癌的发生及不同发展阶段的相关性,初步揭示其内在关系。
1 临床资料
1.1 一般资料 标本取自本院2009年6月至2010年12月的肠镜活检标本,其中包括:(1)大肠癌组62例,男34例,女28例;平均年龄(59±7.4)岁。包括低、中、高分化腺癌3类患者。(2)癌前病变组(结肠腺瘤)54例,男28例,女26例;平均年龄(55±6.7)岁。主要肠镜检查为息肉,活检或术后标本病理检查示腺瘤患者,包括管状腺瘤,绒毛状腺瘤及混合型腺瘤,伴或不伴异型增生。(3)健康对照组48例,男24例,女24例;平均年龄(50±5.6)岁。否认有高血压,糖尿病,冠心病等慢性病。新鲜标本置于液氮中,随后置于-80℃低温冰箱中保存备用。
1.2 主要试剂 BiosPin组织基因组DNA提取试剂盒; 琼脂糖; 100-1000bp DNA Ladder;琼脂糖凝胶DNA回收试剂盒;DNA Clean-up纯化试剂盒(Promega);Realtime PCR Master Mix (TOYOBO);Taq酶 (Fermentas-MBI);Tag酶Buffer (Fermentas-MBI);dNTPs (Fermentas-MBI);Mg2+ (Fermentas-MBI);DMSO。
1.3 方法 (1)组织DNA提取:标本DNA抽提采用BiosPin组织基因组DNA提取试剂盒(艾比根生物技术),每 300 μl 血清获得70μl 的DNA,所有保存血清标本均采用同一批号的试剂盒抽提 DNA 以减少批间误差 ,并统一集中检测。紫外分光光度计及1%的琼脂糖凝胶检测DNA浓度和纯度(A260/A280>1.8)。将提取的DNA置于-20℃冰箱中保存备用。(2)DNA亚硫酸氢盐处理和纯化:取提取的DNA 10μg加入5.5 μl 的 NaOH(3mol/L),于37℃ 变性10min。加入10mM氢醌20 μl,和3M亚硫酸氢钠520 μl,上盖200 μl矿物油于50℃水浴16 h。(3)于矿物油下小心吸取50Oμl液体,置于新的Eppendorf管,加入1ml 37℃预热后冷却至30℃的 Wizard DNA纯化树脂,颠倒混匀。随后加入3M NaOH 5.5 μl,室温变性10min(脱硫)。加入3M醋酸钠5.5 μl(中和NaOH)和冷无水乙醇120μl,沉淀回收DNA于-20℃放置6h。置入-20℃冰箱中贮存备用,以此作为聚合酶链反应 (PCR)扩增模板。(3)引物合成:根据文献[4~6]设计出针对亚硫酸氢盐修饰后的APC 、p16及大肠癌特异性基因Vimentin基因甲基化和非甲基化引物序列,引物由依托实验室(上海捷瑞)合成。具体引物序列如下: 甲基化的APC(APC-M):上游引物5'-3':TAT TGC GGA GTG CGG GTC,下游引物5'-3':TCG ACG AAC TCC CGA CGA扩增目的条带大小为98bp。非甲基化的APC(APC-UM):上游引物5'-3':GTG TTT TAT TGT GGA GTG TGG GTT,下游引物5'-3':CCA ATC AAC AAA CTC CCA ACA A,扩增目的条带大小为104bp。甲基化的p16(P16-M):上游引物Sense Primers5'-3':TTA TTA GAG GGT GGG GCG GAT CGC,下游引物Antisense Primers5'-3':GAC CCC GAA CCG CGA CCG TAA,扩增目的条带大小为150bp。非甲基化的p16(P16-UM):上游引物5'-3':TTA TTA GAG GGT GGG GTG GAT TGT,下游引物5'-3':CAA CCC CAA ACC ACA ACC AIA A,扩增目的条带大小为151bp。甲基化的Vimentin (Vimentin-M):上游引物5'-3':TCG TTT CGA GGT TTT CGC GTT AGA GAC,下游引物:5'-3': CGA CTA AAA CTC GAC CGA CTC GCG A,扩增目的条带大小为216bp。非甲基化的Vimentin(Vimentin-UM):上游引物5'-3': TTG GTG GAT TTT TTG TTG GTT GAT G,下游引物5'-3':CAC AAC TTA CCT TAA CCC TTA AAC TAC TCA,扩增目的条带大小为224 bp。
图1 基因组DNA电泳图
1.4 统计学方法 采用SAS9.0统计软件。计量资料以(x±s)表示,采用t检验,计数资料以n或%表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 组织基因组DNA的提取 通过0.8%的琼脂糖凝胶电泳鉴定 DNA的浓度与纯度,结果示OD260/ OD280均介于1.8~2.0,琼脂糖凝胶电泳呈现单一的和基因组DNA大小相符的条带,说明DNA的纯度较高,完整性较好(图l)。
2.2 各基因甲基化检测结果 大肠癌、癌前病变(结肠腺瘤)和正常肠黏膜组pl6甲基化阳性率分别为51.61%、31.48%、14.58%;APC基因甲基化阳性率分别为77.42%、46.29%、6.25%; Vimentin基因甲基化阳性率分别为66.13%、51.85%、4.17%;大肠癌、癌前病变(结肠腺瘤)和正常肠黏膜组各基因甲基化阳性率比较差异有统计学意义(P<0.05),任意两组之间阳性率比较差异有统计学意义(P<0.05)(表2)。
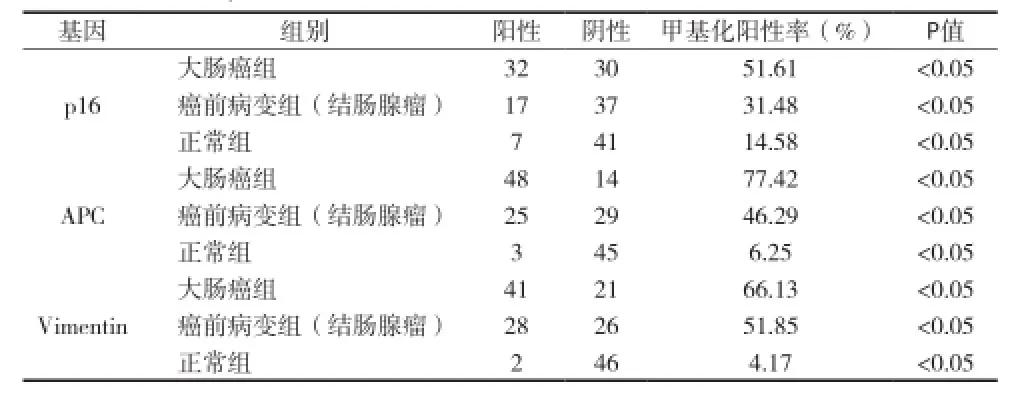
表2 p16,APC和Vimentin基因的甲基化检测结果(n)
2.3 各基因定量检测水平 对大肠癌、癌前病变(结肠腺瘤)及正常组织病变中p16,APC,Vimentin基因甲基化定量水平进行比较发现,三组之间甲基化定量水平差异有统计学意义 (P<0.05),任意两组之间比较差异有统计学意义 (P<0.05),由正常组织、癌前病变(结肠腺瘤)到大肠癌各基因甲基化的定量水平呈上升趋势 (P<0.05)。
2.4 各基因在大肠癌不同组织中甲基化程度检测结果 对62例大肠癌患者的不同组织各基因甲基化程度定量测定。肿瘤、癌旁组织(癌症病灶周围5cm组织)及正常的大肠黏膜组织pl6、APC、Vimentin基因甲基化程度比较差异有统计学意义(P<0.05),任意两组之间阳性率比较差异有统计学意义(P<0.05)。
3 讨论
大肠癌从诱发到进展是一个多阶段、多因素的复杂过程。抑癌基因是正常细胞在调控细胞增殖、分化等方面起重要作用的基因,它在保持基因组结构稳定、促进细胞生长、诱导细胞凋亡等方面均有重要意义,它的缺失或失活可引起细胞内癌基因的活化,造成细胞的过度增生、分化,导致恶性肿瘤的发生和发展。DNA甲基化的异常能导致肿瘤的发生。近年来发现肿瘤细胞中出现染色体区域性高甲基化与抑癌基因功能的丢失有关,可能是肿瘤甲基化不平衡中的重要部分,基因启动子区域5'CPG岛甲基化常伴有基因的转录失活。
大肠腺癌息肉病基因 (APC)与大肠腺癌发生密切相关[7]。APC基因是由Herrera等[8]于1986年对1例格-德纳综合征患者进行细胞遗传学研究时发现的一个抑癌基因,并于1991年从结肠癌中首先克隆出这一基因,并正式命名为DP2、5或APC[9]。早期研究[7]发现该基因不仅与家族性结肠腺瘤息肉病(FAP)有关,而且在散发性大肠癌(SCRC)中亦起着重要作用。Chop等[10]采用免疫沉淀技术也证实大肠癌组织中缺乏野生型 APC蛋白,提示APC蛋白失表达可能与大肠癌的发生与演进密切相关。APC基因可能是散发型大肠癌的易感基因,但APC基因的突变可能无助于大肠癌的预后。检测APC基因对早期诊断及治疗大肠癌有着重要的指导意义。
p16基因[11]是一种细胞周期中的基本基因,直接参与细胞周期的调控,负调节细胞增殖及分裂,在人类50%肿瘤细胞株纯发现有纯合子缺失,突变,会导致细胞恶性增殖,导致恶性肿瘤发生。pl6基因位于第9号染色体短臂上,全长8.5Kb,由3个外显子和2个内含子组成。5'端第1外显子有126bp,中间307bP构成第2个外显子,3'端第3个外显子有116bp;3个外显子构成1个开放阅读框架,共同编码分子量为15.84KD、由145个氨基酸组成的单链蛋白质,即pl6蛋白。P16基因已经在肺癌等多种肿瘤中发现纯合子缺失以及无义,错义及移码突变,表明p16基因以缺失,突变方式广泛参予肿瘤形成,检测p16基因有无改变对判断患者肿瘤的易感性以及预测肿瘤的预后,具有十分重要的临床意义。研究发现pl6基因与多种肿瘤的发生有关[12],因此又称为多肿瘤抑制基因(MTSI)。APC 、p16及大肠癌特异性基因Vimentin基因属于细胞周期素依赖性激酶4(CDK4)抑制因子家族成员之一,其产物APC、p16及大肠癌特异性基因Vimentin蛋白竞争性结合CDK4,抑制其激酶活性,维持pRb蛋白的去磷酸化,使细胞分裂阻滞于G0期而抑制细胞的增殖。pl6基因失活使APC、p16及大肠癌特异性基因Vimentin INK4a/pRb调节通路异常,致使细胞过度增殖而导致肿瘤的发生,其主要失活机制有基因突变、纯合性缺失和启动子甲基化。pl6基因作为抑癌基因,其5'端启动子调节序列及第一外显子均含有CpG岛,这些区域在正常组织中一般是非甲基化的,但在一些常见的肿瘤中却呈高甲基化,近年来发现肿瘤细胞中出现染色体区域性高甲基化与抑癌基因功能的丢失有关,可能是肿瘤甲基化不平衡中的重要部分,基因启动子区域5'CPG岛甲基化常伴有基因的转录失活。CPG岛是基因组C、G富集区,细胞中约有40%的基因启动子区域具有CPG岛。正常情况下,除失活的X染色体外,常染色体基因CPG岛均处于非甲基化状态,而在细胞癌变过程中(包括头颈部肿瘤)常染色体基因CPG岛存在广泛的甲基化,p16基因的外显子1启动子区域存在一CPG岛,在被检测的正常组织中它处于非甲基状态。在一些p16等位基因较少发生点突变或纯合性缺失的人类肿瘤中,如小细胞肺癌株出现高比例(78%)的5'CPG岛甲基化而失去转录活性,特别是结肠癌细胞系中甲基化发生率高达97%,尤其是在一些未发生纯合性缺失的结肠癌细胞中,p16基因的两个等位基因都出现异常甲基化,并与其完全失活是相关的。后来又发现在结肠癌患者的正常结肠黏膜也出现甲基化,这在正常细胞常染色体基因中是罕见的,一般岛都是非甲基化的。pl6基因由于纯合性缺失和突变而失活已在众多肿瘤中进行了研究,但这两种遗传变异方式还不能够充分解释APC 、P16及大肠癌特异性基因Vimentin蛋白的高丢失率,而APC、P16及大肠癌特异性基因Vimentin基因cpG岛高甲基化已被证实是APC 、p16及大肠癌特异性基因Vimentin蛋白丢失的另一重要机制[13]。最近的研究结果表明,在众多肿瘤中,pl6基因启动子高甲基化是造成APC 、p16及大肠癌特异性基因Vimentin蛋白丢失的主要原因。在原发性大肠癌中APC 、P16及大肠癌特异性基因Vimentin基因缺失突变少见,但APC、p16及大肠癌特异性基因Vimentin蛋白有较高的失表达率,因此pl6基因在大肠癌中的失活可能存在其他机制。
1 Kokki I, Papana A, Campbell H, et al. Estimating the incidence of colorectal cancer in South East Asia. Croat Med J, 2013, 54(6):532~40.2 Weisenberger DJ. Characterizing DNA methylation alterations from The Cancer Genome Atlas. J Clin Invest,2014 ,124(1):17~23.
3 Penney RB, Lundgreen A, Yao-Borengasser A, et al. Lack of correlation between in silico projection of function and quantitative realtime PCR-determined gene expression levels in colon tissue.Pharmgenomics Pers Med, 2013,6:99~103.
4 Nagel R, le Sage C, Diosdado B, et al. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer. Cancer Res, 2008, 68(14): 5795~5802.
5 Wong IH, Lo YM, Lai PB, et al. Relationship of p16 methylation status and serum α-fetoprotein concentration in hepatocellular carcinoma patients. Clin Chem, 2000, 46(9):1420~1422.
6 Zou H, Harrington J, Rego RL, et al. A novel method to capture methylated human DNA from stool: implications for colorectal cancer screening. Clin Chem, 2007, 53(9):1646~1651.
7 Abraham SC, Nubukawa B, Ciardicllo FM, et al. Fundicgland polyps in familial adenomatous polyposis: neoplasms with frequent somatic adenomatous polyposis coli gene alterations . Am J Pathol,2000, 157(3): 747~754.
8 Herrera L,Kakati S,Gibas L,et al.Gardner syndrome in a man with an interstitial deletion of 5q .Am J Med Genet,1986,25(3):473~476.
9 Shpitz B,Bomstein Y,Mekori Y,et al.Aberrant crypt foci in human colons:distribution and histomorphologic characteristics.I lum Pathol,1998, 29(5):469~475.
10 Aust DE,Terdiman JP,Willenbucher RF,et al. The APC/beta catenin pathway in ulcerative colitis –related colorectal carcinomas:a mutational analysis.cancer,2002,94(5):1421~1427.
11 Chop AM,Abraham CI ,Adrian TE,et al.Immunodetection of the presence or absence of full length APC gene product in human colonic tissue.Anticaner Res,1995,159(3):991~997.
12 kamb, Gruis NA ,Weaver|Feld|haus J,et al. A cell cycle regulator potentially involved in genesis of many tumor types .Science, 1994, 264 (15):436.
13 Nobori T, Miura K, Wu DJ, et al . Deletions of the cycle dependent kinase|4 inhibitor gene in mu cancers. Nature,1993,368(6473):753.
321000 浙江省金华市中心医院
*通讯作者

