浅谈高考化工工艺流程题-金属部分
浅谈高考化工工艺流程题-金属部分
林佳旋衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:工艺流程试题是各地高考中经常出现的题型,特别是广东卷,工艺流程题已经成为了必考题目之一。由于近年来高中化学新课程的改革越来越注重教材内容与日常生活和工农业生产的紧密联系。因此此类题型成为了高考的一个热点,同时也是一个难点,了解此类题型的解题思路和掌握解题技巧有助于在高考中提高学生的得分率。
关键词:工艺流程题广东高考解题策略金属部分
一、广东历年高考工艺流程题金属部分考点分析
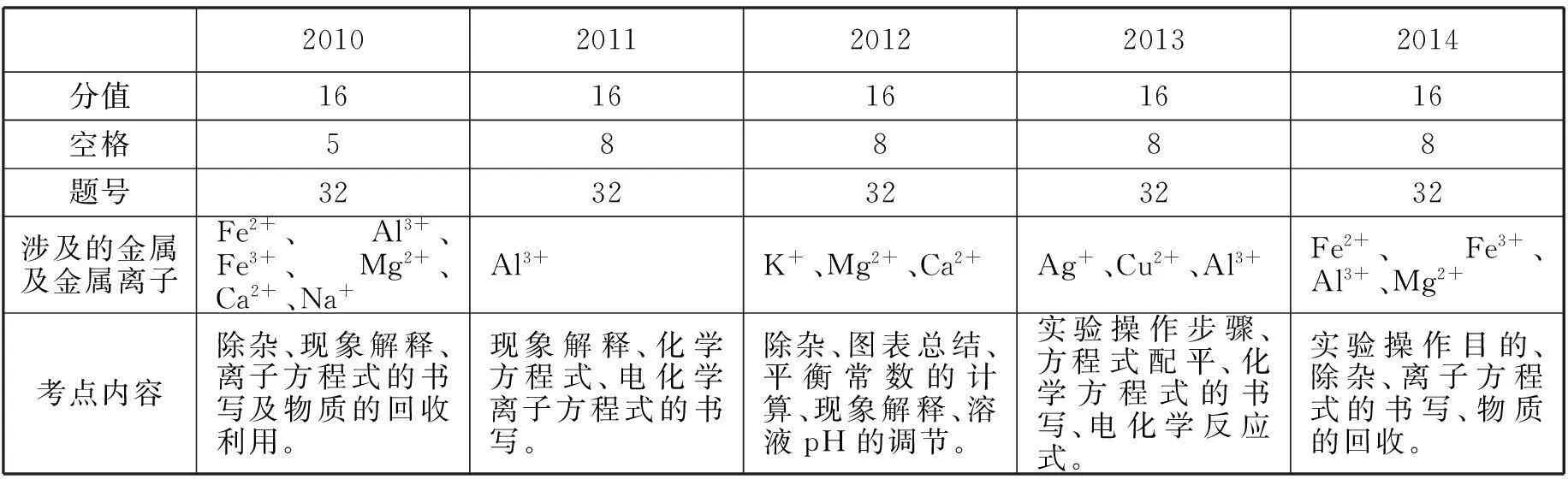
表 2010年到2014年广东高考工艺流程图有关金属的考察
从以上表格可以得出,工艺流程图金属部分一般为16分,所占分值比较大,除了2010外,从2011年到2014年均为8个空格,平均每个空格占两分。涉及到的金属离子有Fe2+,Al3+、Fe3+、Mg2+、Ag+、Cu2+、Ca2+、K+、Na+。
通过历年的广东卷及以上表总结出广东卷工艺流程题金属部分的常见考点有以下几点:
a、混合物的除杂(酸化、沉淀、氧化等);
b、常见离子的检验(Fe3+、Fe2+、Cl-、CO32-、SO42-等);
c、溶液中获得晶体:蒸发浓缩-冷却结晶-过滤-(洗涤);
d、溶液pH的调节(pH测定);
e、物料循环(绿色化学);
f、定量计算或分析(转化率、产量、纯度等)
g、现象的解释(实验步骤的目的、原因、现象和实验步骤的描述)。
二、工艺流程题金属部分出题思想
随着教学改革的进行,现如今高中化学教学更多的是强调将化学知识应用于生产、生活实践的意识。因此高考的出题多是源于生产实际,以解决化学实际问题思路进行设问,使问题更加的贴近生活。高考中该题型考察的知识点多,涉及到化学基础知识的方方面面且试题新颖,题目一般较长,信息量大,信息点多,考察的是阅读能力、资料的收集处理能力和思维能力。
(一)高考中工艺流程题金属部分出题思想主要有以下几个方面:
(1)将原料转化为产品;
(2)除去杂质并分离提纯产品;
(3)提高产量和产率;
(4)“绿色化学”,减少污染;
(5)原料来源丰富,生产低成本;
(6)生产设备简单,生产工艺简便可行。
(二)工艺流程图题型依据实验目的主要分为两类:
A、从混合物中分离、提纯某一物质;
B、利用某些物质制备另一物质。
三、解答工艺流程题
(一)解题步骤
(1)读题:工艺流程图的信息量一般都比较多,第一步是将题目从头到尾粗读一遍,初步了解这道题的大意。
(2)分析推断:理清关系。可以从以下方面几方面入手:
a、弄清楚原料是什么,最终要得到什么产品。中间必须出去什么元素?需要引进什么离子?
b、弄清楚每个步骤与目的:一般只考虑与后面提问有关的步骤,其它不必清楚。
c、信息与迁移:题目所给的信息一般都用,而且一定会用到,题目不会随便给无用的信息。有时候还需要对信息进行分解,重组和迁移到题目中去。
(3)认真作答:一些化学反应现象的解释往往要求用规范的化学用语。比如如何洗涤沉淀,如何判断沉淀是否洗净等。有些问题看似简单,但个别地方往往有悖所学知识,这时就要考虑产物、环保、成本、产量和题目所给的限制条件。
(4)细心检查:回答完后一定要认真检查所写的化学方程式、离子方程式、化学式是否正确,有没有答非所问,是否与实验原理相结合。
(二)解题策略
a、知道原料和产物分别是什么后,要对比分析原料和产物之间的关系。如最终要引进哪种元素或是除去哪种元素。
b、先从简单的步骤入手。有些步骤看不懂可以从后面或前面的步骤来推测。
c、如果考察的知识点课本上没有那么就要仔细看题目所给的信息,高考是不会考考纲里没有的知识点,要考也会给你信息,让你根据所给的信息结合所学的知识来解答。
例:(2013年广东卷)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
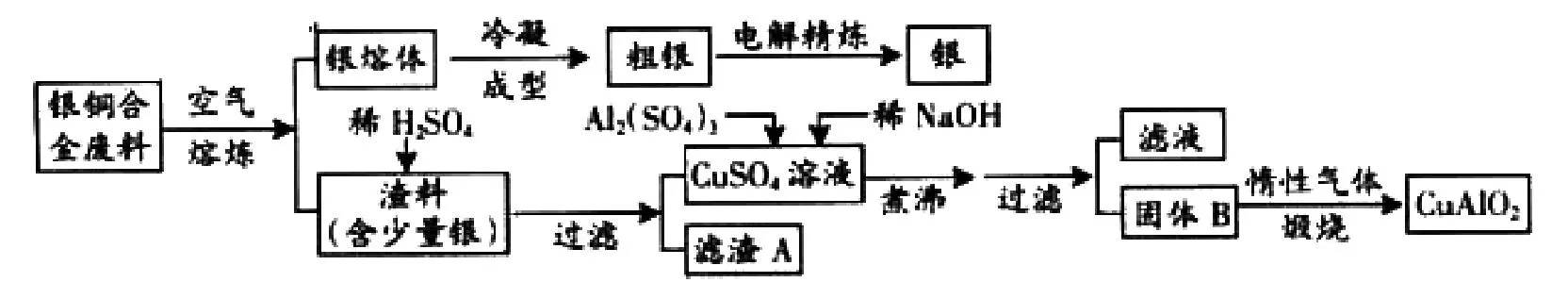
图 工艺流程
(1)电解精练银时,阴极反应式为:____;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为:____。
(2)固体混合物B的组成为:____;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为:____。
(3)完成煅烧过程中一个反应的化学方程式:____。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为____mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液:____L。
(5)CuSO2溶液也可用于制备胆矾,其基本操作时____、过滤、洗涤和干燥。
解析:按基本步骤分析。
1.读题:粗读题目,知此题是以银铜合金废料回收银并制取偏铝酸铜。
2.分析推断:对比原料和产品可知,该生产的主要工序是:一是回收银;二是将原料中的铜离子转化成偏铝酸铜。再进一步分析,通过电解粗银来回收银;通过引入铝离子和一系列的化学反应来制备偏铝酸铜。
3.认真回答:弄清反应原理后,经过计算、分析、推断后即可 逐问回答。
4、答完后认真检查离子方程式和核算计算结果。
答案:(1)电解精炼时,阴极上Ag+得电子生成金属银,电极反应式为Ag++e-=Ag;气体迅速变红是因为生成的NO气体被空气氧化为NO2,2NO+O2=2NO2。
(2)Al2(SO4)3和CuSO4溶液中加入NaOH溶液后得到的固体为Al(OH)3和Cu(OH)2的混合物,但是煮沸后,氢氧化铜在80℃即分解,故应该为氢氧化铝和氧化铜的混合物;在该过程中加入的NaOH过量后会使生成的Al(OH)3溶解,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(3)在该未完成的方程式中,产生的气体只能是氧气,故配平后的方程式为:
4CuO+2Al2O3=4CuAlO2+O2↑。
(4)根据铜守恒可知

因为n(Al)=n(Cu)=n(CuAlO2)=50mol,故需要溶液的体积为25L。
(5)从硫酸铜溶液中得到晶体的过程为,蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
四、总结
化学工艺流程图题是将元素化合物知识和化学实验基础知识以真实的工业流程为载体来进行综合考查,取代了传统的无机框图题。解答流程图题时要勤于思考,养成多问自己“什么”的习惯,如:从原料到产品依次进行了什么反应,利用了什么原理,每一步操作进行到什么程度最佳,每一步除目标物质外还产生了什么杂质或副产物,杂质或副产物用什么方法除去,等等。除此之外,最重要的还是要务实基础知识,重视知识的应用和方法的指导;回归基础通过抓教材、抓题型、抓弱点,抓主干、巧整合,培养自己统摄化学知识的能力;善于归纳、梳理,构建完整的知识体系,加强规范化训练和解题过程性教学,“习惯决定命运,细节决定成败”;除了课本的知识以后,还要多关注一些新兴的化学工艺。

