Mn掺杂改性{010}面择优生长的磷酸铁锂纳米片
陈路路,杨 柳,刘双任,陈金伟,王瑞林
(四川大学材料科学与工程学院,四川 成都 610065)
Mn掺杂改性{010}面择优生长的磷酸铁锂纳米片
陈路路,杨 柳,刘双任,陈金伟,王瑞林
(四川大学材料科学与工程学院,四川 成都 610065)
以LiOH,(NH4)2Fe(SO4)2和NH4H2PO4为原料,抗坏血酸为添加剂通过水热法制备出了{010}晶面择优生长的LiFePO4纳米片,在此基础上以MnSO4为锰源,制备了锰掺杂磷酸铁锂复合材料LiFe1-xMnxPO4/C(x=3%、5%、7%),并研究了不同Mn2+掺杂量对LiFePO4的晶体结构和充放电、交流阻抗(EIS)等电化学性能的影响.XRD、SEM和EDS测试结果表明:Mn2+成功掺入到了LiFePO4晶格中,掺杂后的材料仍是具有橄榄石结构的纳米片,且具有更小的颗粒尺寸,但是{010}晶面的择优情况在一定程度上被抑制了.恒流充放电测试中,在0.1 C倍率下,材料LiFe0.95Mn0.05PO4/C的首次放电比容量达到了165.26 mA·h g-1,表现出了良好的电化学性能.交流阻抗测试结果表明Mn2+的掺杂降低了电荷迁移电阻,提高了材料的电子导电率.
LiFePO4;Mn掺杂;电导率;{010}晶面;水热法
1 引言
自1997年Padhi A K等人[1]首次提出LiFePO4材料可进行Li+的脱出/嵌入以来,近些年LiFePO4凭借其理论容量高(170 mA·h g-1)、工作电压高(3.4V)、安全性能和循环性能较好,且原料来源丰富、价格低廉、环境友好、无记忆效应等优点[2],已经成为锂离子电池正极材料开发者竞相研究的热点.磷酸铁锂电池可应用于储能设备、军事领域等,尤其在轻小型电子产品及电动车领域具有广阔的市场前景.
然而,LiFePO4正极材料电子电导率和离子电导率较低[1],导致倍率性能也较差,不能满足电动汽车等大功率做功的需要.所以,当前迫切需要解决的问题就是对LiFePO4进行改性,以提高材料的电子电导率及离子扩散率,进而有效提高材料的大电流充放电性能.目前,人们研究的主要改性措施有:包覆导电相[3]、掺杂金属离子[4]、细化颗粒尺寸[5]等.另外,由于锂电池充放电过程中,Li+是沿着[010]方向的一维通道进行扩散的[6],电荷转移主要发生在{010}晶面[7],因此,保证{010}的晶体取向也能改进Li+的传导性.
本文在已经通过水热法制备出{010}面择优生长的LiFePO4纳米片的基础上,对其进行掺杂改性,以期体相掺杂在材料晶格内部产生缺陷,进而改善LiFePO4的导电率.而目前对LiFePO4进行Fe位掺杂的金属离子有 Mn2+、Ni2+、Co2+、Mg2+、V3+、Ti4+、Nb5+、Mo6+等[8-15].考虑到Mn2+与Fe2+有相近的离子半径,本文以MnSO4·H2O为Mn源,通过在Fe位掺入不同含量的锰元素,水热合成LiFe1-xMnxPO4(x=0、3%、5%、7%),研究了锰的掺杂对材料的结构和电化学性能的影响等.
2 实验部分
2.1 样品的制备
LiFePO4样品和掺杂样品均采用水热法合成.按化学计量比Li:Fe:Mn:P=3:(1-x):x:1称取LiOH ·H2O、(NH4)2Fe(SO4)2·6H2O、MnSO4·H2O、NH4H2PO4与适量抗坏血酸分别溶于脱氧去离子水中(所用试剂均为分析纯),再混合搅拌并持续通入Ar,调节PH值7.0-7.5[16],得到前驱体溶液,然后在170℃水热反应10 h,冷却后洗涤抽滤并在80℃下真空干燥8 h,得到掺锰的LiFePO4样品.Mn2+的掺杂量分别为0、3%、5%和7%(x,原子分数).将干燥后的产物混合质量分数为30%的抗坏血酸在玛瑙研钵中研磨均匀,置于管式退火炉中,在Ar气保护下以3℃·min-1升温至 600℃ 反应 5 h,得到 LiFe1-xMnxPO4/C样品.
2.2 物理性能表征
XRD测试采用丹东方圆公司DX-2000型X射线衍射仪分析,以CuKα为射线源,波长0.154 nm,工作电压40 kV,管电流25 mA,扫描范围10~80°,扫描速度0.06o/s.粉末的微观形貌和元素含量分析采用日本日立公司S-4800型场发射扫描电子显微镜及其配套EDS器件.
2.3 电化学性能表征
组装成CR2032型扣式模拟电池对正极材料进行电化学性能测试.正极由正极材料、乙炔黑(导电剂)、PVDF(聚偏氟乙烯)按质量比80:10:10,以N-甲基吡咯烷酮(NMP)做分散剂,充分混合后均匀涂于洁净铝箔上,在80℃下真空干燥12 h,然后用打孔器裁成直径15.8 mm的正极片.负极采用相同尺寸的金属锂片,隔膜为Celgard-2400型的聚丙烯微孔膜,电解液为1.0 M的LiPF6/EC+DMC+EMC(体积比1: 1:1).纽扣电池在充满Ar的Lab-2000型手套箱中进行密封装配.充放电测试采用武汉蓝电的LAND电池测试系统,在室温下,电池以不同倍率(以1 C=170 mA·h g-1)进行充放电测试,电压范围2.5-4.2 V.循环伏安(C-V)和交流阻抗(EIS)均使用上海辰华的CHI760B型电化学工作站测试,C-V的电压范围2.5-4.2 V,扫描速率0.1 mV·s-1,EIS的测试频率范围为10-1~105Hz,振幅为5 mV,并使用Zview-Zplot软件对测试结果进行拟合.
3 实验结果与讨论
3.1 XRD分析
图1是Mn掺杂量分别为0、3%、5%和7%(x为原子分数)的样品的XRD图谱.从图中可以看出,四种样品的衍射峰都比较尖锐,且没有呈现其他杂质峰,与LiFePO4标准谱图(PDF#81-1173)的衍射峰十分吻合,可知所制备的LiFe1-xMnxPO4材料都是纯相的橄榄石结构,少量的Mn2+掺杂并未影响材料的晶体结构,说明Mn原子已经进入LiFePO4的晶格内部.分析图谱还可以看出,未掺杂样品的(020)衍射峰明显择优,掺杂量为5%的样品(020)衍射峰也明显高于最强主峰(311),显示一定程度的择优.使用MIDI jade 5.0软件对样品的晶胞参数和晶胞体积进行分析,结果见表1.由数据可知,Mn2+的掺杂导致样品的晶胞尺寸沿各向收缩,晶胞体积减小.而对于正交晶系的LiFePO4,Li+是沿着b轴方向进行扩散的,因此,(020)衍射峰的强度与最强衍射峰(311)的峰强比值越大,材料的电化学性能越好.由XRD计算样品的I(020)/I(311)值,结果表明,掺杂后样品的 I(020)/I(311)减小,其中x=5%的样品减小的程度最低.

图1 不同Mn掺杂量合成的LiFe1-xMnxPO4的XRD谱图Fig.1 XRD patterns of LiFe1-xMnxPO4preparedwith different Mn dophing content.
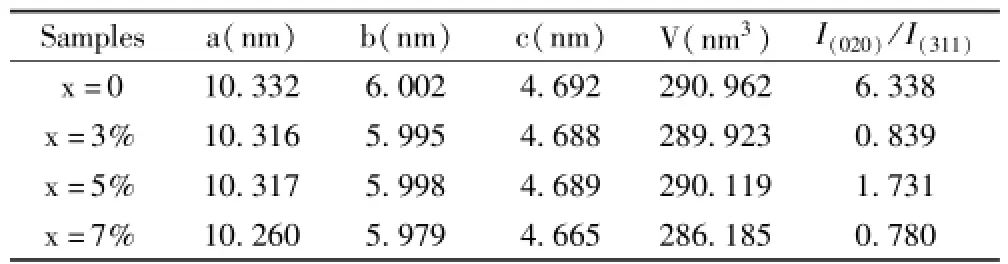
表1 LiFe1-xMnxPO4(x=0、3%、5%、7%)的晶胞参数Table1 Lattice parameters of LiFe1-xMnxPO4(x=0,3%,5%,7%)
3.2 SEM和EDS分析
图2是样品LiFePO4和LiFe0.95Mn0.05PO4分别放大10 k、50 k的SEM图.由图可知,样品粒径均在纳米尺度,且分散良好,形貌规整,粒度分布较匀,具有片状结构,掺杂样品LiFe0.95Mn0.05PO4明显比未掺杂样品 LiFePO4的颗粒细小,晶粒尺寸分别为 300、500nm左右.对于橄榄石结构的LiFePO4,较细的颗粒和充分的结晶是影响材料电化学性能的重要因素[17],本实验得到纳米级的粒子,缩短了Li+在充放电过程中的脱嵌路径[18-20],有助于提高离子导电率,进而改善材料的电化学性能[21].表 2为 LiFe1-xMnxPO4(x=3%、5%、7%)的EDS分析结果,由数据计算可知Mn原子与Fe、Mn原子总数比(Mn:Fe+ Mn)分别为3.27%、5.28%、6.83%,与实验预计方案设定的掺杂量3%、5%、7%基本吻合,说明Mn2+已成功按预设比例掺入到了LiFePO4晶格中.

图2 LiFePO4(a、b)和LiFe0.95Mn0.05PO4(c、d)的SEM图Fig.2 SEM images of LiFePO4(a,b)and LiFe0.95Mn0.05PO4(c,d)
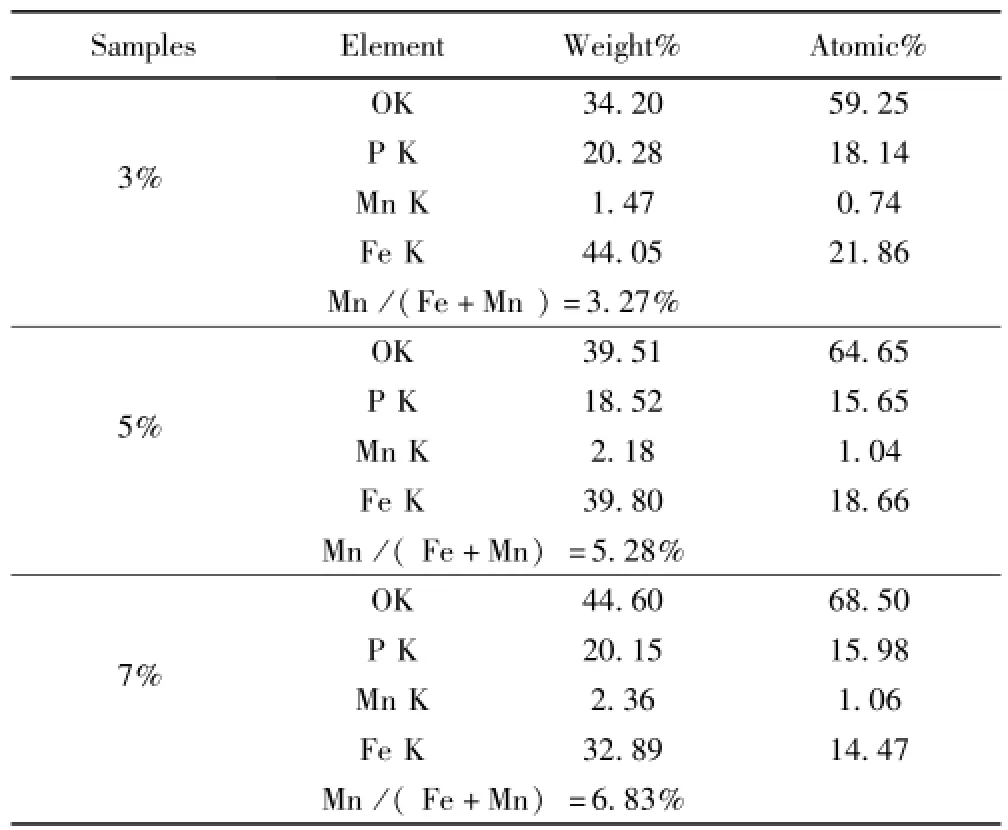
表2 LiFe1-xMnxPO4(x=3%、5%、7%)的EDS分析结果Table2 Contents of element in LiFe1-xMnxPO4(x=3%,5%,7%)tested by EDS
3.3 充放电测试
图3为LiFe1-xMnxPO4/C(x=0%、3%、5%、7%)在0.1 C倍率下的首次充放电曲线.由图可知,样品的首次放电比容量分别为161.64、146.85、165.26和130.64 mA·h g-1,可见LiFe0.95M n0.05PO4/C具有更高的放电比容量.这可能是由于掺杂 Mn2+后,造成晶格缺陷提高了电导率,且样品的颗粒变小,缩短了Li+的扩散路程,从而提高了扩散速率使容量有所增加.但同时,Mn2+的掺杂在一定程度上抑制了(020)晶面的择优生长,不利于Li+的扩散,会使容量有所降低.综上所述,当Mn2+的掺杂量5%时,样品的放电性能最好.
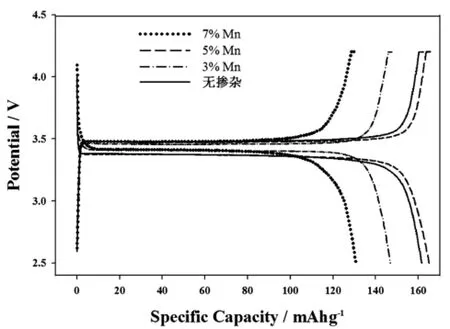
图3 样品LiFe1-xMnxPO4/C(x=0、3%、5%、7%)在0.1 C倍率下的首次充放电曲线Fig.3 Initial charge-discharge curves of LiFe1-xMnxPO4/C (x=0,3%,5%,7%)at0.1 C
图4是LiFe0.95Mn0.05PO4/C复合材料在不同倍率下的首次放电曲线.在0.1C的放电倍率下,复合材料的首次放电比容量达到165.26 mA·h g-1,在0.2、0.5、1.0、2.0和5.0 C的倍率下分别达到了152.85、141.62、120.61、100.78、66.63 mA·h g-1,保持了较高的放电容量.
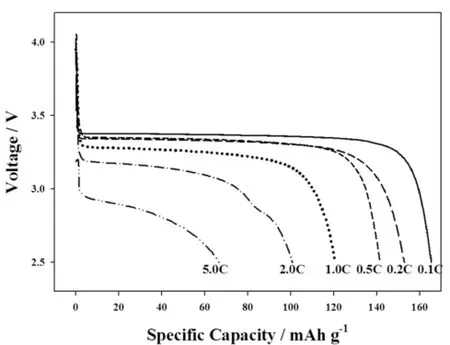
图4 LiFe0.95Mn0.05PO4/C在不同倍率下的首次放电曲线Fig.4 Initial discharge curves of LiFe0.95Mn0.05PO4/C (x=0,3%,5%,7%)at different current densities
3.4 循环伏安测试
为研究不同Mn掺杂量的LiFePO4/C样品在充放电过程中的稳定性,以0.1 mV s-1的扫描速率在2.5-4.2 V区间内进行循环伏安扫描,结果如图5所示.从图中可以看出,样品的氧化还原峰基本对应Fe3+/Fe2+的电对即Li+的脱出和嵌入过程,且对称性较好,表明所有样品的电极反应过程都是可逆的.而随着Mn掺杂量不同,氧化、还原峰出现的位置也不尽相同,峰面积也有差别.Mn含量为0、3% 、5% 和7% 时,氧化还原峰的电位差分别为0.330、0.434、0.306、和0.501V,样品LiFe0.95Mn0.05PO4/C并且其峰形最尖锐,峰电流最大,说明其可逆性最好,氧化还原反应更彻底,更利于提高电池容量,这与充放电测试结果一致.
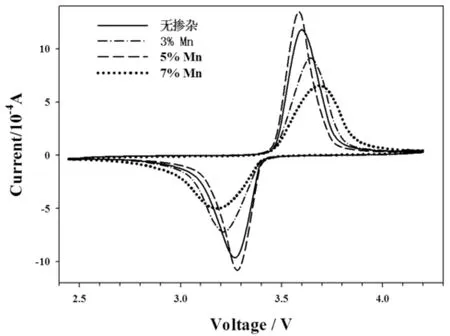
图5 LiFe1-xMnxPO4/C(x=0、3%、5%、7%)的循环伏安曲线Fig.5 Cyclic voltammograms curves of LiFe1-xMnxPO4/C (x=0,3%,5%,7%)
3.5 交流阻抗测试
图6是不同Mn含量样品的交流阻抗(EIS)图谱及其等效电路,EIS通常用来表征电池充放电过程中Li+脱出/嵌入电极的动力学能力.图谱由一个中高频的半圆和低频区的的直线组成.其中半圆反应的是在电极与电解液界面发生的电荷转移时Li+的脱嵌过程,低频区的直线则对应着材料体相中Li+的扩散阻抗ZW.Rs代表电解液的总电阻,即电池内阻.Rct代表电荷传递极化电阻.交换电流密度i0采用如下公式进行计算:
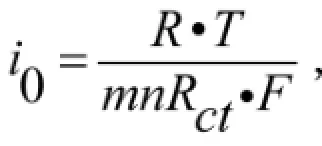
其中R是摩尔气体常数,T是绝对温度,m是活性物质质量,n是转移电子数,F是法拉第常数.
采用Zview-Plot软件对EIS谱进行拟合计算,结果如表3.由于各个样品采用相同的流程做出扣式电池进行测试的,故Rs未发生明显变化,而随着Mn2+的掺入Rct明显减小,i0明显增大,其中样品LiFe0.95Mn0.05PO4/C的Rct为44.01Ω远小于LiFePO4/C的99.43Ω,其i0也具有最大值91.21 mA·g-1,说明Mn2+掺杂降低了电池的电荷转移电阻,提高了材料的导电性.理论研究认为,阻抗减小能改善LiFePO4的动力学性能,提高Li+的嵌入深度,进而提高LiFePO4的电化学性能,故而样品LiFe0.95Mn0.05PO4/C具有最优的电化学性能.
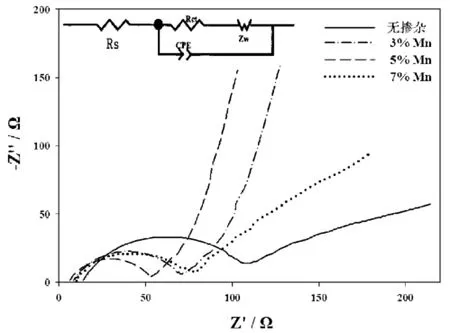
图6 LiFe1-xMnxPO4/C(x=0、3%、5%、7%)的交流阻抗谱图Fig.6 EIS for LiFe1-xMnxPO4/C(x=0,3%,5%,7%)
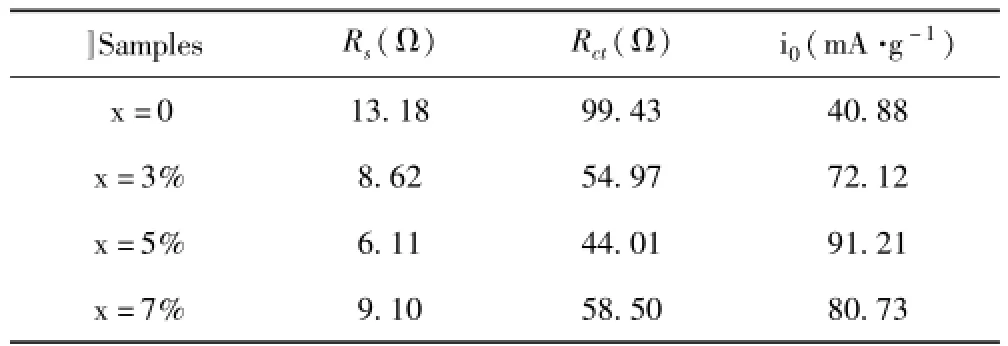
表3 通过等效电路拟合实验数据所得的电极动力学参数测试中的参数Table3 Electrode kinetic parameters obtained from equivalent circuit fitting of experimental data
4 结论
通过水热法合成了一定Mn掺杂比例的纳米级LiFe1-xMnxPO4正极材料,实验结果表明,掺杂后的样品仍为纯相的橄榄石结构,且电导率有所提高,充放电性能、倍率性能和可逆性都较为理想.在0.1 C下,LiFePO4/C及 LiFe0.95Mn0.05PO4/C的首次放电比容量高达161.64,165.26 mA·h g-1,即使在2.0 C的高倍率下,LiFe0.95Mn0.05PO4/C的放电比容量仍然达到了100.78 mA·h g-1,表现出了较好的倍率性能.这是因为,一方面金属离子渗入LiFePO4晶格内部形成缺陷,增强了材料的导电能力,降低了电荷转移电阻,有利于Li+的迁移,从而使容量提升;其次,掺杂减小了颗粒粒径,意味着Li+的扩散路径缩短了,这就在很大程度上避免了因材料内阻产生的部分容量损失,进而提升了容量.另一方面,掺杂以后样品的(020)晶面择优生长情况受到不同程度的抑制,不利于Li+的扩散,即阻碍了容量的进一步提高.
[1]PADHIA K,NANJUNDASWAMY K S,GOODENOUGH JB.Phospho -olivines as Positive-Electrode Materials for Rechargeable Litihum Batteries[J].Electrochemical Society 1997,144(4):1188-1194.
[2]QIAN JF,ZHOU M,CAO Y L,et al.Template-Free Hydrothermal Synthesis of Nanoembossed Mesoporous LiFePO4Microspheres for High -Performance Lithium-Ion Batteries[J].The Journal of Physical Chemistry C,2010,114(8):3477-3482.
[3]BOYANO I,BLAZQUEZ A,MEATZA I D,et al.Preparation of CLiFePO4/polypyrrole lithium rechargeable cathode by consecutive potential steps electrodeposition[J].Journal of Power Sources,2010,195 (16):5351-5359.
[4]NOVIKOVA S,YAROSLAVTSEV S,RUSAKOV VY,et al.LiFe1?xMIIxPO4/C(MII=Co,Ni,Mg)as cathode materials for lithium-ion batteries[J].Electrochimica Acta,2014,122:180-186.
[5]ORVANANOS B,MALIK R,YU H C,et al.Architecture Dependence on the Dynamics of Nano-LiFePO4 Electrodes[J].Electrochimica Acta,2014,137:245-257.
[6]WANG L,HE XM,SUNW T,etal.CrystalOrientation Tuning of LiFe-PO4Nanoplates for High Rate Lithium Battery Cathode Materials[J]. Nano Letters,2012,12(11):5632-5636.
[7]GUO B B,RUAN H C,ZHENG C,et al.Hierarchical LiFePO4 with a controllable growth of the(010)facet for lithium-ion batteries[J]. Scientific Reports,2013,3-2788:1-6.
[8]LIN Y,LIN YB,ZENGB Z,etal.An optimized Mn-doped LiFePO4/ CComposite Synthesized by Carbonthermal Reduction Technique[J]. International Journal of Electrochemical Science,2011,6:6653-6661.
[9]SHU H B,WANG X Y,WU Q,et al.Improved electrochemical performance of LiFePO4/C cathode via Niand Mn co-doping for lithium -ion batteries[J].Journal of Power Sources,2013,237:149-155.
[10]WANG D Y,LIH,SHISQ,et al.Improving the rate performance of LiFePO4by Fe-site doping[J].Electrochimica Acta,2005,50(14): 2955-2958.
[11]YANG ZH,XIA JF,ZHIL H,et al.An improved solid-state reaction route to Mg2+-doped LiFePO4/C cathode material for Li-ion battery[J].Ionics,2014,20(2):169-174.
[12]VUJKOVI M,JUGOVI D,MITRI M,et al.The LiFe(1-x)VxPO4/C composite synthesized by gel-combustion method,with improved rate capability and cycle life in aerated aqueous solutions[J].Electrochimica Acta,2013,109:835-842.
[13]FANC L,HAN SC,LIL F,et al.Structure and electrochemical performances of LiFe1?2xTixPO4/C cathode doped with high valence Ti4+by carbothermal reduction method[J].Journal of Alloys and Compounds,2013,576:18-23.
[14]MA Z P,SHAO G J,WANG G L,et al.Effects of Nb-doped on the structure and electrochemical performance of LiFePO4/C composites [J].Journal of Solid State Chemistry,2014,210(1):232-237.
[15]GAOH Y,JIAO L I,PENGW X,etal.Enhanced electrochemicalperformance of LiFePO4/C via Mo-doping at Fe site[J].Electrochimica Acta,2011,56(27):9961-9967.
[16]LEE JW,TEJA A S.Characteristics of lithium iron phosphate(LiFe-PO4)particles synthesized in subcritical and supercritical water[J]. The Journal of Supercritical Fluids,2005,35(1):83-90.
[17]YAMADA A,CHUNG S C.Crystal Chemistry of the Olivine-Type LiMnyFe1-yPO4and MnyFe1-yPO4as Possible 4 V Cathode Materials for Lithium Batteries[J].Electrochemical Society,2001,148(8):960 -967.
[18]PROSINIP P,CAREWSKA M,SCACCIA S.et al.A New Synthetic Route for Preparing LiFePO4with Enhanced Electrochemical Performance[J].Journal of The Electrochemical Society,2002,149(7):A886 -A890.
[19]HUANG H,YIN SC,NAZAR L F.Approaching Theoretical Capacity of LiFePO4at Room Temperature at High Rates[J].Electrochemical and Solid-State Letters,2001,4(10):A170-A172.
[20]ANDERSSON A S,THOMASJO.The source of First-cycle capacity loss in LiFePO4[J].Journal of Power Sources,2001,97-98:498-502.
[21]YING JR,LEIM,JIANG C Y,et al.Preparation and characterization of high-density spherical Li0.97Cr0.01FePO4/C cathode material for lithium ion batteries[J].Journal of Power Sources,2006,158(1):543 -549.
(责任编辑:张阳,付强,李建忠,罗敏;英文编辑:周序林)
M n-doped modification of lithium iron phosphate nanoplates w ith{010}p lane preferential growth
CHEN Lu-lu,YANG Liu,LIU Shuang-ren,CHEN Jin-wei,WANG Rui-lin
(School ofMaterials Science and Engineering,Sichuan University,Chengdu 610065,P.R.C.)
LiFe1-xMnxPO4(x=0%,3%,5%,7%)was prepared by hydrothermalmethod.Microstructure and electrochemical properties of thewere studied.The structure and morphology of the sampleswere characterized by X-ray diffraction(XRD)and scanning electronmicroscope(SEM),electrochemical performanceswere investigated by constant current charge-discharge and electrochemical impedance spectroscopy(EIS).The results showed that Mn-doped LiFePO4preserved pure olivine structure and nanoplatesmorphology.Although the preferred growth of{010}planes was inhibited in some degree,but the particle size decreased and the electronic conductivity of LiFe1-xMnxPO4increased.The Mn-doped LiFePO4had a reversible capacity of165.26 mA·h g-1at 0.1 C discharge rate,and showed good electrochemical properties.
LiFePO4;Mn-doping;electronic conductivity;{010}plane;hydrothermalmethod
TM911;O614.111
A
2095-4271(2015)03-0373-06
10.11920/xnmdzk.2015.03.021
2015-03-23
陈路路(1988-),女,汉族,河南确山人,硕士研究生,研究方向:新能源材料与器件.
王瑞林(1960-),男,教授,博士生导师,E-mail:rl.wang@scu.edu.cn.
四川省应用基础研究(2013JY0150);中物院科研基金(HG2012039);四川省科技支撑计划(2013FZ0034)

