Twist在口腔鳞状细胞癌中的表达及其与鳞状细胞癌上皮间质化的关系
孙昊轩 冯红超 宋宇峰
1.贵州医科大学附属口腔医院口腔颌面外科,贵阳 550004;2.贵阳市口腔医院,贵阳 550002;3.贵州省食品药品监督管理局,贵阳 550000
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部最常见的恶性肿瘤,由于面部特殊解剖结构与生理功能的影响,因此OSCC易发生淋巴转移及远处转移。上皮间质化(epithelialmesenchymal transition,EMT)是指上皮细胞在特定的生理和病理情况下向间充质细胞转化的现象[1]。研究[2-3]显示,EMT在胚胎发育、组织发生等过程中起重要作用,并且是肿瘤侵袭周围正常组织发生转移的必备条件。EMT相关蛋白Twist是新近发现的可赋予细胞迁移能力的转录因子。为了阐明OSCC中是否存在EMT而导致其易转移的恶性生物学行为,本研究通过免疫组织化学染色和荧光原位杂交的方法对30例OSCC标本中Twist的表达进行了检测,同时以免疫组织化学法对其他EMT相关蛋白,包括上皮源性标志物E-钙黏蛋白(E-cadherin,E-cad)和细胞角蛋白(cytokeratin,CK),间质源性标志物N-钙黏蛋白(N-cadherin,N-cad)进行检测和分析,以期为OSCC转移的预测和预后评估提供有价值的资料。
1 材料和方法
1.1 材料
1.1.1 标本选择 收集贵州医科大学附属口腔医院口腔颌面外科2009—2014年手术切除的组织蜡块保存完好的OSCC标本,要求术前未采取任何针对肿瘤的治疗措施,如放疗、化疗等,术后均经常规病理检查确诊为OSCC。
1.1.2 临床资料 共选择OSCC患者30例,男22例,女8例;高分化22例,中低分化8例;无淋巴结转移10例,有淋巴结转移20例;无发生远处转移者。另选择10例正常口腔黏膜组织作对照。
1.1.3 试剂 小鼠抗人CK单克隆抗体、小鼠抗人波形蛋白单克隆抗体、小鼠抗人N-cad单克隆抗体、小鼠抗人E-cad单克隆抗体及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司,兔抗人Twist单克隆抗体购自北京博奥森生物技术有限公司;Twist mRNA原位杂交试剂盒购自武汉博士德生物工程有限公司。
1.2 实验方法
1.2.1 免疫组织化学SP法 组织蜡块行厚5 μm的连续切片,脱蜡水化后,3%去离子过氧化氢液封闭内源性过氧化物酶,微波热处理修复抗原,正常山羊血清封闭特异性抗原,分别加入Twist(1∶100)、E-cad(1∶100)、N-cad(1∶100)和CK一抗工作液,4 ℃孵育过夜,加入生物素化二抗,DAB显色,苏木素复染,中性树胶封固。PBS代替一抗做阴性对照。实验步骤按照试剂说明书严格进行。另取一张切片行苏木精-伊红(hematoxylin-eosin,HE)染色。
1.2.2 原位杂交 原位杂交探针为地高辛标记的Twist寡核苷酸探针。Twist mRNA序列:1)5'-AGCAACAGCGAGGAGGAGCCAGACCGGCACCAGCC-3';2)5'-CGCAAGCGGCGCAGCAGCAGGCGCAGCGCGGGCGG-3';3)5'-GACGAGCCGGGCAGCCCGGCCCAGGGCAAGCGCGG-3'。操作步骤严格按照试剂说明书进行。通过不加探针原位杂交用PBS和阴性标本作对照,以排除特异性染色。
1.2.3 结果判定 免疫组织化学及原位杂交每例切片随机选择10个视野(放大200倍)拍照。以Imageproplus图像分析系统进行平均光密度(mean optical density,MOD)分析[4],分析中进行了光密度校准及空间标定,按照阳性表达范围在照片中画出测量区域,即总面积A,读取积分光密度(integral optical density,IOD)数值,作为这张照片的累积光密度值。MOD计算方法为MOD=IOD/A。
1.3 统计学分析
各组间光密度的差异根据组别大小分别采用两样本t检验(若方差不齐,采用t'检验)或单因素方差分析,数据应用SPSS 11.5统计软件完成,检验水准为双侧α=0.05。
2 结果
N-cad阳性信号主要定位于细胞膜,高表达于OSCC的癌巢部位,在癌巢周围鳞状上皮层内无表达(图1A);Twist阳性区域主要定位于细胞质和细胞核,呈棕黄、棕褐色颗粒,多表达于多形性结构的细胞,少量表达于上皮形态的细胞(图1B);E-cad阳性信号主要定位于正常组织细胞质及细胞膜(图1C),在OSCC组织中多表达于有细胞极性的鳞状上皮部分,呈浅淡的点状分布,多数癌巢组织无着色表现;CK主要定位于细胞质(图1D),与周围正常组织相比,在癌巢部位的表达相对较低。Twist mRNA主要定位于细胞核,棕褐色的颗粒主要分布在癌组织浸润的前缘(图1E);正常口腔黏膜组织内未见明显染色。

图1 免疫组织化学染色和原位杂交结果 SP × 20Fig 1 Immunohistochemical staining and in situ hybridization results SP × 20
Twist、Twist mRNA、E-cad、N-cad、CK在OSCC与正常组织表达的MOD值见表1:在OSCC组织中,Twist和N-cad的表达明显高于正常组织,而E-cad及CK的表达明显低于正常组织(P<0.05)。
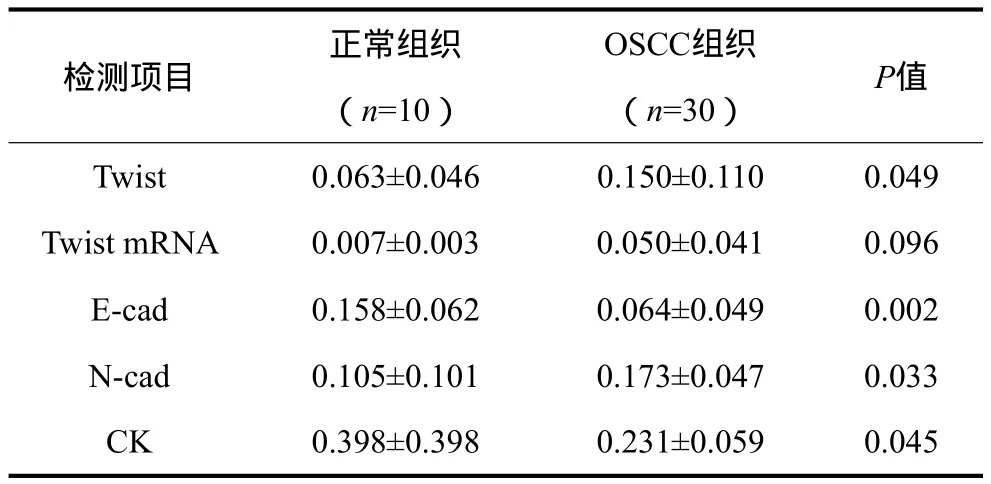
表1 Twist、Twist mRNA、E-cad、N-cad、CK在OSCC与正常组织表达的MOD值Tab 1 MOD values of Twist, Twist mRNA, E-cad, N-cad and CK between OSCC and normal oral tissues
OSCC组织中Twist mRNA的表达与临床病理资料的关系见表2,Twist、E-cad、N-cad、CK的表达与临床病理资料的关系见表3。由表2可见,Twist mRNA在OSCC中低分化组,T3、T4组和有淋巴结转移组的表达量分别高于高分化组,T1、T2组和无淋巴结转移组,其差异有统计学意义(P<0.05)。
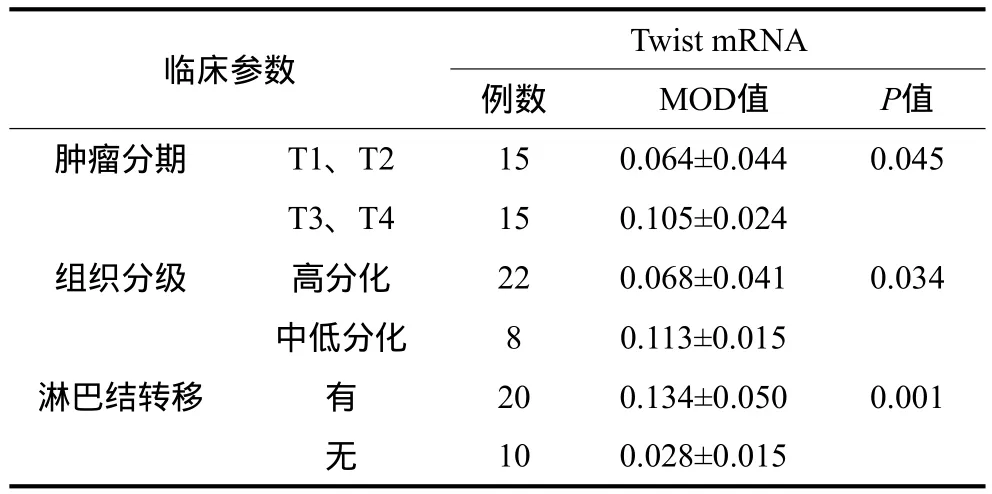
表2 OSCC组织中Twist mRNA的表达与临床病理资料的关系Tab 2 Relationship of Twist mRNA expression and clinical pathology data in OSCC

表3 OSCC组织中Twist、E-cad、N-cad、CK的表达与临床病理资料的关系Tab 3 Relationship among the clinico-pathologic data with the expressions of Twist, E-cad, N-cad, and CK
由表3可见,在OSCC中低分化组,Twist、N-cad 的表达高于高分化组,E-cad及CK的表达低于高分化组;在有淋巴结转移组中,Twist、N-cad的表达高于无淋巴结转移组,E-cad及CK的表达低于无淋巴结转移组,以上差异均有统计学意义(P<0.05);而Twist、E-cad、N-cad、CK的表达在不同肿瘤分期中无明显差异(P>0.05)。
3 讨论
1982年,Greenburg等[5]提出了EMT的概念。EMT是指在某些特殊的生理或病理条件下,上皮细胞表型缺失并获得间质细胞特性,细胞的迁移和运动能力增强[6]。近年有研究发现,E-cad可作为独立指标预测OSCC患者的生存结果[7],E-cad表达的变化在EMT过程中具有至关重要的作用[8]。E-cad是一种钙连接蛋白,用于维持正常细胞间连接的稳定性。在上皮细胞发生EMT以及癌症的发生过程中,经常会发现E-cad表达的下调[9],可以作为癌细胞失去上皮特性的金标准[10]。本研究结果中,E-cad在OSCC组的表达明显低于正常组织,提示在OSCC中可能发生了EMT现象;在中低分化组和有淋巴结转移组的表达明显低于高分化组和无淋巴结转移组,提示OSCC上皮细胞失去极性且细胞间的黏附作用不稳定,从而实现细胞从原发灶中的分离,导致细胞移动力加强。在T1、T2组与T3、T4组的比较中,E-cad的表达并无明显差异,结合镜下观察,在发生EMT后E-cad仍表达于肿瘤中的鳞状上皮部分。由此推测,不同大小的肿瘤可同时存在着EMT细胞和非EMT细胞。
CK是各种单层上皮、腺上皮以及复层上皮表达的一种中间纤维蛋白,具有高度的细胞和组织特异性,不同组织来源及不同分化状态的上皮细胞CK的表达具有一定特异性,CK表达谱的改变可以作为上皮细胞分化过程的标志物[11-12]。本实验发现,在不同的肿瘤分期中(T3、T4组与T1、T2组)均能检测到CK表达,且无明显差异,提示在肿瘤大小与浸润程度方面,肿瘤细胞均出现上皮细胞表型,与本实验E-cad所得结论相同。本研究中,CK主要定位于细胞质,其在OSCC中低分化组和有淋巴结转移组的表达明显低于高分化组和无淋巴结转移组,提示OSCC低分化与淋巴结转移中,上皮表型特征的间质化趋向增大,说明OSCC中发生了EMT现象并且可能影响患者的预后。目前的研究对CK在参与EMT过程中的机制尚无定论,但在易转移和低分化的OSCC患者中均呈现出上皮标志物的丧失,证实了在OSCC中存在着EMT现象。
N-cad是钙黏蛋白家族的另外一种黏附因子,主要介导间叶细胞间的动态黏附作用。N-cad通过转录水平启动后,间接作用于E-cad的合成,抑制其转录表达,促进肿瘤细胞侵袭转移[13]。本研究结果显示:不同T分期比较中,T1、T2组MOD值低于T3、T4组,虽然两组的差异无统计学意义,但肿瘤大小和N-cad的表达体现出正相关趋势。分析原因,可能是N-cad的高表达使细胞赋予了流动性,可使癌细胞脱出上皮结构,使肿瘤的侵袭性加强,与王博等[14]等研究结果基本一致。N-cad在中低分化组织及出现淋巴结转移组织中的表达较高,而同组的E-cad表达降低,提示在OSCC中,肿瘤发生淋巴结转移的组织中更多地发生了钙黏着蛋白转化(cadherin switch)现象[15-16]。有学者[17]认为,随着肿瘤大小的增加和发生淋巴结转移,可能也存在着E-cad向N-cad的转化现象。这些结果均提示,E-cad和N-cad或可作为OSCC浸润转移的预测指标,联合检测E-cad和N-cad可能会筛选出OSCC患者中的易转移人群。
Twist基因是一种位于常染色体上的编码碱性螺旋-环-螺旋的转录因子,可以调节组织发育中的组织重建,并赋予细胞迁移的能力;Twist基因的过量表达可能促进细胞表型的恶性转化,可能是某些恶性肿瘤发生发展的关键因素[18-19]。Satoh等[20]通过提高Twist的表达,发现E-cad和β-链蛋白(β-catenin)呈低表达状态,其肝脏和腹膜转移的发生率明显增加。本实验原位杂交结果显示:Twist mRNA在T3、T4分组中的表达明显高于T1、T2组,免疫组织化学结果在肿瘤T分期的比较中无统计学差异,但Twist mRNA在OSCC中低分化组和有转移淋巴结组的表达分别高于高分化组和无淋巴结转移组,提示在OSCC中Twist mRNA的过表达可能是影响肿瘤分化和转移的危险因素。因Twist在肿瘤转移阶段表达明显增强,所以推测OSCC上皮细胞往往早期就出现间质转化而致淋巴转移;由于侵袭力强、癌细胞分裂速度加快,出现大量中低分化细胞。有研究[21]表明,低分化的癌细胞导致了肿瘤的转移倾向。本研究的免疫组织化学结果中,Twist在OSCC中低分化组和有淋巴结转移组的表达明显高于高分化组和无淋巴结转移组,结合E-cad和N-cad的表达差异,推测Twist可能表达上调后直接与E-cad的启动子结合,抑制E-cad的表达,而Twist与N-cad的表达呈正相关,通过抑制E-cad和促进N-cad转录表达,调控EMT的发生,使上皮细胞极性和细胞间黏附能力丧失,而获得间质特性及细胞移动能力,最终发生侵袭及远处转移[22]。Krisanaprakornkit等[23]通过上调舌癌小鼠体内的Twist基因,发现小鼠出现肺癌转移导致呼吸困难。上调Twist表达后与对照组相比存活率明显降低,证实Twist表达的升高与患者不良预后有关;通过对人OSCC的研究,提示干扰Twist的表达是减少OSCC侵袭的潜在治疗方法。结合本实验结果发现,Twist和E-cad、N-cad的表达水平有明显相关性,而Twist和CK在表达变化上无明显相关性;由此推测,联合检测Twist、E-cad和N-cad的表达可能会更有效地判断和预测OSCC的转移。
OSCC的浸润和转移是一个多因素共同作用的复杂病理过程。本研究结果证实,在人OSCC中存在EMT现象;OSCC中Twist可以通过调节E-cad、N-cad及相关蛋白的变化促进肿瘤细胞发生EMT,促进肿瘤的生长和转移。随着研究的深入,会有助于进一步阐明Twist对OSCC恶性生物学行为的影响,为Twist靶向治疗提供依据。
[1]Shook D, Keller R. Mechanisms, mechanics and function of epithelial-mesenchymal transitions in early development[J]. Mech Dev, 2003, 120(11):1351-1383.
[2]Hlubek F, Spaderna S, Jung A, et al. Beta-catenin activates a coordinated expression of the proinvasive factors laminin-5 gamma2 chain and MT1-MMP in colorectal carcinomas[J].Int J Cancer, 2004, 108(2):321-326.
[3]Gavert N, Conacci-Sorrell M, Gast D, et al. L1, a novel target of beta-catenin signaling, transforms cells and is expressed at the invasive front of colon cancers[J]. J Cell Biol, 2005,168(4):633-642.
[4]李涛, 范妤, 刘芳. 免疫组织化学图像光密度分析的标准化方法[J]. 解剖学杂志, 2008, 31(5):727-728.
[5]Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol, 1982, 95(1):333-339.
[6]Savagner P. The epithelial-mesenchymal transition (EMT)phenomenon[J]. Ann Oncol, 2010, 21(Suppl 7):vii89-vii92.[7]Fan CC, Wang TY, Cheng YA, et al. Expression of E-cadherin,Twist, and p53 and their prognostic value in patients with oral squamous cell carcinoma[J]. J Cancer Res Clin Oncol,2013, 139(10):1735-1744.
[8]Chao YL, Shepard CR, Wells A. Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J]. Mol Cancer, 2010, 9:179.
[9]Christofori G, Semb H. The role of the cell-adhesion molecule E-cadherin as a tumour-suppressor gene[J]. Trends Biochem Sci, 1999, 24(2):73-76.
[10]Liu AN, Zhu ZH, Chang SJ, et al. Twist expression associated with the epithelial-mesenchymal transition in gastric cancer[J]. Mol Cell Biochem, 2012, 367(1/2):195-203.
[11]Moll R, Franke WW, Schiller DL, et al. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured c/ells[J]. Cell, 1982, 31(1):11-24.
[12]Nagle RB. Intermediate filament expression in prostate cancer[J]. Cancer Metastasis Rev, 1996, 15(4):473-482.
[13]Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004, 117(7):927-939.
[14]王博, 张传平, 张舒, 等. EMT介导口腔鳞癌淋巴结转移及其机制研究[J]. 中国肿瘤临床, 2012, 39(23):1877-1880.
[15]Gravdal K, Halvorsen OJ, Haukaas SA, et al. A switch from E-cadherin to N-cadherin expression indicates epithelial to mesenchymal transition and is of strong and independent importance for the progress of prostate cancer[J]. Clin Cancer Res, 2007, 13(23):7003-7011.
[16]Miao Y, Li AL, Wang L, et al. Overexpression of NEDD9 is associated with altered expression of E-Cadherin, β-Catenin and N-Cadherin and predictive of poor prognosis in nonsmall cell lung cancer[J]. Pathol Oncol Res, 2013, 19(2):281-286.
[17]Zhao D, Tang XF, Yang K, et al. Over-expression ofintegrinlinked kinase correlates with aberrant expression of Snail,E-cadherin and N-cadherin in oral squamous cell carcinoma:implications in tumor progression and metastasis[J]. Clin Exp Metastasis, 2012, 29(8):957-969.
[18]Vernon AE, LaBonne C. Tumor metastasis: a new twist on epithelial-mesenchymal transitions[J]. Curr Biol, 2004, 14(17):R719-R721.
[19]Elias MC, Tozer KR, Silber JR, et al. TWIST is expressed in human gliomas and promotes invasion[J]. Neoplasia, 2005,7(9):824-837.
[20]Satoh K, Hamada S, Kimura K, et al. Up-regulation of MSX2 enhances the malignant phenotype and is associated with twist 1 expression in human pancreatic cancer cells[J]. Am J Pathol, 2008, 172(4):926-939.
[21]Califano J, van der Riet P, Westra W, et al. Genetic progression model for head and neck cancer: implications for field cancerization[J]. Cancer Res, 1996, 56(11):2488-2492.
[22]Yun SJ, Kim WJ. Role of the epithelial-mesenchymal transition in bladder cancer: from prognosis to therapeutic target[J]. Korean J Urol, 2013, 54(10):645-650.
[23]Krisanaprakornkit S, Iamaroon A. Epithelial-mesenchymal transition in oral squamous cell carcinoma[J]. ISRN Oncol,2012:681469.

