程序性死亡分子1及其配体在口腔鳞状细胞癌患者外周血中的表达及临床意义
张鹏 欧阳少波 王军 黄自坤 王娇龙 廖岚
1.南昌大学附属口腔医院修复科;2.南昌大学第二附属医院口腔颌面外科;3.南昌大学第一附属医院检验科,南昌 330006
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC,以下简称口腔鳞癌)是头颈部最常见的恶性肿瘤之一,近年来其发病率有逐年增高的趋势[1]。研究证实,肿瘤细胞可通过免疫逃逸使肿瘤免受宿主防御机制的杀伤[2]。近年来,共刺激分子在肿瘤免疫应答中的作用备受关注[3-5],其中,新近发现的B7家族共刺激分子程序性死亡分子配体1(programmed death ligand-1,PD-L1)已被证实是介导肿瘤免疫逃逸的重要分子之一。PD-L1与其受体程序性死亡分子1(programmed death-1,PD-1)结合后介导的负性信号可抑制T淋巴细胞的激活、增殖及细胞因子的分泌,消弱宿主的抗肿瘤免疫反应,从而参与肿瘤的发生、发展过程[6]。Tsushima等[7]及Cho等[8]研究发现,口腔鳞癌细胞上PD-L1的表达升高。随后的研究[9]中,PD-1/PD-L1与口腔鳞癌的相互关系倍受关注,但口腔鳞癌患者外周血中PD-1/PD-L1变化情况及其与口腔鳞癌诸多临床病理特征的关系尚不清楚。本研究通过流式细胞术检测口腔鳞癌患者及健康对照者外周血T淋巴细胞亚群数量及CD4+、CD8+T淋巴细胞表面PD-1/PD-L1的表达水平,通过酶联免疫吸附方法检测血清中可溶性PD-1(soluble PD-1,sPD-1)和可溶性PD-L1(soluble PD-L1,sPD-L1)的表达水平,从而探讨PD-1/PD-L1途径在口腔鳞癌中的临床意义。
1 材料和方法
1.1 研究对象
选取2010年8月—2013年10月南昌大学第二附属医院口腔颌面外科收治的口腔鳞癌患者82例为口腔鳞癌组,其中,男48例,女34例;年龄30~72岁,中位年龄57岁。纳入要求:口腔鳞癌患者术前未进行过化疗、放疗或其他生物治疗,且无全身性免疫系统疾病。鳞癌原发灶及颈淋巴结转移灶均由南昌大学第二附属医院病理科确诊,其中舌癌36例,牙龈癌22例,颊黏膜癌13例,唇癌7例,腭癌4例;TNM分期,Ⅰ+Ⅱ期52例,Ⅲ+Ⅳ期30例;伴淋巴结转移21例,无淋巴结转移61例。对照组为同期本院体检中心性别、年龄匹配的健康体检者25例,其中男15例,女10例;年龄28~70岁,中位年龄54岁。本研究中所有研究对象均知情同意并签署知情同意书。
1.2 试剂和仪器
异硫氰酸荧光素标记的CD4抗体(fluorescein isothiocyanate-CD4,FITC-CD4)、藻红蛋白(phycoerythrobilin,PE)-Cy5标记的CD8抗体(PE-Cy5-CD8)、藻红蛋白-得克萨斯红(energy coupled dye,ECD)标记的CD3抗体(ECD-CD3)(Beckman Coulter公司,美国),PE标记的鼠抗人PD-1(PE-PD-1)、PD-L1(PE-PD-L1)抗体及各种同型对照IgG抗体(eBioscience公司,美国),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒Human-sPD-1 Kit和Human-sPD-L1 Kit(R&D公司,美国),Cytomics FC 500流式细胞仪(Beckman Coulter公司,美国),酶标仪(Bio-Tek公司,美国)。
1.3 方法
1.3.1 标本的收集及处理 所有研究对象均为清晨空腹采血,用普通促凝真空采血管和EDTA-K2抗凝真空采血管采静脉血(外周血)各2 mL。EDTA-K2抗凝血标本置4 ℃保存,6 h内送检;促凝血室温静止30 min,3 000 r·min-1离心5 min后取上清液,-80 ℃冻存备用。
1.3.2 T淋巴细胞亚群检测 取2支流式细胞分析管,其中一支加入荧光素标记单抗ECD-CD3、FITC-CD4和PE-Cy5-CD8各5 μL,另外一支加入相应同型对照IgG抗体。在两支试管中各加入EDTA-K2抗凝血50 μL,室温避光孵育15 min,加入经10倍稀释的溶血素200 μL,静置10 min后,1 500 r·min-1离心5 min,弃上清,加生理盐水洗涤细胞2次,弃上清,用生理盐水重悬经Cytomics FC 500流式细胞仪检测。
1.3.3 T淋巴细胞表面PD-1、PD-L1表达的检测 取3支流式细胞分析管,其中一支加入荧光素标记单抗FITC-CD4、PE-Cy5-CD8和PE-PD-1各5 μL,一支加入FITC-CD4、PE-Cy5-CD8和PE-PD-L1各5 μL,另外一支中加入相应同型对照 IgG 抗体。两支试管中各加EDTA-K2 抗凝血50 μL,室温避光孵育15 min,加入经10倍稀释的溶血素200 μL,静置10 min后,1 500 r·min-1离心5 min,弃上清,加生理盐水洗涤细胞2次,弃上清,用生理盐水重悬经Cytomics FC 500流式细胞仪检测。
1.3.4 血清sPD-1、sPD-L1表达的检测 采用ELISA法检测血清sPD-1、sPD-L1的含量,操作步骤参照试剂盒说明书进行。简要操作步骤如下:将sPD-1、sPD-L1标准品依次稀释,在96孔板中分别加入100 μL血清样品或标准品,室温孵育2 h,清洗液洗2次,然后加入100 μL酶标二抗室温孵育2 h,清洗液洗2次,加入100 μL显色剂避光孵育20 min,反应结束后加入50 μL终止液,酶标仪读取450 nm吸光度值,根据标准品吸光度绘制标准曲线,然后计算血清sPD-1、sPD-L1的浓度。
1.4 统计学分析
采用SPSS 17.0软件对计量资料进行方差齐性检验和正态性检验,各组检测值均符合正态分布且方差齐,两组间比较用独立样本t检验进行统计分析,三组间用单因素方差分析,两两间比较采用SNK-q检验。口腔鳞癌患者CD4+/CD8+T淋巴细胞亚群百分数比值与外周血CD4+、CD8+T淋巴细胞表面PD-1阳性表达率的相关性应用Pearson相关进行分析。将口腔鳞癌患者按临床病理参数(性别、年龄、肿瘤部位、大小、临床分期、分化程度及颈淋巴结是否转移)进行分组,应用Pearson相关分析口腔鳞癌患者血清中sPD-L1水平、PD-1的阳性T细胞百分率与临床病理特征的关系。P<0.05表示差异有统计学意义。
2 结果
2.1 口腔鳞癌组与对照组外周血T淋巴细胞亚群的比较
口腔鳞癌组与对照组外周血T淋巴细胞亚群的比较结果见表1。口腔鳞癌组外周血CD3+、CD4+T淋巴细胞亚群百分数及CD4+/CD8+T淋巴细胞亚群百分数比值均低于对照组,差异有统计学意义(P<0.05);口腔鳞癌组CD8+T淋巴细胞亚群百分数则高于对照组,差异有统计学意义(P<0.05)。
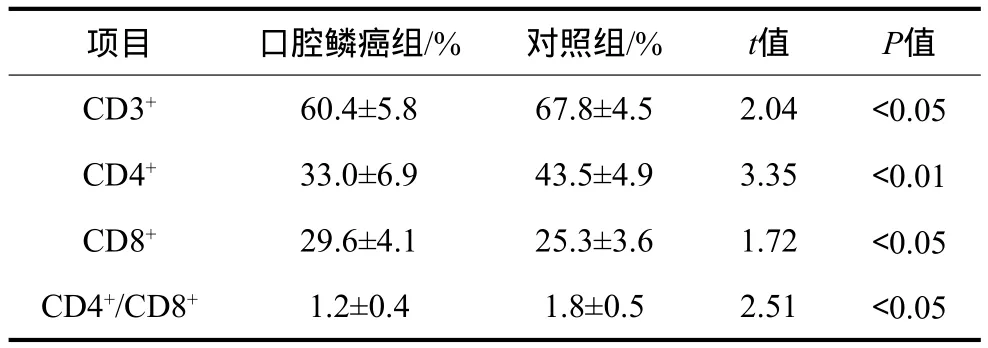
表1 口腔鳞癌组与对照组外周血T淋巴细胞亚群的水平Tab 1 The expression of peripheral blood T lymphocyte subsets from OSCC group and control group
2.2 口腔鳞癌组与对照组外周血T淋巴细胞表面PD-1、PD-L1的表达水平
口腔鳞癌组与对照组CD4+、CD8+T淋巴细胞表面PD-1及PD-L1的表达水平见表2。口腔鳞癌患者外周血CD4+、CD8+T淋巴细胞表面PD-1、PD-L1的表达水平均高于对照组,差异具有统计学意义(P<0.01)。
2.3 口腔鳞癌患者CD4+/CD8+ T淋巴细胞亚群百分数比值与外周血CD4+、CD8+ T淋巴细胞表面PD-1阳性表达率的相关性
相关分析结果显示,口腔鳞癌患者CD4+/CD8+T淋巴细胞亚群百分数比值与外周血CD4+T淋巴细胞表面PD-1的阳性表达率相关(r=0.446,P<0.01),与CD8+T淋巴细胞表面PD-1的阳性表达率不相关(P>0.05)。
2.4 口腔鳞癌组与对照组血清中sPD-1、sPD-L1的表达水平
口腔鳞癌组与对照组血清中sPD-1、sPD-L1的表达水平见表3。口腔鳞癌组血清sPD-L1水平高于对照组,差异有统计学意义(P<0.05),而sPD-1水平二者的差异无统计学意义(P>0.05)。对口腔鳞癌患者CD4+/CD8+T淋巴细胞亚群百分数比值与患者血清sPD-L1水平进行相关性分析,结果显示,口腔鳞癌患者CD4+/CD8+T淋巴细胞亚群百分数比值与患者血清sPD-L1水平相关(r=0.353,P<0.01)。
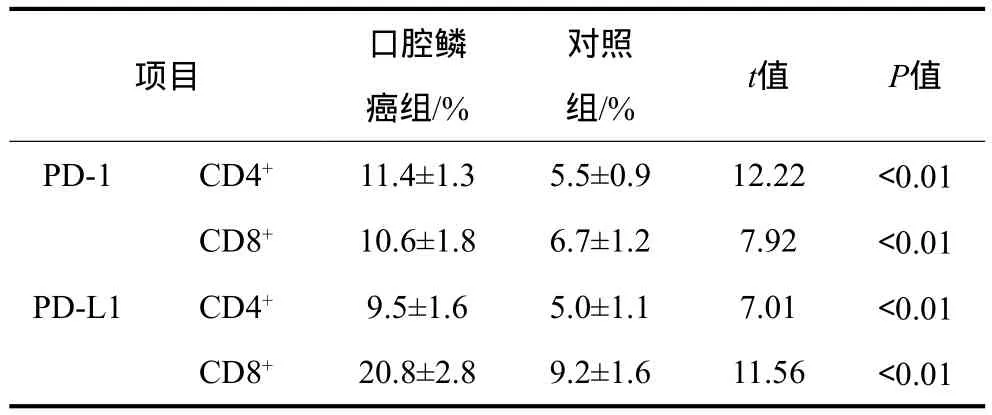
表2 口腔鳞癌组与对照组CD4+、CD8+ T淋巴细胞表面PD-1及PD-L1的水平Tab 2 The expression of PD-1 and PD-L1 in CD4+, CD8+T cells from OSCC group and control group

表3 口腔鳞癌组与对照组血清中sPD-1、sPD-L1的水平Tab 3 The expression of sPD-1 and sPD-L1 in serum from OSCC group and control group
2.5 口腔鳞癌患者血清中sPD-L1含量与患者临床病理特征的关系
相关性分析结果显示,sPD-L1的表达与临床分期、细胞分化程度以及淋巴结转移状态相关(P<0.05)。Ⅲ+Ⅳ期患者血清sPD-L1水平(450.2 pg·mL-1±85.2 pg·mL-1)高于Ⅰ+Ⅱ期患者(414.0 pg·mL-1±83.4 pg·mL-1)(P<0.05);有淋巴结转移患者血清sPD-L1水平(483.3 pg·mL-1±79.3 pg·mL-1)高于无淋巴结转移患者(399.7 pg·mL-1±84.8 pg·mL-1)(P<0.01);低分化患者血清sPD-L1水平(495.8 pg·mL-1±86.5 pg·mL-1)高于中高分化患者(382.4 pg·mL-1±82.6 pg·mL-1)(P<0.01)。血清sPD-L1含量与性别、年龄、肿瘤部位及大小无相关性(P>0.05)。
2.6 口腔鳞癌患者PD-1的阳性T细胞百分率与患者临床病理特征的关系
相关性分析表明,口腔鳞癌患者外周血CD4+、CD8+T淋巴细胞表面PD-1的表达水平均与肿瘤分化程度及淋巴结转移状态相关。低分化患者的外周血CD4+、CD8+T淋巴细胞表面PD-1的表达水平高于中高分化患者(P<0.05);有淋巴结转移患者外周血CD4+、CD8+T淋巴细胞表面PD-1的表达水平高于无淋巴结转移患者(P<0.05)。口腔鳞癌患者外周血CD4+、CD8+T淋巴细胞表面PD-1的表达水平与临床分期、性别、年龄、肿瘤大小、肿瘤部位无关(P>0.05)。
3 讨论
肿瘤免疫主要依靠细胞免疫,其中,T淋巴细胞处于核心地位,在免疫监视、杀伤靶细胞及免疫调节方面具有极重要的作用。由于T淋巴细胞各亚型在抗肿瘤免疫中所起作用不同,因此,检测外周血T淋巴细胞亚群是反映机体抗肿瘤状态的重要指标之一。本研究表明,口腔鳞癌患者外周血淋巴细胞免疫亚型比例与健康人相比存在异常,CD3+、CD4+及CD4+/CD8+百分率较对照组降低,CD8+较对照组升高,与李向春等[10]报道结果一致,说明口腔鳞癌患者体内存在细胞免疫功能失衡的微环境。
在T细胞的活化和增殖过程中,除了需要T细胞受体与表达在抗原递呈细胞表面的主要组织相容性复合体(major histocompatibility complex,MHC)-抗原肽复合物结合产生的第一信号外,还需要共刺激分子与受体结合产生的第二信号的参与[6]。PD-1及其配体PD-L1是新近发现的负性共刺激信号分子,PD-L1与PD-1结合后可有效抑制T淋巴细胞的增殖和活化,负向调控免疫应答,从而减弱机体抗肿瘤免疫反应,该信号途径在肿瘤免疫中的地位已经备受关注。刘书漫等[11]报道PD-L1和PD-1在胃癌组织中表达升高,且PD-L1表达与胃癌的浸润深度、周围淋巴结转移、远处转移及TNM分期有关。Hua等[12]研究发现,PD-L1在人结肠癌组织中高表达,主要表达于肿瘤细胞的胞质和胞浆中,结肠癌患者外周血调节性T细胞上PD-1表达升高,其推测阻断 PD-1/PD-L1途径可作为治疗结肠癌的一个新靶点。近年来,在口腔鳞癌免疫逃逸机制的诸多研究中,有研究结果表明口腔鳞癌的发生发展可能与PD-1/PD-L1信号途径有密切关系。Chen等[9]研究发现,γ-干扰素(interferon-γ,IFN-γ)可通过蛋白激酶D2(protein kinase D isoform 2,PKD2)信号途径对人舌鳞状细胞癌细胞Tca8113上PD-L1表达有明显促进作用。卢礼兵等[13]研究发现,肿瘤微环境中炎症细胞因子可以促进Tca8113表达PD-L1。为深入研究PD-1/PD-L1信号途径与口腔鳞癌的关系,本研究采用流式细胞术检测了82例口腔鳞癌患者外周血CD4+、CD8+T淋巴细胞表面PD-1及PD-L1的表达,结果显示,与对照组相比,口腔鳞癌患者CD4+、CD8+T淋巴细胞表面PD-1及PD-L1的表达均明显升高(P<0.05),与Malaspina等[14]的结果一致,说明PD-1/PD-L1信号途径与口腔鳞癌的发生及发展关系密切。此外,本研究还发现,口腔鳞癌患者CD4+/CD8+T淋巴细胞百分数比值与外周血CD4+T淋巴细胞表面PD-1的阳性表达有关(P<0.01)。进一步分析患者PD-1阳性T细胞百分率与性别、年龄、肿瘤部位、病理、大小、临床分期、分化程度及颈淋巴结是否转移的关系,结果显示,口腔鳞癌患者外周血CD4+、CD8+T淋巴细胞表面PD-1的表达水平与肿瘤细胞分化程度及淋巴结转移状态相关(P<0.05),与临床分期、性别、年龄、肿瘤大小、肿瘤部位无关(P>0.05)。
近年来研究发现,共刺激分子除了可以在细胞膜上表达(膜型)外,还可以呈可溶性形式存在于血清中,即可溶性共刺激分子。现已证明,这类可溶性的共刺激分子能够像细胞膜表面的分子一样以相同的方式与受体相互作用发挥一定的生物学功能。研究显示,可溶性的共刺激分子能够像细胞因子一样参与血液循环,不但可以影响邻近细胞,而且也能和远端细胞表面的受体相互结合从而发挥广泛的抑制效应,其发挥作用的广度和深度可能远远超过细胞膜表面的膜型共刺激分子,因此,可溶性共刺激分子在疾病发生和发展过程中的作用引起了研究者的高度关注[15-16]。临床研究显示,人血清中也同样存在sPD-1和sPD-L1分子,其中,sPD-L1是由金属蛋白酶剪切细胞表面膜型PD-L1而成,人外周血中存在的sPD-L1能促进PD-1/PD-L1负性信号,从而参与肿瘤细胞的免疫逃逸。邢玉斐等[17]研究发现,肺癌患者外周血清中sPD-L1的表达异常增高,且与肺癌的分期、转移和疗效有关,这有助于判断肺癌患者的预后。
迄今为止,尚未有关于口腔鳞癌可溶性共刺激分子表达情况的报道,为进一步深入研究sPD-1/sPDL1与口腔鳞癌发生发展的关系,本研究采用ELISA技术检测了口腔鳞癌患者和健康对照人群血清中sPD-1和sPD-L1的表达水平,结果显示,口腔鳞癌患者血清中sPD-L1异常增高。对口腔鳞癌患者CD4+/CD8+T百分数比值与患者血清sPD-L1水平的相关性进行分析,结果显示,口腔鳞癌患者CD4+/CD8+T百分数比值与患者血清sPD-L1水平有关(P<0.01)。在分析sPD-L1表达水平与口腔鳞癌多种临床病理特征的关系中可以发现,sPD-L1的表达与临床分期、肿瘤细胞分化程度及淋巴结转移状态相关。Ⅲ+Ⅳ期患者血清中的sPD-L1表达水平明显高于Ⅰ+Ⅱ期患者,低分化患者的sPD-L1表达水平高于中、高分化患者,有淋巴结转移患者的sPD-L1表达水平高于无淋巴结转移者。本研究中未发现sPD-L1表达与患者性别、年龄、肿瘤大小、肿瘤部位有关。
综上所述,口腔鳞癌患者体内T细胞免疫处于抑制状态,外周血CD4+、CD8+T淋巴细胞表面PD-1/PD-L1的表达上调,口腔鳞癌患者血清中sPD-L1异常升高,且与临床分期、肿瘤细胞分化程度及淋巴结转移状态有关。本研究表明,特异性阻断PD-1/PD-L1抑制途径有望成为肿瘤靶向治疗的策略之一。
[1]刘思玉, 李宏卫. 微RNA在口腔鳞状细胞癌中表达的研究进展[J]. 中华口腔医学杂志, 2013, 48(6):376-380.
[2]Dawson MA, Kouzarides T, Huntly BJ. Targeting epigenetic readers in cancer[J]. N Engl J Med, 2012, 367(7):647-657.[3]Callahan MK, Wolchok JD. At the bedside: CTLA-4- and PD-1-blocking antibodies in cancer immunotherapy[J]. J Leukoc Biol, 2013, 94(1):41-53.
[4]Hamid O, Carvajal RD. Anti-programmed death-1 and antiprogrammed death-ligand 1 antibodies in cancer therapy[J].Expert Opin Biol Ther, 2013, 13(6):847-861.
[5]Atanackovic D, Luetkens T, Kröger N. Coinhibitory molecule PD-1 as a potential target for the immunotherapy of multiple myeloma[J]. Leukemia, 2014, 28(5):993-1000.
[6]Pedoeem A, Azoulay-Alfaguter I, Strazza M, et al. Programmed death-1 pathway in cancer and autoimmunity[J].Clin Immunol, 2014, 153(1):145-152.
[7]Tsushima F, Tanaka K, Otsuki N, et al. Predominant expression of B7-H1 and its immunoregulatory roles in oral squamous cell carcinoma[J]. Oral Oncol, 2006, 42(3):268-274.
[8]Cho YA, Yoon HJ, Lee JI, et al. Relationship between the expressions of PD-L1 and tumor-infiltrating lymphocytes in oral squamous cell carcinoma[J]. Oral Oncol, 2011, 47(12):1148-1153.
[9]Chen J, Feng Y, Lu L, et al. Interferon-γ-induced PD-L1 surface expression on human oral squamous carcinoma via PKD2 signal pathway[J]. Immunobiology, 2012, 217(4):385-393.
[10]李向春, 张素欣, 程立军, 等. 口腔癌患者手术前后细胞免疫功能变化的检测及临床意义[J]. 河北医科大学学报,2010, 31(11):1329-1332.
[11]刘书漫, 孟青, 张钦宪, 等. B7-H1及其受体PD-1在胃癌组织中的表达与意义[J]. 中华肿瘤杂志, 2008, 30(3):192-195.
[12]Hua D, Sun J, Mao Y, et al. B7-H1 expression is associated with expansion of regulatory T cells in colorectal carcinoma[J]. World J Gastroenterol, 2012, 18(9):971-978.
[13]卢礼兵, 陈娇, 冯云, 等. 炎症细胞因子诱导Tca8113细胞表达PD-L1的作用研究[J]. 四川大学学报: 医学版, 2013,44(1):42-45.
[14]Malaspina TS, Gasparoto TH, Costa MR, et al. Enhanced programmed death 1 (PD-1) and PD-1 ligand (PD-L1) expression in patients with actinic cheilitis and oral squamous cell carcinoma[J]. Cancer Immunol Immunother, 2011, 60(7):965-974.
[15]Pan XC, Li L, Mao JJ, et al. Synergistic effects of soluble PD-1 and IL-21 on antitumor immunity against H22 murine hepatocellular carcinoma[J]. Oncol Lett, 2013, 5(1):90-96.
[16]Song MY, Park SH, Nam HJ, et al. Enhancement of vaccineinduced primary and memory CD8+T-cell responses by soluble PD-1[J]. J Immunother, 2011, 34(3):297-306.
[17]邢玉斐, 张增利, 施敏骅, 等. 肺癌患者外周血中可溶性程序性死亡配体-1的表达及其临床意义[J]. 中华结核和呼吸杂志, 2012, 35(2):102-106.

