日粮高碘对獭兔生长轴相关激素基因mRNA表达的影响
秦 枫, 潘孝青, 邵 乐, 李 晟, 李 健, 杨 杰
(江苏农业科学院畜牧研究所,江苏南京210014)
碘是动物体内不可缺少的微量元素,调节甲状腺激素的合成与代谢。甲状腺激素可以通过参与机体营养物质的代谢,影响动物的生长发育、繁殖以及机体健康等。甲状腺激素是内分泌轴的重要激素,对下丘脑-垂体-生长激素轴有重要的影响。据报道,甲状腺激素在垂体GH合成与分泌中起着关键的作用(Valcavi等,1992)。然而碘摄取过量将导致甲状腺炎、甲状腺肿大、甲减/甲亢等疾病的发生,此外还影响脑发育(Guo等,2006;Yang等,2006)。本试验拟以獭兔为试验动物,探讨日粮中不同水平的碘对獭兔内分泌生长轴基因mRNA的影响,为獭兔碘的安全补饲提供科学参考。
1 材料与方法
1.1 试验动物和饲养管理 选择120只体况良好、体重为(2235.4±13.04)g、4 月龄獭兔作为试验动物,试验前统一驱虫。试验在江苏省农业科学院六合试验兔场进行。试验前对兔舍兔笼进行彻底清扫、消毒。试验獭兔2只为一笼,分别在早上08∶30和下午15∶30饲喂两次,试验獭兔饲喂基础料,饲料为2~3 cm颗粒料,自由饮水,每天清扫卫生,并做好各种记录。预试期内进行分组。
1.2 试验设计 采用单因素完全随机试验设计,将120只獭兔随机分为4组,碘添加水平分别为0、0.2、2、4 mg/kg 干物质(对照组、低水平组、中水平组、高水平组)。试验时间为2012年10—12月,预试期7 d,正式期28 d。
1.3 试验日粮 试验日粮配制参照NRC(1977)兔饲养标准(NRC,1977),代谢能供给量为1.2倍的维持需要。碘以碘酸钾的形式在日粮中添加。基础日粮组成及营养水平见表1。
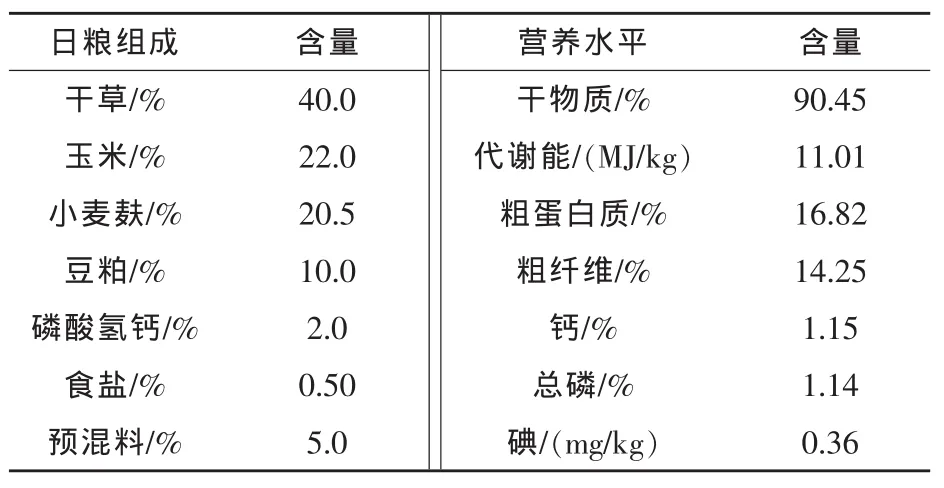
表1 日粮组成和营养水平(干物质基础)
1.4 样品采集 在试验结束时,每组各随机抽取体重相近獭兔5只,空腹24 h后进行屠宰,采集垂体、肝脏组织,液氮保存。
1.5 实时荧光定量PCR测定垂体GH、肝脏IGF-1和IGFBP1 mRNA
1.5.1 总RNA提取 用Trizol法抽提垂体、肝脏样品中的总RNA,样品中RNA浓度用紫外分光光度计(260 nm)测定。RNA样品经2.0%变性琼脂糖凝胶电泳,EB染色后观察分析,无拖尾现象和其他杂带,则认为RNA样品质量可靠。
1.5.2 RT反应 采用10 μL反应体系,在0.2 mL Eppendorf管中依次加入模板RNA1.0μL,50μmol/L Oligo dT 0.5 μL,100 μmol/L 随机引物 0.5 μl,5×PrimerScript Buffer 2 μL,PrimerScript RT Enzyme Mix I 0.5 μL,RNase free H2O 5.5 μL。 在ABI 9700型PCR仪上37℃保温15 min使逆转录反应完全后,85℃、5 s终止反应。 产物加入 90 μL RNase free H2O稀释至 100 μL,储存在-20℃冰箱,用于后续试验。
1.5.3 荧光定量PCR分析 引物序列及扩增条件见表 2。 20 μL PCR 反应体系:10 μmol/L Forward primer 0.4 μL,10 μmd/L Forward primer 0.4 μL,2×SuperRealPreMix(SYBR Green)10 μL,RNase free H2O 8.2 μL,RT 产物 1 μL。

表2 基因引物序列及扩增片段
1.5.4 基因相对表达量计算方法 以看家基因(GAPDH)作为内参基因,以垂体、肝脏组织cDNA作为模板, 进行 GAPDH、GH、IGF-1、IGFBP1 基因实时荧光定量PCR检测,用得出的CT值制作扩增效率曲线。 试验采用比较 Ct法(2-△△Ct)进行GH、IGF-1、IGFBP1基因mRNA相对表达量的统计分析。试验以GAPDH作为持家基因,从而校正不同样品初始模板量的差异,每个样品重复三次,从而获得平均 Ct值,采用 2-△△Ct法计算样品间 GH、IGF-1、IGFBP1基因mRNA的相对表达量。 2-△△Ct法采用的公式如下:
△△Ct=[Ct(目的基因,试验样品)-Ct(GAPDH,试验样品)]-[Ct(目的基因,参照样品)-Ct(GAPDH,参照样品)]。
每个样品的 2-△△Ct值即是该样品 GH、IGF-1、IGFBP1基因mRNA的相对表达量。
1.6 数据分析 运用Excel整理数据,采用SPSS 17.0中单因素ANVOA统计分析,Duncan’s法进行多重比较,P<0.05为显著差异。
2 结果与讨论
试验结果见图1、2、3。结果显示,与对照组相比,中水平组、高水平组垂体 GH、肝脏IGF-1基因mRNA表达略有下降,GH表达分别下降3.8%、8.6%,IGF-1表达分别下降 25.8%、19.6%,但均无统计学差异(P>0.05)。此外,肝脏IGFBP1基因mRNA表达高水平组比对照组高14.2%,但也无显著影响(P>0.05)。
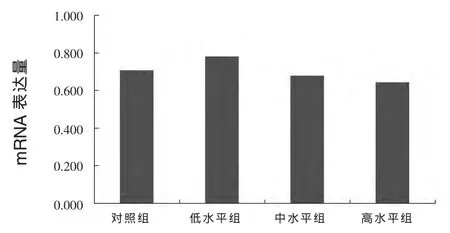
图1 日粮碘对獭兔垂体GH基因mRNA表达的影响
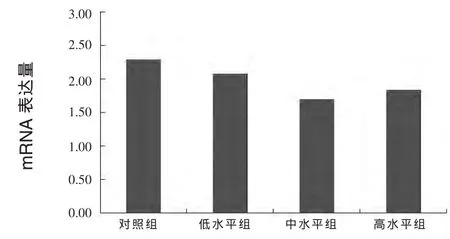
图2 日粮碘对獭兔肝脏IGF-1基因mRNA表达的影响
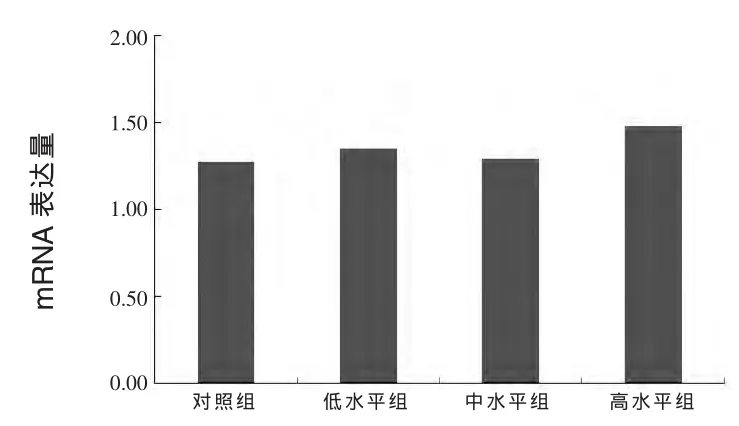
图3 日粮碘对獭兔肝脏IGFBP1基因mRNA表达的影响
碘是甲状腺激素的重要组成成分,其作用主要通过甲状腺激素体现的。相关研究报道,碘缺乏和碘过量会影响动物体内与甲状腺激素相关基因的表达(张瑞等,2009;王琨等,2008)。本试验主要研究了过量碘对獭兔生长轴相关激素基因表达的影响。甲状腺激素、生长激素和IGF-1是调节动物生长和发育的重要内分泌激素。GH通过IGF-1的介导而起生长调节作用。肝脏是产生IGF-1的最主要器官。IGF-1的作用主要通过受体IGF-1R介导,它具有酪氨酸激酶活性,并通过PI3K/AKP信号通路传递作用。甲状腺激素影响生长是通过改变GH的分泌及影响,作用强弱是通过GH调控IGF-1的合成与分泌实现的 (Wolf等,1989)。GH/IGF-1轴不仅影响动物的生长和其甲状腺功能,而且还影响甲状腺激素的代谢 (Torre等,2000;Jørgensen 等,1999)。
本试验中,发现短期内日粮添加高碘对GH/IGF-1生长轴激素基因mRNA表达没有显著影响。分析原因为:一方面是试验獭兔为青年兔,高碘的添加量可能还不到獭兔最大耐受量;另一方面是短期内碘的作用还可能受到Wolff-Chaikoff法则的影响。但也有研究报道,甲状腺激素可以上调大鼠海马组织中GH及其受体的表达,并促进GH信号转导、促进NSCs和前体细胞向神经元分化,在脑的发育期,这种上调作用呈现在转录和翻译两个水平,进入幼年期之后这种促进作用仅仅表现在翻译水平上,提示甲状腺激素促进脑的生长发育功能可能是通过GH介导而实现的 (汤慧芹,2010)。在外周甲状腺激素对维持血清GH的浓度起着重要的调节作用 (Davis和Tremont,2007;Silva等,2006)。正常血浓度的甲状腺激素能增加垂体细胞GH基础分泌、甲状腺激素缺乏可导致垂体GH储备降低,其机制可能是甲状腺激素与垂体细胞核内的甲状腺激素受体结合后,作用于GH基因启动子5'上游区域的正性甲状腺激素应答元件,从转录水平调控GH基因的表达(Sugawara等,1994)。新近的研究还显示,甲状腺激素可以诱导多聚腺苷酸(polyA)的合成来保护GHmRNA免受核糖核酸酶的降解,从而提高GHmRNA的稳定性(Silva等,2006)。除调控GH基因表达外,甲状腺激素还可促进垂体细胞对促生长激素释放激素的反应,进而促进GH的合成与分泌 (Jones等,1990)。这些现象提示,GH功能的正常发挥,在很大程度上依赖于甲状腺激素。GH也可直接或间接调节外围T4的代谢,通过GH诱导外围T4脱碘转变成 T3(Jorgensen 等,1989)。
3 结论
综上所述,试验期内,高碘日粮对獭兔内分泌生长轴相关激素及蛋白表达无显著影响,由此可见,短期内饲喂高碘日粮不会引起獭兔内分泌轴变化,不会影响其健康与生长,但相关研究还需要进一步深入,以确定獭兔碘供给安全上限。
[1]汤慧芹.甲状腺激素对海马内源性生长激素及其受体的调节:[博士学位论文][D].武汉:武汉大学.2010.
[2]王琨,孙毅娜,刘嘉玉,等.不同碘摄入水平对小鼠甲状腺组织Ⅰ型脱碘酶基因表达及酶活性的影响[J].生物化学与生物物理进展,2008,35(3):320~326.
[3]张瑞,戈海泽,赵秀娟,等.低碘膳食对大鼠脑组织中同源盒基因NKX- 22 表达的影响[J].中国生物工程杂志,2009,29(1):92~96.
[4]Davis J D,Tremont G,Neuropsychiatric aspects of hypothyroidism and treatment reversibility[J].Minerva Endocrinology,2007,32:49~65.
[5]Guo H,Yang X,Xu j,et al.Effect of selenium on thyroid hormone metabolism in filial cerebrum of mice with excessive iodine exposure[J].Biological Trace Element Research,2006,113:281~295.
[6] Jones P M,Burrin J M,Ghatei M A,et al.The influenceof thyroidhormonestatusonthehypothalamo -hypohysealgrowthhormoneaxis[J].Endocrinology,1990,126:1374~1379.
[7]Jørgensen J O,Ovesen P,Juul A,et al.Impact of growth hormone administration on other hormones[J].Hormone Research,1999,51:121~126.
[8]Jorgensen J O,Pedersen S A,Laurberg P,et al.Effects of growth hormone therapy on thyroid function of growthhormone-deficient adults with and without concomitant thyroxinesubstitutedcentral hypothyroidism[J].Journal of Clinical Endocrinology&Metabolism,1989,69:1127~1132.
[9]NRC.Nutrition Requirements of rabbits[M].Report of the Committee on Animal nutrition.National Academy Press Washington,DC,1977.
[10]Silva F G,Giannocco G,Santos M E,et al.Thyroidhormoneinductionofactin polymerizationinsomatotrophsofhypothyroidrats:Potentialrepercussionsingrowth hormone synthesisand secretion[J].Endocrinology,2006,147:5777~5785.
[11]Sugawara A,Yen P M,Chin W W.9-cis retinoic acidregulationofratgrowthhormonegeneexpression:Potentialrolesofmultiplenuclearhormonereceptors[J].Endocrinology,1994,135:1956~1962.
[12]Torre G,Barreca A,Borgonovo G,et al.Goiter recurrence in patients submitted to thyroid-stimulatinghormone suppression:possible role of insulinlike growth factors andinsulin-like growth factor-binding proteins[J].Surgery,2000,127:99~103.
[13]Valcavi R,ZiniM,Portioli I.Thyroid hormones and growth hormone secretion[J].Journal of EndocrinologicalInvestigation,1992,15(4):313~330.
[14]Wolf M,Ingbar SH,MosesA C.Thyroidhormoneandgrowth hormoneinteractto regulate insulin-like growth factor-Imessenger ribonucleic acid andcirculating levels in the rat[J].Endocrinology,1989,125:2905~2914.
[15]Yang X F,Xu J,Hou X H,et al.Developmental toxic effects of chronic exposure to high doses of iodine in the mouse[J].Reproductive Toxicology,2006,22:725~730.

