固态发酵制备花生多肽的菌种筛选研究
杨新建 , 段素云 , 肖海峻 , 田 璐, 王伟青 , 罗红霞 *
(1.北京农业职业学院,北京房山 102442;2.农业部饲料生物技术重点实验室,北京海淀 100081;3.中国农业科学院饲料研究所基因工程研究室,北京海淀 100081)
花生饼(粕)是脱壳花生经压榨或浸提取油后的副产物,其营养丰富,粗蛋白质含量比豆粕大约高出3%(Hwang等,2010);多糖含量高达32.5%;代谢能水平在所有饼粕类饲料中最高;并含有Mg、K、Ca、Fe、Na、Zn、P、Cu、Mn 等多种矿物质元素。目前,用动植物蛋白制备多肽已成为了研究热点,这种多肽被认为具有良好的理化性质和水合性质,其溶解度增加,黏度降低,凝胶性降低,发泡性降低,无过敏反应,消化吸收性好(刘大川和周俊梅,2008;Byun,2001;Wahb,1998),并且具有抗氧化特性,能够清除体内自由基,达到延长细胞寿命的作用(刘大川,2013;Sarmadi和 Ismail,2010)。本研究以花生饼(粕)作为基质,采用固态发酵技术,以枯草芽孢杆菌、地衣芽孢杆菌、黑曲霉、米曲霉、产朊假丝酵母、酿酒酵母、植物乳酸杆菌为备选菌株,花生多肽产量为考察指标,筛选获得多肽产量高、稳定的发酵菌株。旨在为今后优化发酵工艺,提高多肽产量、品质及活性研究提供基础。
1 材料与方法
1.1 试验材料
1.1.1 候选菌种 芽孢杆菌:枯草芽孢杆菌、地衣芽孢杆菌;霉菌:黑曲霉、米曲霉;酵母:产朊假丝酵母、酿酒酵母;乳酸菌:植物乳酸杆菌。上述菌种均由中国农业科学院饲料研究所基因工程研究室保存。
1.1.2 花生粕(饼) 试验用花生粕(饼)分别购自山东鲁花集团有限公司、天津宇顺国际贸易有限公司、北京鹤来科技有限公司、莱州市三元花生油加工厂,粉碎过40目筛备用。
1.1.3 培养基
1.1.3.1 活化培养基 霉菌、酵母培养基:马铃薯培养基(PDA)。芽孢杆菌培养基:LB固体培养基。乳酸菌培养基:MRS固体培养基。
1.1.3.2 扩大培养基 活化培养基(液体)。
1.1.3.3 固体发酵培养基 灭菌后的基质(90%花生粕和 10%麸皮)和水按 1∶1(w/w)的比例混合,自然pH。
1.1.4 试剂 牛血清白蛋白、葡萄糖、硫酸铜(CuSO4·5H2O)、酒石酸钾钠(NaKC4H4O6·4H2O)、氢氧化钠、碘化钾、三氯乙酸(TCA)、石油醚(沸程60~90℃)、3,5-二硝基水杨酸、重蒸酚 (结晶酚)、亚硫酸钠等均为分析纯。
1.1.5 设备 全自动凯氏定氮仪 (型号:KDY-9830,品牌:KETUO)、紫外可见分光光度计(T6,北京普析通用仪器有限责任公司)、索氏提取器(SXT-06、上海洪纪仪器设备有限公司)、电热恒温水浴锅等。
1.2 试验方法
1.2.1 花生粕基本成分测定 粗蛋白质测定采用凯氏定氮法(GB/T 5009·5-2010);粗脂肪测定按GB/T 5009·6-2003 进行;水分测定按 GB/T5009·3-2010进行;总糖测定采用DNS法。
1.2.2 菌种活化与扩培 芽孢杆菌、酵母菌、乳酸菌活化与扩培方法:保藏菌种划线(或涂布)相应固体平板,在适宜条件下培养一定时间后,挑取单菌落于相应液体培养基中,根据其生长曲线,适宜条件下培养至对数生长期末,备用。
霉菌活化与扩培方法:保藏的斜面菌种转接于PDA斜面培养基上,30℃恒温箱中培养3 d,长满大量黑色(黑曲霉)或黄绿色(米曲霉)孢子,即为活化的斜面种子。 用无菌移液管吸取5 mL无菌水加至斜面上,用接种环轻轻刮下孢子,装入含有玻璃珠的三角瓶中,盖好塞子振荡数分钟,用血球计数板测定孢子悬液的浓度,并进行适当稀释后备用。
1.2.3 各菌种固态发酵花生粕试验 (1)13.5 g花生粕+1.5 g麸皮放入250 mL三角瓶中,121℃、20 min,自然冷却并打散;(2)量取 11.2 mL 无菌水(考虑花生粕本身含水量)放入50 mL三角瓶中;并按照10%接种量(3 mL,霉菌为107个/mL的孢子悬液),接种各培养至对数生长期末的菌液,充分混匀;(3)将(2)中混匀好的溶液,均匀的接种到(1)中(多点接种),并用灭菌的玻棒打散成团花生粕。每组三个重复,根据各菌种生长温度培养48 h,每12 h翻料一次。对照:在不接种菌种的情况下,所有过程同样品处理。
1.2.4 多肽含量测定 多肽测定参照史军(2007)的方法进行。
1.2.4.1 标准曲线绘制 标准蛋白质溶液:准确称取经真空干燥的标准蛋白质——牛血清白蛋白,用双蒸水配制成10 mg/mL的溶液(可用1 mg牛血清白蛋白/mL在280 nm处的吸光度为0.66来校正)。放置过夜以助溶。
双缩脲试剂:称取0.75 g硫酸铜、3 g酒石酸钾钠、0.5 g碘化钾,依次溶解于250 mL水中,搅拌下加入150 mL 10%氢氧化钠溶液,用冷却的通过煮沸逐出所溶解二氧化碳的蒸馏水稀释定容至500 mL。
标准曲线制作:取小试管22支,分为两组,分别编号0~10,按表1所示顺序加入各试剂,在漩涡器上轻轻振动混匀,于37℃水浴下反应30 min后,用未加蛋白质溶液的第一支试管作为空白对照液,540 nm处测定吸光度(A)值。并取两组测定的平均值。以溶液中蛋白质浓度为横坐标,A540为纵坐标作标准曲线(R2≥0.9990才可用)。
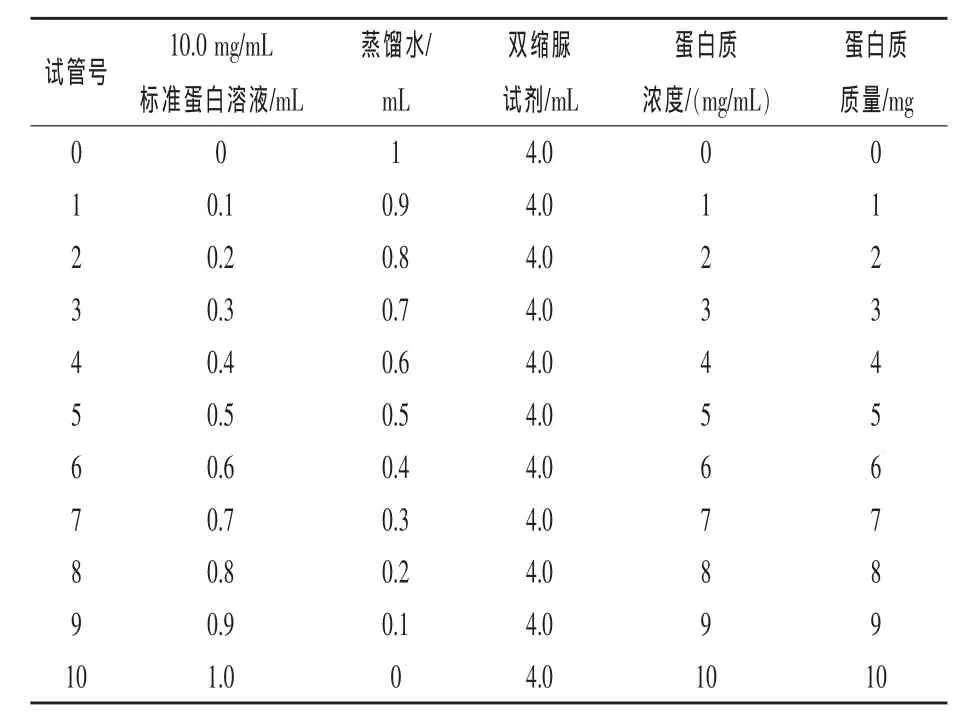
表1 制作标准曲线具体参数
1.2.4.2 发酵样品处理及多肽含量测定 发酵结束后,将发酵物50℃烘干,粉碎,过40目筛,取0.25 g(每个发酵样品取2个平行),置于10 mL洁净离心管中,加入8 mL 10%的三氯乙酸,混匀并室温振荡 30 min(200 r/min),然后 5000 r/min离心20 min,取上清液1 mL(记录上清液总体积,每个样品做2个平行),加双缩脲试剂4 mL,于37℃水浴下反应30 min,在540 nm处测定吸光值,根据标准曲线回归方程计算上清液中多肽含量(mg/mL)。然后再根据上清液总体积以及取样品量计算出发酵产物中多肽含量/(mg/g)。
未发酵样品:90%花生粕+10%麸皮与水按照质量比1∶1混合后,处理同上。
1.2.5 SDS-PAGE检测花生粕发酵前后蛋白质分子量分布情况 分别取发酵前与发酵后的粉碎花生粕 (40目)各1.0 g,用8 mL 0.03 mol/L Tris-HCL缓冲液(pH 8.0)浸提1 h以上,然后于4℃、3000 r/min离心5 min,取上清液,再于4℃、10000 r/min离心5 min。SDS-PAGE电泳的分离胶浓度为12%,浓缩胶浓度为5%,以溴酚蓝作为前沿指示剂。电泳时,取样品0.5 mL,加入0.5 mL的上样缓冲液,混匀后在100℃沸水浴3~5 min,再于10000 r/min离心30 s。上样量为7 μL,样品在浓缩胶时电压为40 V,待溴酚蓝前沿进入分离胶后增至80 V继续电泳,待溴酚蓝距离下缘仅有0.5~1.0 cm时结束电泳。胶片经染色和脱色后,进行拍照。
1.2.6 备选菌株产多肽稳定性试验 对发酵产多肽较多的米曲霉、地衣芽孢杆菌、产朊假丝酵母进行3个批次的发酵试验(每个批次2个重复),并测定其多肽含量,验证各备选菌种产多肽的稳定性。
1.3 数据统计与分析 采用SPSS 19.0统计软件对数据进行t检验,试验数据以“平均值±标准差”表示。P>0.05为统计学差异不显著,P<0.05为统计学差异显著,P<0.01为统计学差异极显著。
2 结果与分析
2.1 不同来源花生粕(饼)基本成分测定及样品选择 根据试验需求,分别收集了4个不同厂家的花生粕(饼),并对其营养成分的含量进行了测定。测定结果见表2。
根据表2结果可知,不同来源的花生粕(饼)均含有较高含量的蛋白质及总糖,但以来至山东鲁花的样品含量较高;而四个样品的粗脂肪以及水分含量均较低。并且在粗脂肪含量方面,花生粕显著低于花生饼(P=0.000<0.01)。
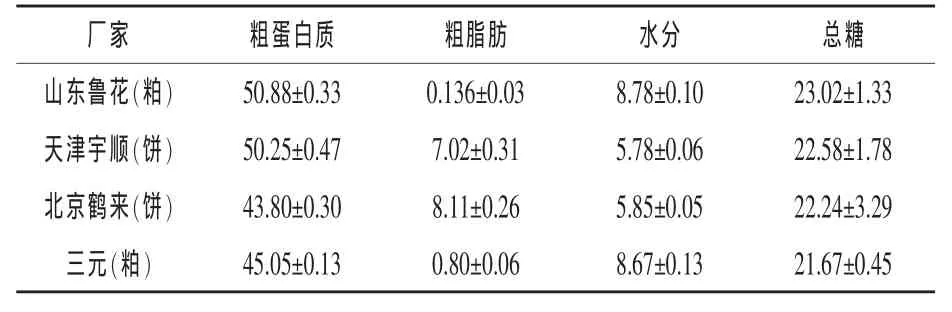
表2 不同厂家花生粕(饼)营养成分含量%
2.2 多肽含量测定标准曲线 根据1.2.4所述方法,测定标准蛋白质在540 nm处吸光度 ,结果见表3。
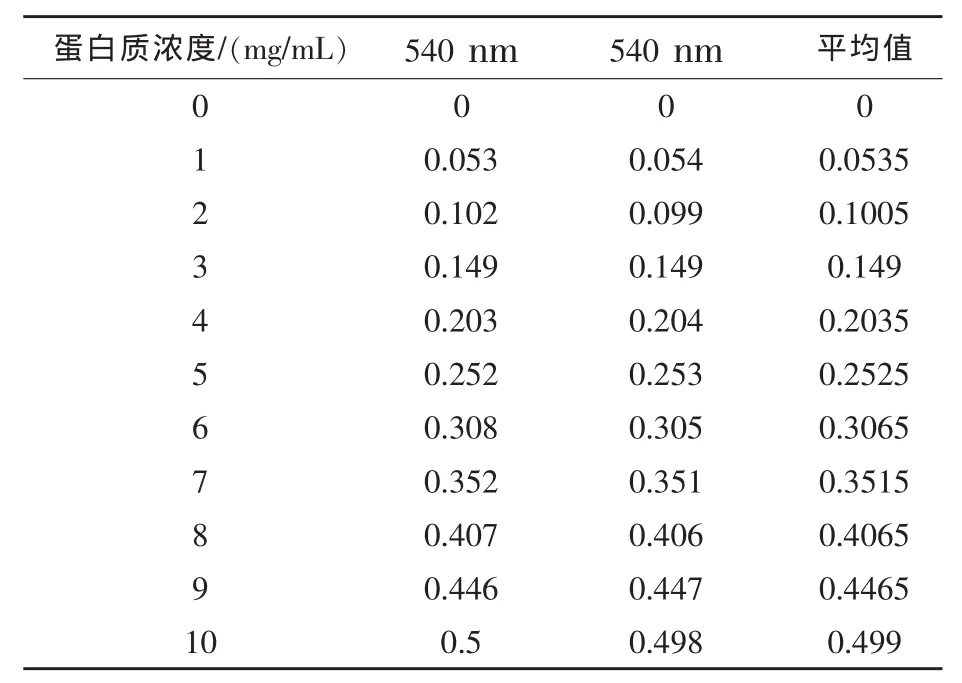
表3 各浓度标准蛋白质在540 nm处吸收值
根据表3数据(平均值)利用Excel制作散点图,计算出斜率、截距并获得其公式,以供后面计算所用(图 1)。
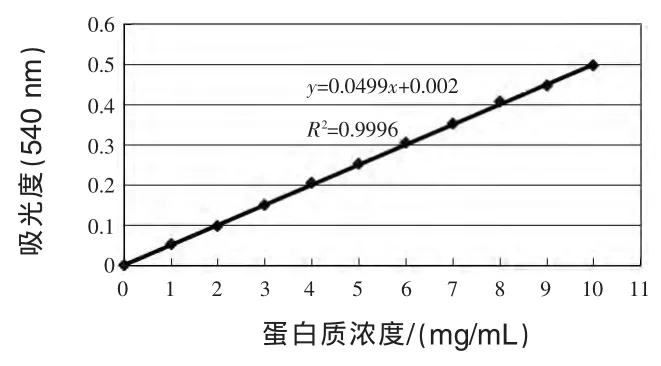
图1 牛血清白蛋白标准曲线
2.3 各菌种固态发酵结果 根据1.2.3及1.2.4中方法,测得7株供试菌发酵花生粕产多肽结果如图2所示。
根据上述结果,米曲霉产多肽量最高,为(149.20±14.69)mg/g,产朊假丝酵母、地衣芽孢杆菌次之。同时,为了进一步验证上述结果,对各菌种发酵产物进行多肽提取,进行SDS-PAGE分析,结果见图3。
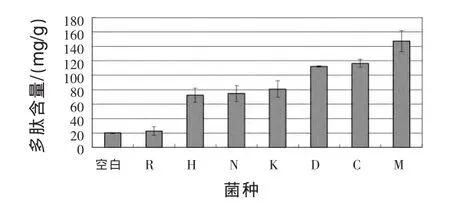
图2 不同菌种作用花生粕产多肽情况
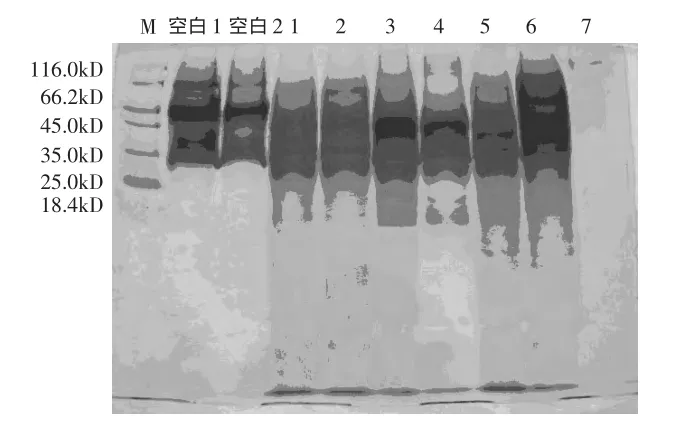
图3 不同菌种发酵样品电泳图
图3结果显示,产朊假丝酵母、地衣芽孢杆菌、枯草芽孢杆菌、米曲霉、酿酒酵母对花生蛋白粕均有一定的降解作用(与对照相比,大分子蛋白被不同程度降解),但以米曲霉为最好,产朊假丝酵母、地衣芽孢杆菌次之,与含量测定结果吻合。
2.4 备选菌种发酵制备多肽稳定性试验 采用1.2.4中方法,对备选的米曲霉、产朊假丝酵母和地衣芽孢杆菌产多肽稳定性进行试验,结果如图4、图5所示。
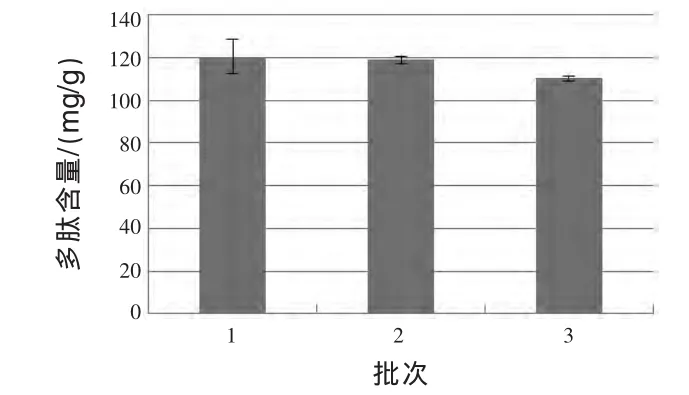
图4 产朊假丝酵母发酵花生粕制备花生多肽稳定性试验
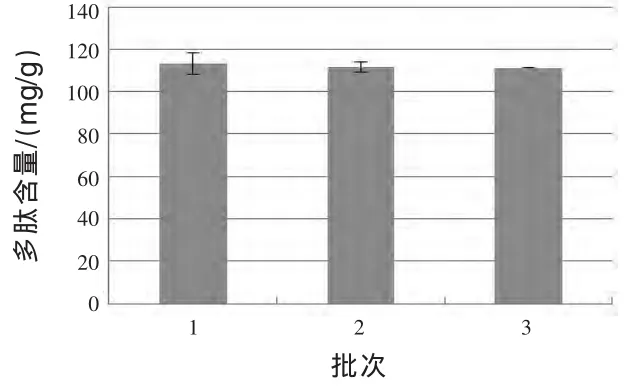
图5 地衣芽孢杆菌发酵花生粕制备花生多肽稳定性试验
根据图4和图5的结果可知,首先,产朊假丝酵母三个批次发酵产物中多肽含量分别为(120.43±7.89)mg/g、(118.95±1.66)mg/g 和(110.39±1.17)mg/g(P > 0.05),地衣芽孢杆菌三个批次发酵产 物 中 多 肽 含 量 分 别 为 (113.39±5.21)mg/g、(111.69±2.49)mg/g 和 (111.35±0.22)mg/g (P >0.05),产朊假丝酵母及地衣芽孢杆菌作用花生粕3个批次所产花生多肽平均值分别为 (116.59±5.42)mg/g、(112.14±1.09)mg/g, 结果差异不显著(P>0.05);其次,借助 SPSS 19.0分别分析了产朊假丝酵母及地衣芽孢杆菌三个批次发酵结果的差异显著性,结果发现,产朊假丝酵母及地衣芽孢杆菌三个批次发酵结果均差异不显著(P>0.05),这说明就多肽的产量方面,产朊假丝酵母及地衣芽孢杆菌均可作为发酵菌种。但是,通过分析具体数据发现,产朊假丝酵母和地衣芽孢杆菌三个批次发酵产物中多肽含量从均匀性上看,地衣芽孢杆菌更佳;同时,产朊假丝酵母发酵产物气味较地衣芽孢杆菌重(发酵味道更浓,中间夹杂一定的臭味),会影响发酵后花生粕作为饲料原料的适口性。而对于米曲霉,在试验过程中出现生长不佳甚至不生长的情况,与初筛结果有较大差异。
综上,选择地衣芽孢杆菌作为发酵菌种。
3 讨论
3.1 基质的选择 本试验所用4个不同来源样品粗蛋白质含量均在43%以上,主要原因是花生粕是花生榨油后的副产物,大部分油脂被脱去,脂肪含量明显减少,蛋白质得到浓缩,因此花生粕(饼)作为一种高蛋白质原料生产多肽有较好的优势。
在粗脂肪含量方面,花生饼显著高于花生粕,这主要与花生饼/花生粕的生产工艺有关。脂肪作为一种营养物质,可作为碳源和能源被很多微生物所利用,并可提供一定的生长因子,但是脂肪的降解不但需要有脂肪酶的存在,更需要比糖代谢更多的O2才能完全降解,不然大量的脂肪酸以及代谢中的有机酸的积累,会引起pH的显著下降,导致微生物酶系统的作用以及微生物的正常生长代谢受到严重影响。因此当花生粕(饼)作为微生物的作用基质(培养基)时,尤其是在采用固态发酵形式的情况下,其粗脂肪含量不宜过高(王镜岩等,2002)。
糖类是发酵培养基中应用最为广泛的一种碳源,是促进微生物生长的一种速效碳源,因此花生粕(饼)中含有较高的总糖,有利于目标微生物的生长繁殖及代谢产物(酶)的产生,进而作用于基质中的蛋白质生成目标产物(多肽)。
综合所述,来自于山东鲁花的样品由于具有较高的蛋白质和总糖含量,较低的脂肪含量,被选作为后续试验的样品。
3.2 各菌种对花生粕基质的作用效果 就粕类的发酵生产而言,菌种多采用以产蛋白酶、纤维素酶及糖化酶丰富的芽孢杆菌、霉菌等,并取得了较好的作用效果(明强强等,2014a;张友维,2012)。在本研究中,枯草芽孢杆菌并没有表现出较佳的作用效果,究其原因可能是作为基质的花生粕的碳氮比为7.5∶1,而适合枯草芽孢杆菌生长的碳氮比在 2∶1左右(叶云峰等,2011),同时采用的固态发酵方式而导致的通气不畅,使其生长较差,其丰富的酶系未大量分泌,只是将大分子的花生蛋白进行了初步降解,而降解成小肽(14 kD以下)的能力不足。
黑曲霉的作用效果与枯草芽孢杆菌类似,但比枯草芽孢杆菌更弱,尤其是产生小肽能力方面[(72.38±9.89)mg/g],电泳图谱颜色显示更浅,并且其生长过程中产生大量黑色孢子,使发酵后花生粕颜色明显变暗,严重影响产品外观。
对于酿酒酵母,虽然含量测定 [(74.82±10.77)mg/g]及电泳图谱均显示其有大量的小肽产生,但是电泳图谱同时显示,花生粕大分子蛋白并未被大量降解,因此图谱上显示的小肽可能更多的是来至菌体产生的蛋白而不是降解所得。
植物乳酸杆菌由于需要厌氧的生长条件,在花生粕基质中几乎无生长,多肽产量也与对照相近 [(22.81±5.84)mg/g]。 而对于米曲霉 (邓静等,2008;孙春华等,2007)、产朊假丝酵母(何东东,2010)和地衣芽孢杆菌(胡尚勤和刘天贵,2000),由于其最适生长基质C/N与花生粕较为相近,生长情况良好,并产生大量的蛋白酶、淀粉酶及纤维素酶等酶类,降解花生粕并产生大量多肽。
4 结论
本试验通过测定不同来源的花生粕(饼)的基本成分,确定了具有较高的粗蛋白质、总糖含量,较低的脂肪含量的样品作为后续试验的样品。然后采用固态发酵技术,以花生多肽产量为考察指标,并通过SDS-PAGE试验及产多肽稳定性试验,从枯草芽孢杆菌、地衣芽孢杆菌、黑曲霉、米曲霉、产朊假丝酵母、酿酒酵母、植物乳酸杆菌等7株菌株中筛选出多肽产量高、稳定的地衣芽孢杆菌为目标发酵菌株。为后续优化发酵工艺,提高多肽产量、品质及活性打下了良好基础。
[1]邓静,吴华昌,吴明霞,等.米曲霉产蛋白酶条件的优化[J].中国酿造,2008,12:51~53.
[2]何东东.产朊假丝酵母的发酵及功能性质研究:[硕士学位论文][D].天津:天津商业大学,2010.
[3]胡尚勤,刘天贵.地衣芽孢杆菌营养要求的研究[J].河北省科学院学报,2000,17(4):224~227.
[4]刘大川,周俊梅.富硒蛋白肽的物性研究[J].食品科学,2008,29(3):84~86.
[5]刘大川.多肽的功能特性及其制备[J].粮食科技与经济,2013,38(3):45~ 48.
[6]明强强,于丽娜,杨庆利,等.黑曲霉固态发酵制备花生蛋白肽及抗氧化活性研究[J].2014a,39(2):17~22.
[7]史军.花生蛋白酶解及活性肽抗氧化活性研究:[硕士学位论文][D].郑州:河南工业大学,2007.
[8]孙春华,燕磊,常维山.不同碳源和氮源对米曲霉产酶影响的研究[J].西南农业学报,2007,20(5):986~990.
[9]王镜岩,朱圣庚,徐长法.生物化学[M].高等教育出版社,2002.
[10]叶云峰,黎起秦,袁高庆,等.枯草芽孢杆菌B47菌株高产抗菌物质的培养基及发酵条件优化[J].微生物学通报,2011,38(9):1339~1346.
[11]张友维.枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究:[博士学位论文][D].无锡:江南大学,2012.
[12]Byun H G.Purication and characterization of angiotensin converting process[J].Biochemistry 2001,36(6):1155~1162.
[13]Hwang J Y,Shyu Y S,Wang Y T,et al.Antioxidative properties of protein hydrolysate from defatted peanut kernels treated with esperase[J].LWTFood Science and Technology,2010,43(2)285~290.
[14]Sarmadi B H,Ismail A.Antioxidative peptides from food proteins:A review[J].Peptides,2010,31(10):1949~1956.
[15]Wahb K E.Glycyl-L-Sarcosine absorption across ovine omasal epithelium during coincubpafion with other pepfide substrated and violatil fatty acida[J].Journal of Animal Seience,1998(17):2706~2771.

