基于四核金属单元的锌/镉配合物的合成、晶体结构及荧光性质
张潇戈 高楼军 陈小莉 崔华莉 马红燕
(延安大学化学与化工学院,陕西省化学反应工程重点实验室,延安716000)
基于四核金属单元的锌/镉配合物的合成、晶体结构及荧光性质
张潇戈 高楼军*陈小莉*崔华莉 马红燕
(延安大学化学与化工学院,陕西省化学反应工程重点实验室,延安716000)
在水热条件下合成了2个金属配合物Zn4(Hhpa)4(phen)4(1)和{[Cd8(cnam)2(bpy)4(C2O4)6(H2O)8]·2H2O}n(2)(H2hpa=2-羟基间苯二甲酸,phen=菲咯啉,H2cnam=4-氧代-4H-吡喃-2,6-二甲酸,bpy=2,2′-联吡啶),通过元素分析、红外光谱、X-射线单晶衍射、荧光、热重分析和X-射线粉末衍射对其进行表征。配合物1为环状四核锌结构,相邻的四核锌单元通过π…π堆积作用扩展为三维超分子结构;配合物2是基于四核镉单元通过C2O42-离子和cnam2-配体连接而成的三维网状结构。在配合物1和2中Hhpa2-,cnam2-和C2O42-离子表现了丰富的配位模式。此外还研究了配合物1和2的荧光性质和热稳定性。
锌/镉配合物;晶体结构;水热合成;光谱性能
0 引言
近年来,金属有机骨架材料由于在分子与离子交换、吸附与选择性催化、光电子与磁性材料等多方面的潜在应用而成为配位化学、超分子化学以及晶体工程研究的热点[1-4]。但由于金属有机配合物的自组装过程受许多因素影响,如金属离子、配体、溶剂、抗衡离子、模板剂和合成方法,目标分子的完全可预测到目前为止仍旧是一个比较棘手的难题。大量文献显示金属离子不同的配位性以及有机配体中参与配位的配位原子的类型、数目及空间位置对形成的配合物的结构有着巨大的影响[5-8]。因而在设计和构筑目标配合物的过程中,有机配体和金属离子的选择非常重要。ZnⅡ和CdⅡ等d10金属配合物不仅具有稳定的电子构型,而且当金属与共轭度大的有机配体形成配合物后,会引发金属到配体或者配体到金属的电荷跃迁,从而改变配体本身的发光性能而受到人们的广泛关注[9-14]。芳香羧酸、氮杂环羧酸等含氮、氧的多齿配体由于骨架比较稳定、羧基的配位模式灵活多变、配位能力强等优点,成为配合物中常见的构筑单元[15-20]。2-羟基间苯二甲酸和4-氧代-4H-吡喃-2,6-二甲酸,都属于双官能化的多羧酸配体,它们不仅有多个配位点可以多种配位模式与金属离子配位,还可以部分脱去质子同时提供氢键的给体和受体进行超分子组装,这就为设计合成具有新颖结构和性质的配合物提供了更多的可能性,但有关金属锌与2-羟基间苯二甲酸的配合物还未见报道,4-氧代-4H-吡喃-2,6-二甲酸与金属镉的配合物的报道也较少[21]。此外,芳香含氮配体如菲咯啉、2,2′-联吡啶都是非常重要的一类构筑羧酸聚合物的辅助配体,它们具有刚性、平面性和芳香性,具有强的配位能力,而且配体本身的吡啶环又有利于形成π-π堆积作用,可以很好的调控配合物的结构和性能而被广泛用于金属-有机配合物的合成[22-24]。
因此本文以金属锌和镉为配位中心,选用2-羟基间苯二甲酸(由2-甲氧基间苯二甲酸(H2mpa)原位生成)和4-氧代-4H-吡喃-2,6-二甲酸作为配体,菲咯啉和2,2′-联吡啶作为辅配体,在水热条件下合成了2个具有良好发光性质的配合物[Zn4(Hhpa)4(phen)4] (1)和{[Cd8(cnam)2(bpy)4(C2O4)6(H2O)8]·2H2O}n(2),并利用元素分析、红外光谱、荧光光谱等对其进行了表征。
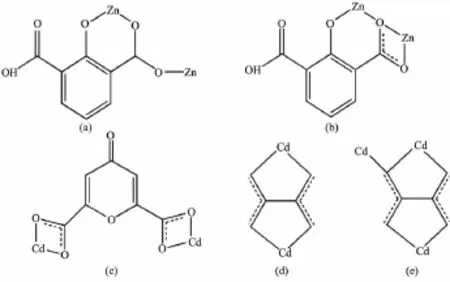
图1 配合物1中Hhpa2-配体(a,b)和配合物2中cnam2-配体(c)及C2O42-(d,e)的配位模式Fig.1 Coordination modes of Hhpa2-(a,b)in 1 and cnam2-(c)and C2O42-(d,e)in 2
1 实验部分
1.1 试剂与仪器
Zn(NO3)2·6H2O、2-甲氧基间苯二甲酸、菲咯啉、Cd(NO3)2·4H2O、4-氧代-4H-吡喃-2,6-二甲酸和2,2′-联吡啶均为分析纯;德国BRUKER SMART APEX CCD单晶衍射仪、德国BRUKER EQUINOX-55红外光谱仪(KBr压片)、日立F-4500型荧光分析仪、ZRY-2P综合热分析仪器、Rigaku D/Max 3III X-射线粉末衍射仪、美国Elementar Vario ELⅢ元素分析仪。
1.2 配合物1~2的合成
Zn4(Hhpa)4(phen)4(1):准确称取Zn(NO3)2·6H2O 0.029 7 g(0.1 mmol)、2-甲氧基间苯二甲酸0.019 6 g (0.1 mmol)、phen 0.019 8 g(0.1 mmol)与10 mL水混合,用0.5 mol·L-1NaOH溶液调节混合溶液的pH值至6.5,在室温下搅拌30 min,随后把混合物转移到25 mL内衬聚四氟乙烯的水热反应釜中密封,然后加热到140℃并恒温72 h后,再以5℃·h-1的速度降温至室温。过滤、洗涤、干燥收集产品,得到淡黄色块状晶体,产率46%。2-甲氧基间苯二甲酸在此反应条件下发生水解生成2-羟基间苯二甲酸(H2hpa)。元素分析C40H24N4O10Zn2:计算值(%):C:56.42;H: 2.84;N:6.58;测定值(%):C:56.40;H:2.86;N:6.55。红外光谱(KBr,cm-1):3 446(s),3 070(w),1 707(s),1 592(s),1 514(s),1 441(s),1 394(s),1 274(m),1 159 (w),1 075(w),851(m),772(w),725(m),605(w)。
{[Cd8(cnam)2(bpy)4(C2O4)6(H2O)8]·2H2O}n(2):准确称取Cd(NO3)2·4H2O 0.0616 g(0.2mmol)、cnam 0.018 4g(0.1 mmol)、bpy 0.015 6 g(0.1 mmol)与10 mL水混合,后续步骤与1类似,只是恒温时间变为96 h,最后得到无色晶体。元素分析C66H54Cd8N8O46:计算值(%):C:30.56;H:2.10;N:4.31;O:28.37;测定值(%): C:30.54;H:2.15;N:4.25;O:28.41。红外光谱(KBr, cm-1):3 423(s),1 630(s),1 586(s),1 442(s),1 368(s),1 246 (w),1 013(w),1 022(w),807(s),762(s),649(w)。
1.3 晶体结构测定
选取大小合适的单晶样品,置于BRUKER SMART APEX II型CCD X-射线单晶衍射仪上,用经石墨单色器单色化的Mo-Kα(λ=0.071 073 nm)射线,在296(2)K下以ω-φ扫描方式,用smart程序收集衍射数据。全部衍射数据还原和结构解析工作分别用SAINT 5.0和SHELXTL-97程序完成。衍射数据经Lp因子和半经验吸收校正。晶体结构用SHELXTL-97程序[25]直接法解出,用SHELXTL-97程序对全部非氢原子坐标及其各向异性热参数基于F2进行全矩阵最小二乘法精修,碳上氢原子采用理论加氢法确定。配合物的晶体学数据见表1,部分键长和键角数据见表2。氢键的键长和键角见表3。
CCDC:1024511,1;1024510,2。
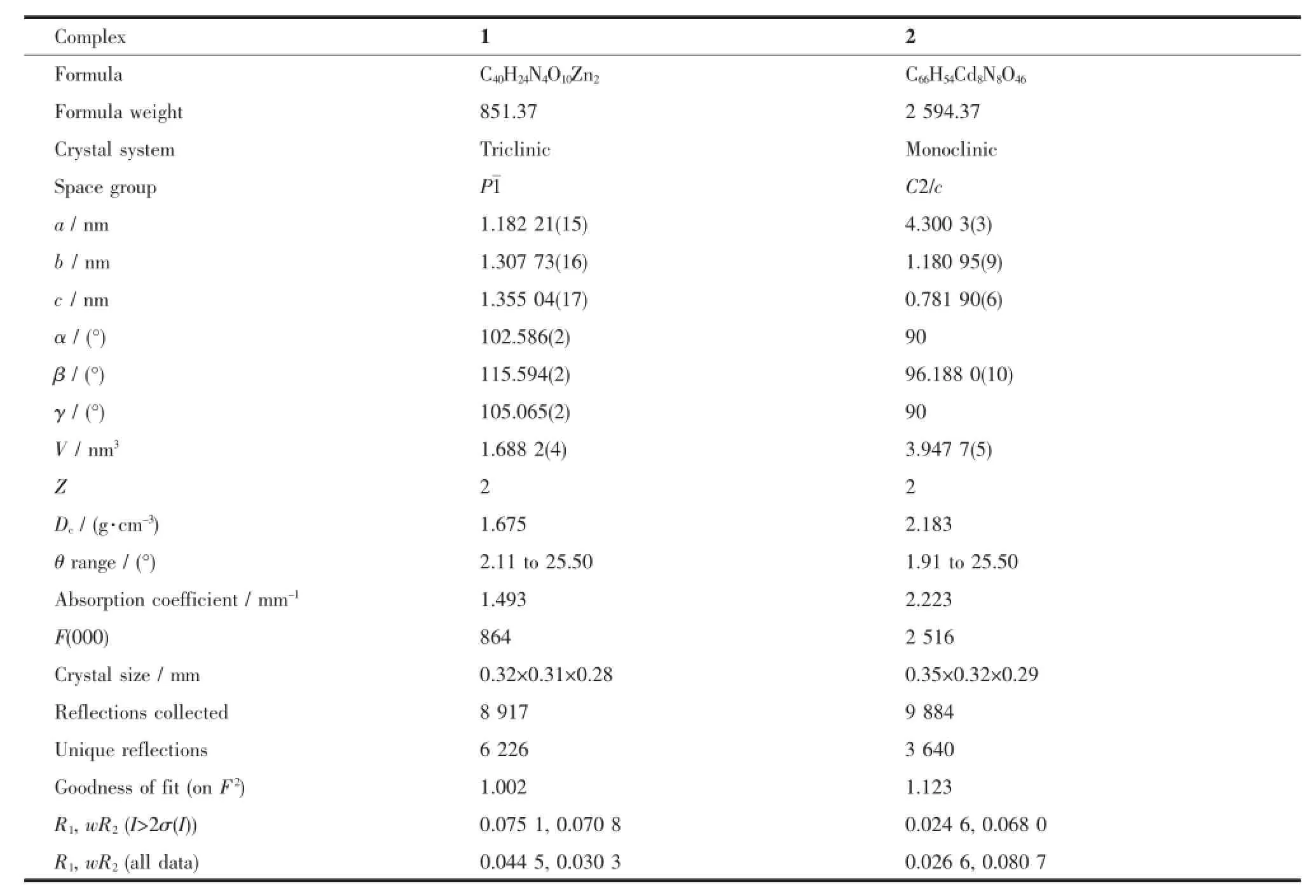
表1 配合物1和2的晶体学数据和结构参数Table1 C rystallographic data of com p lexes 1 and 2
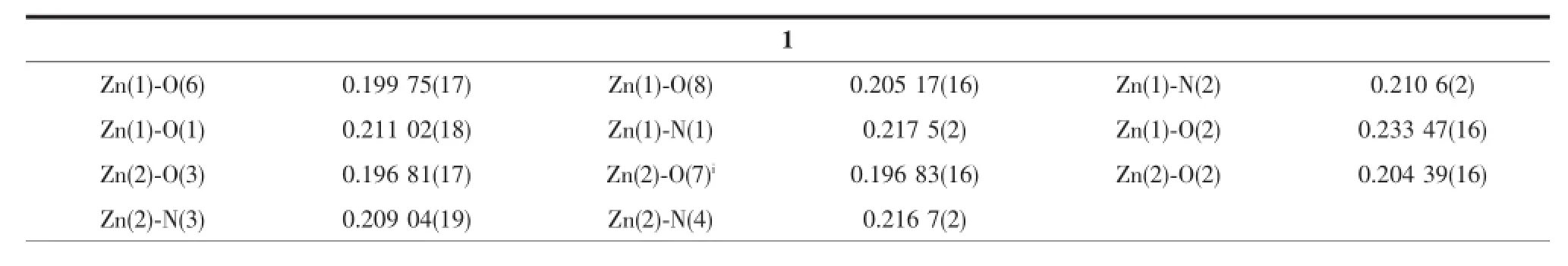
表2 配合物1和2的部分键长Table2 Selected bond distances(nm)and bond angles(°)for complexes 1 and 2
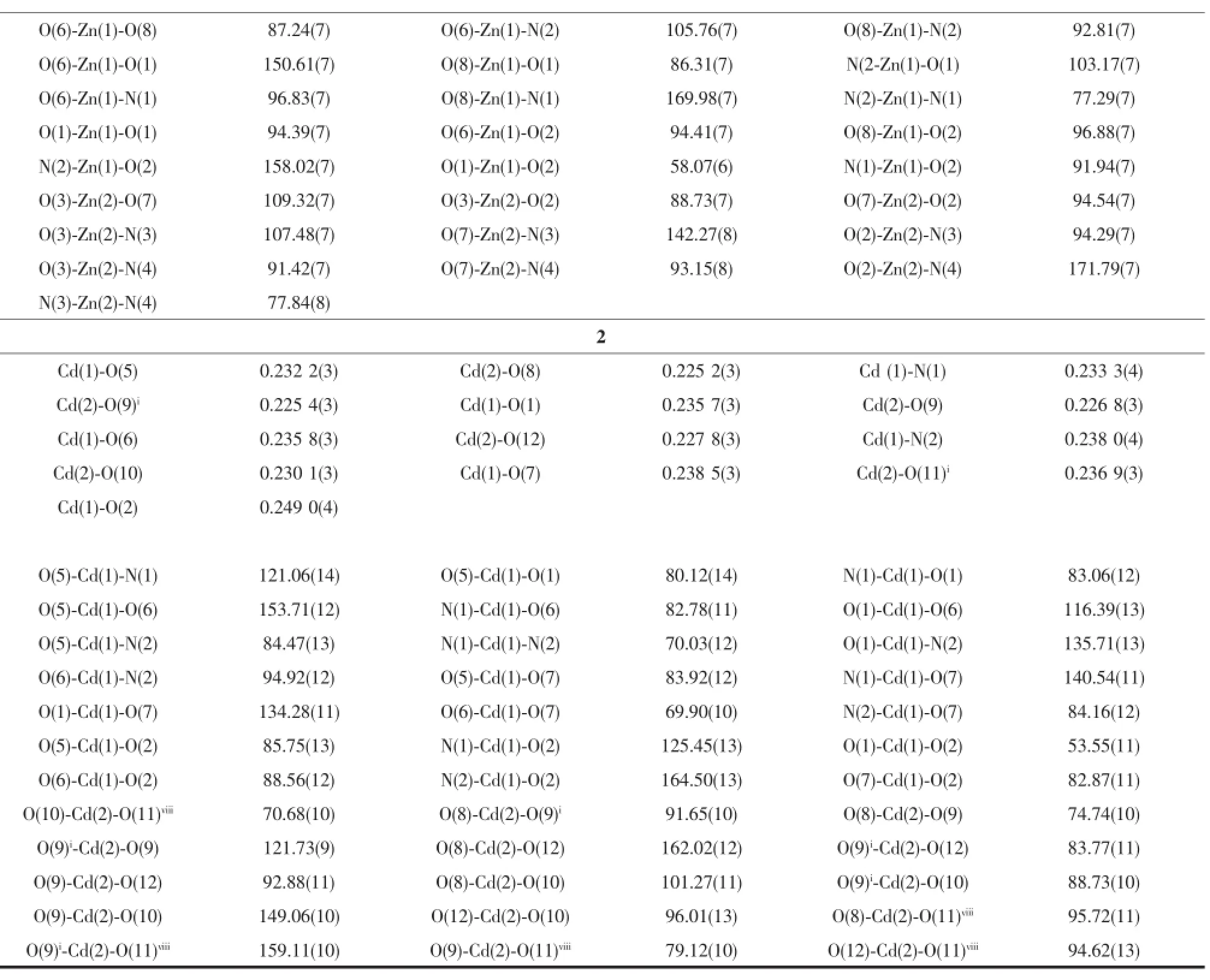
Continued Table 2
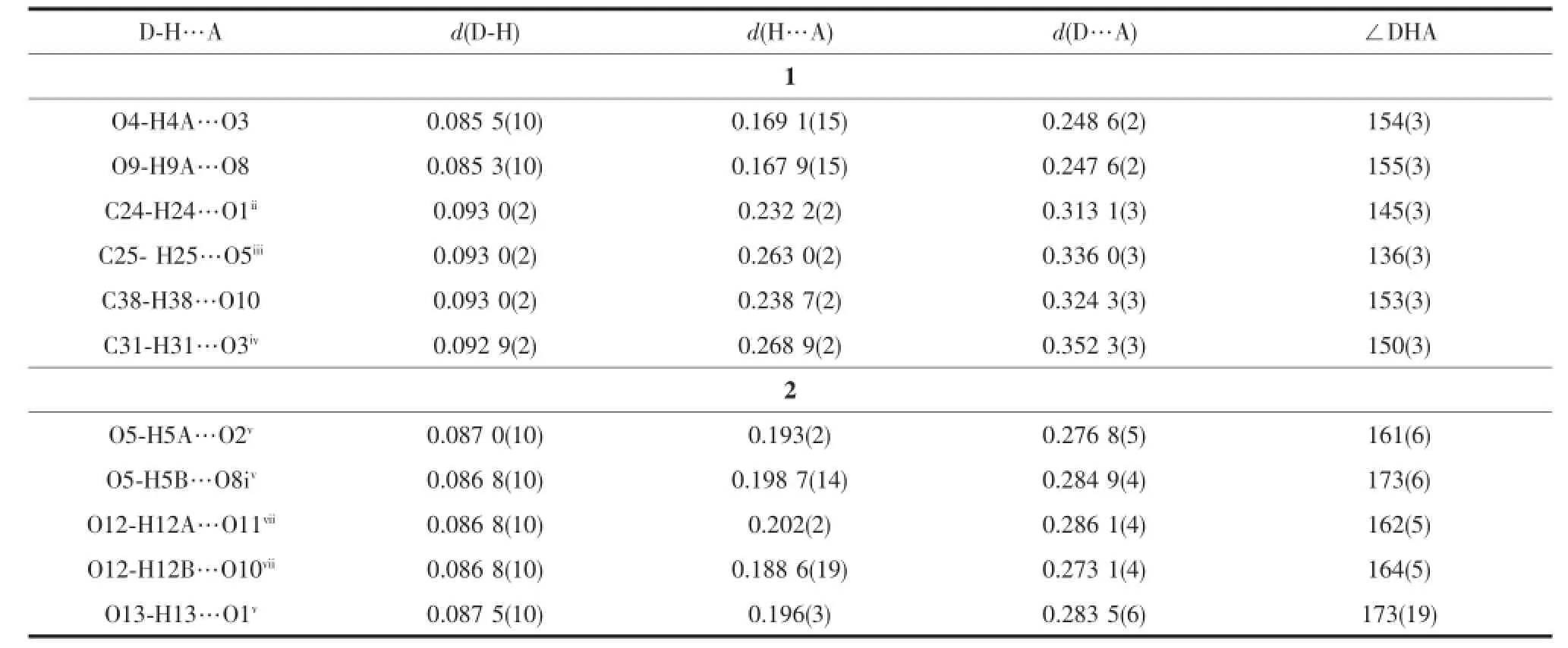
表3 配合物1和2中氢键的键长和键角Table3 Hydrogen bond distances(nm)and bond angles(°)for com p lexes 1 and 2
2 结果与讨论
2.1 [Zn4(Hhpa)4(phen)4](1)的晶体结构分析
X-射线单晶结构分析表明,配合物1为环状四核结构。如图2(a)所示,每个不对称单元里包含2个ZnⅡ离子,2个部分脱去质子的Hhpa2-离子和2个phen配体。每个Zn1Ⅱ离子分别与1个phen的2个氮原子(Zn1-N1 0.217 5(2)nm;Zn1-N2 0.210 6(2)nm)螯合配位,与1个Hhpa2-离子的羟基氧原子(Zn1-O8 0.205 17(16)nm)配位,与2个Hhpa2-配体的3个羧基氧原子(O1,O2,O6)(Zn1-O1 0.211 02(18)nm;Zn1-O2 0.233 47(16)nm;Zn1-O6 0.199 75(17)nm)配位,因此,Zn1离子为六配位呈扭曲的八面体几何构型。O1,O2,O6和N2这4个原子构成了赤道平面,另外2个原子N1,O8占据轴向位置。与Zn1原子不同,每个Zn2原子是五配位呈扭曲的三角双锥构型,其中O3,N3,O7A这3个原子构成了赤道平面,O2和N4占据轴向位置,Zn2-O键长范围在0.196 81(17)~0.204 39(16)nm之间,与文献报道的值相近[26]。
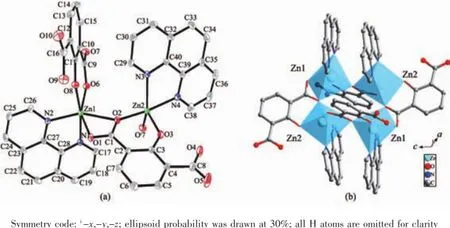
图2 (a)配合物1中ZnⅡ的配位环境图;(b)四核锌结构图Fig.2(a)View of the coordination environment of the ZnⅡion in 1;(b)View of tetranuclear zinc structure
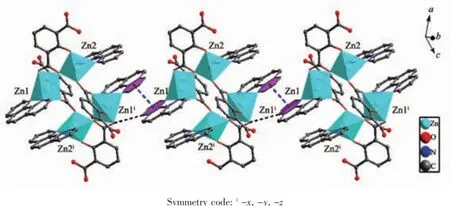
图3 配合物1一维超分子链图Fig.3 View of the 1D supramolecular chain of 1
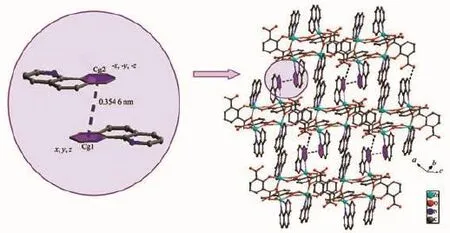
图4 配合物1的二维超分子网图Fig.4 View of the 2D supramolecular network structure of 1
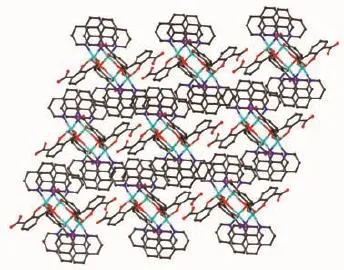
图5 配合物1在c方向三维超分子结构图Fig.5 View of the 3D supramolecular structure of 1 along c axis
值得注意的是,配合物1中未完全脱去质子的Hhpa2-配体采取了2种完全不同的配位模式。其一为三齿桥联配位模式,如图1(a)所示,其中Hhpa2-的1个羧基以双单齿与2个ZnⅡ离子配位,另1个羟基氧原子与1个ZnⅡ离子配位。另一种为四齿螯合桥联配位模式,如图1(b)所示,1个羟基氧原子单齿配位1个ZnⅡ离子,1个羧基以三齿螯合桥联与2个ZnⅡ离子配位。基于上述配位方式,4个ZnⅡ离子通过4个Hhpa2-配体桥联形成了四核锌结构,含有大小为0.651 0 nm×0.600 6 nm的孔洞(基于Zn1…Zn1i和Zn2…Zn2i测量),如图2(b)所示。4个phen配体从4个方向附着在四核环上,有趣的是相邻的2个四核锌单元通过phen分子之间面对面的π…π堆积作用形成一维超分子链(图3),π…π堆积发生在芳香环R1与R2间(R1:N2-C23-C24-C25-C26-C27,R2:N2-C23-C24-C25-C26-C27;Symmetry code: -x,-y,2-z;质心距0.354 6 nm,二面角0°)。同时Hhpa2-配体上的羧基氧(O1)与另1个四核单元的Hhpa2-的碳原子之间氢键作用(C24-H24…O1 0.233 2 nm)进一步稳固了一维超分子链。相邻超分子链又通过phen分子之间边对边的π…π堆积作用(0.336 9和0.335 7 nm)形成二维超分子网,如图4所示。二维超分子网在C-H…O氢键作用下进一步稳固。有趣的是,二维超分子网通过phen分子与Hhpa2-配体的羧基氧原子形成的氢键和C-H…π相互作用(0.284 3 nm),以ABAB…的堆积模式进一步拓展为三维超分子结构,如图5所示。
2.2 {[Cd8(cnam)2(bpy)4(C2O4)6(H2O)8]·2H2O}n(2)的晶体结构分析
X-射线单晶体结构分析表明,配合物2属于单斜晶系,C2/c空间群,如图6所示。配合物2的每个不对称单元里包含了2个晶体学独立的CdⅡ离子。Cd1采取五角双锥几何构型与2个氮原子和5个氧原子配位。2个氮原子来自1个bpy分子(Cd1-N1 0.241 1(2),Cd1-N2 0.241 9(2)nm),2个螯合氧原子(O1,O2)来自于1个cnam2-离子的1个羧基,2个氧原子(O6,O7)来自于1个C2O42-离子,另1个氧原子(O5)来自于配位的水分子。Cd1-O键长的范围在0.232 2(3)~0.249 0(4)nm之间。Cd2六配位呈八面体几何构型,分别与6个氧原子配位。其中5个氧原子(O8,O9,O10,O11A,O9A)来自于3个C2O42-离子,另1个氧原子(O12)来自于配位的水分子。其中4个原子O9、O10、O11A、O9A构成赤道平面,2个原子O8和O12占据了轴向位置。
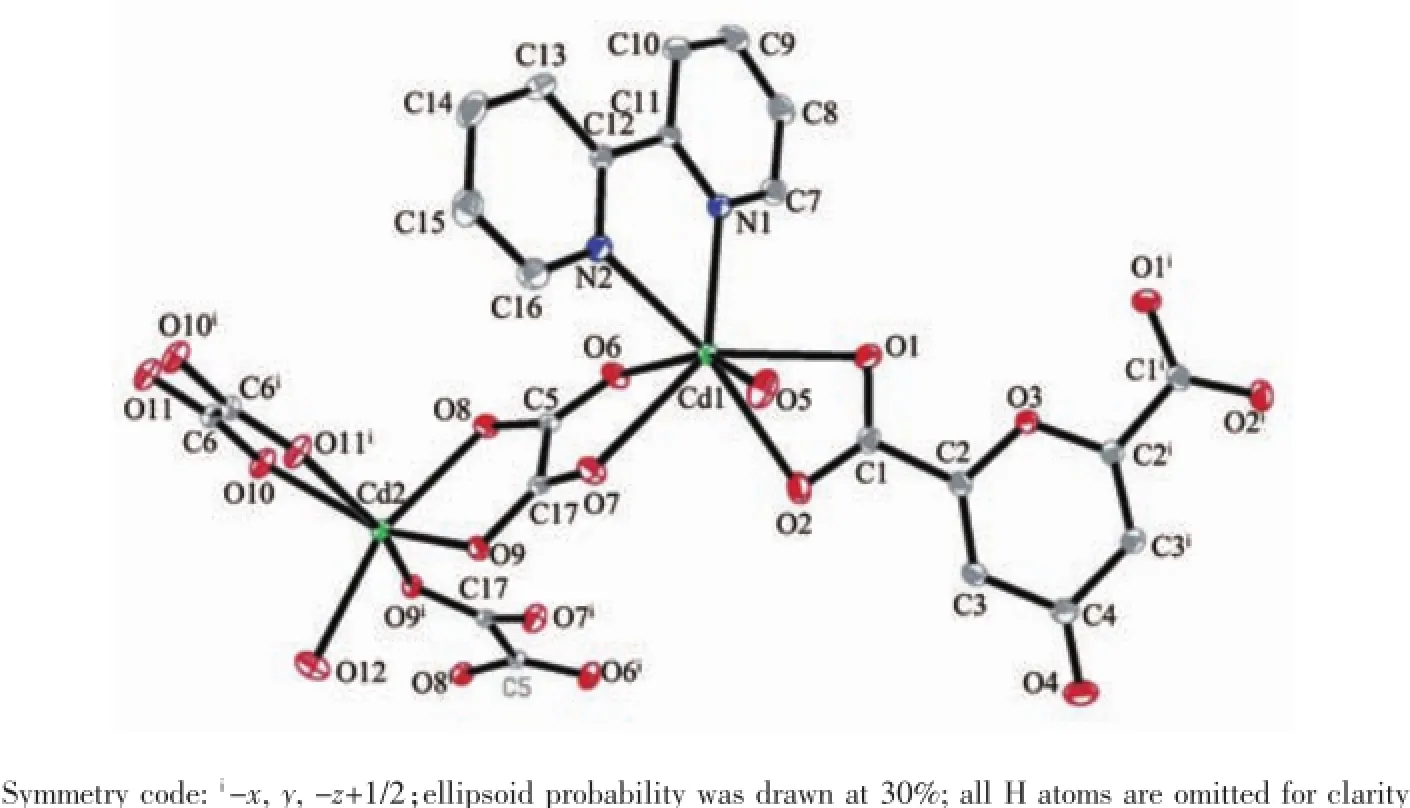
图6 配合物2中CdⅡ的配位环境图Fig.6 View of the coordination environment of CdⅡion in 2
值得注意的是C2O42-离子是在过渡金属CdⅡ离子的催化下由H2cnam配体发生原位氧化-水解反应生成[27];文献报道的H2cnam配体原位氧化-水解生成C2O42-离子反应多由重稀土金属离子催化形成[28],在过渡金属离子CdⅡ离子的催化下由H2cnam配体发生原位氧化-水解生成C2O42-离子的反应尚属首次发现。完全脱去质子的cnam2-离子以螯合桥联双齿与2个CdⅡ离子配位,如图1(c)所示。每个Cd1与1个cnam2-离子、1个C2O42-离子相连。每个Cd2与3个C2O42-离子相连。在配合物2中草酸采取了2种不同的桥联模式(图1):(a)η2∶η2∶μ2;(b)η2∶η1∶η1∶μ3。基于这种配位模式,完全脱去质子的C2O42-离子与Cd1和Cd2原子相连,如图1(d)所示。而相邻的2个Cd1与cnam2-离子配位,形成链状四核镉结构;如果以四核镉单元作为次级建筑单元(SBU),它与相邻的6个SBU连接形成了具有三维网状结构(图7)。该结构也可以看作是首先由Cd2离子与C2O42-离子相连形成链状结构,然后这样的链又被cnam2-离子连接形成三维结构(图8)
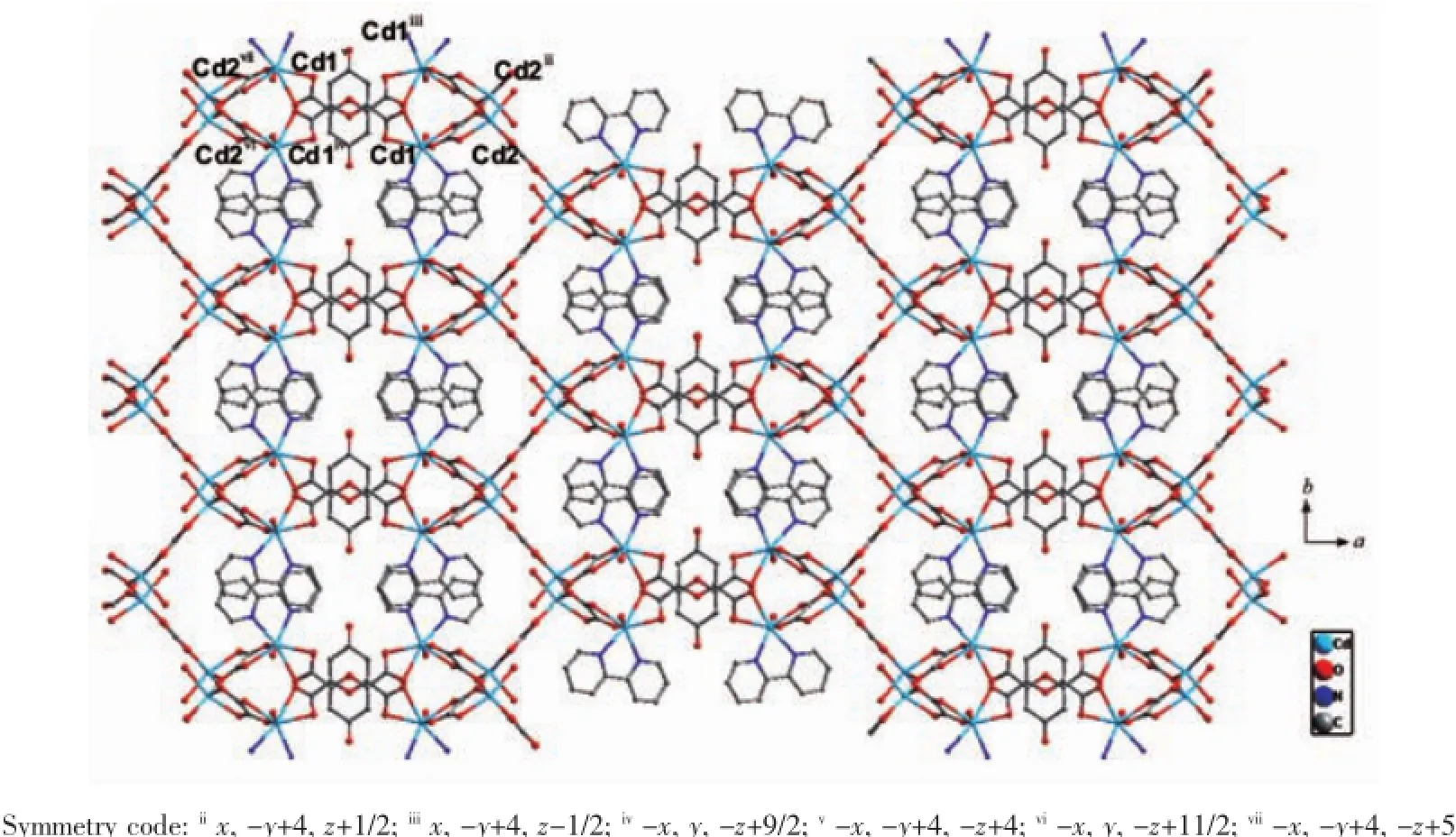
图7 配合物2在c方向上呈三维网状结构Fig.7 View of the 3D network structure of 2 along c axis
2.3 配合物的红外图谱
配合物1在3 446 cm-1附近的峰归属为未脱去质子羧基上的O-H伸缩振动。在3 070 cm-1左右出现的峰位为不饱和C-H键的伸缩振动。在1 702 cm-1附近有羰基吸收峰的出现,证明配体羧基上的质子并没有完全脱去。1 286 cm-1附近的峰是O-H面外弯曲振动。在配合物2的红外谱图中,在3 500~3 000 cm-1范围内出现了中等强度的宽峰,主要归属于分子内配位水和结晶水的O-H伸缩振动。在1 700 cm-1附近没有羰基吸收峰存在,说明配体羧基上的质子全部脱掉。在1 246 cm-1处较强吸收峰出现,表明是配体环内存在C-O-C醚键的伸缩振动。在含羧基的配合物中,一般以C=O的反对称伸缩振动的峰位νas与对称伸缩振动的峰位νs的差值Δν作为判断羧基配位类型的标准。当Δν>200 cm-1时,可以认为羧酸根以单齿配位;当Δν<200 cm-1时,可以认为羧酸根以双齿配位[29]。配合物1中C=O的反对称和对称伸缩振动的峰位分别在1 707、1 592 cm-1和1 514、1 441 cm-1处,其Δν分别为193和151 cm-1,因此可以判断羧酸根以双齿配位。配合物2中C=O的反对称和对称伸缩振动的峰位分别在1 630、1 586 cm-1和1 493、1 442 cm-1,其Δν分别为137和144 cm-1,故羧酸根也以双齿配位。这一结果与晶体结构解析的结果一致。

图8 配合物2在b方向上呈三维结构Fig.8 View of the 3D structure of 2 along b axis
2.4 配位物的荧光光谱
由于d10过渡金属配位聚合物不仅表现出新颖的结构模式,同时还具有优异的荧光性能。因此,我们在室温下测定了H2mpa配体和H2cnam配体以及配合物1和2的固态荧光光谱(图9)。尽管H2mpa配体在水热条件下发生水解形成H2hpa配体,但两者主要官能团基本相同,因此以H2mpa配体与配合物1的荧光进行对比研究。以317 nm的紫外光激发H2mpa配体在358 nm处出现了荧光发射峰。以373 nm波长的光激发,配合物1在493 nm处出现了1个强荧光发射峰,并且相对于配体的发射峰发生了明显的红移。这是由于ZnⅡ与配体配位后,加强了配体的吸电子能力,使激发态的能量降低,谱带红移,发光机理应该归属为配体到金属的电荷跃迁(LMCT)[30]。以317 nm的紫外光激发H2cnam配体在460 nm处出现了弱荧光发射峰。用411 nm波长的光激发,配合物2在473 nm出现1个强的荧光发射峰,且发射峰的形状与H2cnam配体相似,发光机理应该归属为自H2cnam配体的荧光发射峰。而且配合物2的荧光相比自由的H2cnam配体的荧光有了明显的增强,这是因为金属与配体形成聚合物增加了配体的刚性,从而降低了无辐射跃迁能量的损失,更有利于能量的转移[31],致使配合物的荧光强度有了明显的增强。
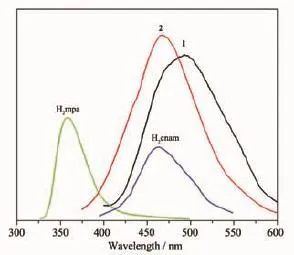
图9 配体H2mpa,H2cnam和配合物1和2的荧光光谱图Fig.9 Emission spectra of H2mpa,H2cnam,1 and 2 in the solid state at room temperature
2.4 配合物1和2的热稳定性和粉末衍射分析
为了研究配合物1和2的热稳定性,对其进行热分析表征(图10a)。配合物1在低于205℃保持相对稳定,在205~430℃之间,配合物2次失重,其中220~285℃之间失重39.96%,对应失去phen配体(计算值:40.82%),在285~430℃之间配合物第二次失重,失重43.78%,Hhpa2-配体完全分解(计算值: 42.31%),最终残余为ZnO。配合物2在温度低于240℃,失重为7.05%,对应着失去游离水和结晶水(计算值:6.94%)。温度在310~430℃之间,失重为62.59%,对应于C2O42-、bpy和cnam2-配体的分解(计算值:63.05%),配合物2骨架坍塌,剩余产物为氧化镉,重量为30.46%
配合物1和2的X射线粉末衍射图显示其主要特征衍射峰位与由单晶数据理论拟合的峰位基本吻合,表明制备的化合物为纯相(图10b)。
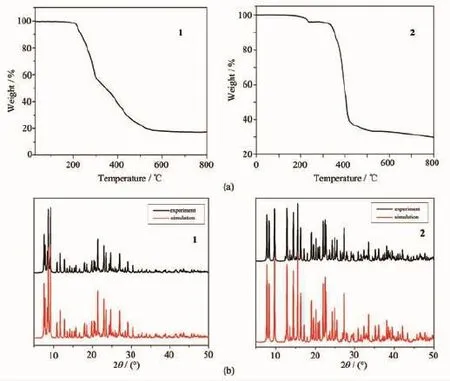
图10 (a)配合物1和2的TGA图;(b)配合物1和2的粉末衍射图Fig.10(a)TGA of comp lexes 1 and 2;(b)XRD patterns of comp lexes 1 and 2
3 结论
利用2-甲氧基间苯二甲酸和4-氧代-4H-吡喃-2,6-二甲酸作为反应物分别和锌盐、镉盐反应,在水热反应条件下合成得到了2个基于四核金属单元构筑的配合物。配合物1中的配体Hhpa2-、配合物2中的配体C2O42-都是原位反应生成,而且在配合物1和2中Hhpa2-,cnam2-和C2O42-离子表现出丰富的配位模式。荧光光谱表明,由于d10构型的中心金属离子和配体本身的刚性使得2个配合物都具有良好的荧光性质,在发光材料方面有潜在的应用价值。
[1]Liu Q D,Li J R,Gao S,et al.Eur.J.Inorg.Chem.,2003,4: 731-736
[2]Yang Y T,Luo F,Che Y X,et al.Cryst.Growth Des.,2008, 8(10):3508-3510
[3]Pan Z R,Sng Y,Jiao Y,et al.Inorg.Chem.,2008,47(12): 5162-5168
[4]Eddaoudi M,Moler D B,Li H,et al.Acc.Chem.Res.,2001, 34:319-330
[5]Reger D L,Wright T D,Semeniuc R F,et al.Inorg.Chem.,2001,40:6212-6219
[6]Bu X H,Chen W,Lu S L,et al.Angew.Chem.,Int.Ed., 2001,40:3201-3203
[7]Kitaura R,Fujimoto K,Noro S,et al.Angew.Chem.,Int. Ed.,2002,41:133-135
[8]Kitaura R,Seki.K,Akiyama G,et al.Angew.Chem.,Int. Ed.,2003,42:428-431
[9]Zhu H G,Strobele M,Yu Z,et al.Inorg.Chem.Commun., 2001,4:577-581
[10]YU Shu-Yan(于澍燕),ZHANG Zhong-Xing(张中兴),LI Hui (李慧),et al.Chem.J.Chinese Universities(高等学校化学学报),2005,26(2):376-378
[11]Liu S G,Zuo J L,Li Y Z,et al.J.Mol.Struct.,2004,705: 153-157
[12]Hatch D M,Wacholtz W F,Mague J T.J.Chem.Crystallogr., 2005,35:327-338
[13]Chandrasekhar V,Azhakar R,Zacchini S,et al.Inorg. Chem.,2005,44:4608-4615
[14]Rahaman S H,Ghosh R,Lu T H,et al.Polyhedron, 2005,24:1525-1532
[15]Chen B L,Wang L B,Xiao Y Q,et al.Angew.Chem.,Int. Ed.,2009,48:500-503
[16]LU Wen-Guan(卢文贯),LIU Hong-Wen(刘宏文).Chinese J. Inorg.Chem.(无机化学学报),2010,26(8):1450-1456
[17]Wang J,Lin ZJ,Ou YC,etal.Inorg.Chem.,2008,47:190-199
[18]LI Wei(李薇),LI Chang-Hong(李昶红),YANG Ying-Qun (杨颖群),et al.Chinese J.Inorg.Chem.(无机化学学报), 2009,25(2):369-372
[19]Ohmori O,Kawano M,Fujita M.J.Am.Chem.Soc., 2004,126:16292-16293
[20]Lewis E A,Smith J R L,Waiton P H,et al.J.Chem.Soc. Dalton Trans.,2001,8:1159-1161
[21]Yasodha V,Govindarajan S,Low J N,et al.Acta Cryst. Sect.C,2007,63:m207-215
[22]Gu J Z,Gao Z Q,Tang Y.Cryst.Growth Des.,2012,12: 3312-3323
[23]LI Gong-Chun(李公春),WANG Hong-Sheng(王宏胜),ZHU Lei(朱蕾),et al.Chinese J.Inorg.Chem.(无机化学学报), 2012,28(11):2369-2372
[24]HUANG Yan-Ju(黄艳菊),NI Liang(倪良),WANG Qiang (王强).Chinese J.Inorg.Chem.(无机化学学报),2012,28 (5):1050-1054
[25]Sheldrick G M.SHELXS-97,Program for X-ray Crystal Structure Solution,University of Göttingen,Göttingen, Germany,1997.
[26]JIA Xiao-Yan(贾晓燕),CHENG Mei-Ling(程美令),LIU Qi (刘琦),et al.Chinese J.Inorg.Chem.(无机化学学报), 2011,8:1517-1522
[27]Zhang X M.Coord.Chem.Rev.,2005,249,1201-1219
[28]Zhang Z J,Zhang S Y,Cheng P,et al.CrystEngComm, 2010,12,1809-1815
[29]Kazuo Nakamoto,Translated by HUANG De-Ru(黄德如), WANG Ren-Qin(汪仁庆).Infrared and Raman Spectra of Inorganic and Coordination Compounds(无机和配位化合物的红外和拉曼光谱).Beijing:Chemistry Industry Press, 1986.
[30]Zhang L Y,Liu G F,Zheng S L,et al.Eur.J.Inorg.Chem., 2003,2965-2971
[31]Valeur B.Molecular Fluorescence:Principles and Applications.Weinheim:Wiley-VCH,2012.
Syntheses,Crystal Structures and Fluorescent Properties of Zinc/Cadm ium Comp lexes Based on Tetranuclear Metal Unit
ZHANG Xiao-Ge GAO Lou-Jun*CHEN Xiao-Li*CUI Hua-Li MA Hong-Yan
(Shaanxi Key Laboratory of Chemical Reaction Engineering,Department of Chemistry and Chemical Engineering, Yanan University,Yanan,Shaanxi 716000,China)
Two complexes,Zn4(Hhpa)4(phen)4(1)and{[Cd8(cnam)2(bpy)4(C2O4)6(H2O)8]·2H2O}n(2)(H2hpa=2-hydroxyisophthalic acid,phen=phenanthroline,H2cnam=4-oxo-4H-pyran-2,6-dicarboxylic acid and bpy=2,2′-bipyridyl), were synthesized under hydrothermal conditions and were characterized by elemental analysis,IR spectrum, single-crystal X-ray diffraction,Fluorescence,TGA and XRD.Complex 1 shows a cyclic tetranuclear structure. The neighboring tetranuclear structures are linked into 3D supramolecular network through π…π stacking interactions.While complex 2 is unprecedented 3D polymer based on tetranuclear cadmium clusters cross-linked by C2O42-ions and cnam2-ligands.In 1 and 2,Hhpa2-,cnam2-ligand and C2O42-ion display colorful coordination modes.In addition,the thermal stabilities and luminescence properties of 1 and 2 were also studied.CCDC:1024511,1;1024510,2.
zinc/cadmium complexes;crystal structure;hydrothermal synthesis;luminescence
O614.24+1;O614.24+2
A
1001-4861(2015)04-0739-10
10.11862/CJIC.2015.110
2014-10-28。收修改稿日期:2014-01-14。
国家自然科学基金(No.21101133),陕西省自然科学基础研究计划项目(No.2014JM2056)资助。
*通讯联系人。E-mail:glj@yau.edu.cn;chenxiaoli003@163;会员登记号:S06N7138M1005(陈小莉),S06N2584M1005(高楼军)。

