蓝色磷光嘧啶铱配合物的合成、晶体结构及发光性能
葛国平 韦传东 李春艳 梁云霄 梁洪泽
(宁波大学材料科学与化学工程学院,宁波315211)
葛国平*韦传东 李春艳 梁云霄 梁洪泽
(宁波大学材料科学与化学工程学院,宁波315211)
合成了一种铱配合物[Ir(N4)(MDFPPM)2](MDFPPM=4,6-二甲基-2-(2,4-二氟苯基)嘧啶,N4=5-(2-吡啶基)-1H-四唑),并利用X射线单晶衍射仪测定了该化合物的2种晶体结构。通过紫外-可见(UV-Vis)吸收光谱、荧光光谱、循环伏安法及含时密度泛函理论(TD-DFT)对其光物理性能及能级结构进行了研究。结果表明:2个晶体的空间构型均为单斜,空间群均为P21/c;Ir(N4) (MDFPPM)2的最高占据轨道(HOMO)主要定域于金属Ir和配体MDFPPM的苯环上,最低未占有轨道(LUMO)主要定域于配体MDFPPM的嘧啶环上;配合物Ir(N4)(MDFPPM)2的HOMO和LUMO能级分别为-5.98和-3.22 eV;Ir(N4)(MDFPPM)2在77 K乙腈溶液中的发射峰波长在449、480和513 nm,CIE x,y色度坐标为(0.15,0.23),是一种潜在的蓝色磷光材料。
铱配合物;嘧啶;磷光材料;OLED
近年来,电致磷光材料因具有良好的发光性能和理论上可以达到100%的内量子效率而成为研究热点[1]。有机电致磷光材料常用的重金属原子多为第Ⅷ族的金属,如锇(Os)[2-4]、铂(Pt)[5-7]、铱(Ir)[8-10]等,其中金属铱配合物具有相对较短的三线态寿命和更高的发光效率、能在室温下发出较强的磷光以及可以通过配体结构的调整而调节发光波长使电致发光器件的颜色覆盖整个可见光区,是研究得最多的一种磷光材料[10]。
要实现全色显示及照明等应用目的,在三基色中蓝光是必不可少的。但相较于其他颜色的磷光材料,蓝色电致磷光材料的发光效率通常较低,目前文献中报道的色纯度高的蓝色磷光铱配合物也相对较少,因此合成高效饱和蓝色磷光铱配合物是急需的。美国普林斯顿大学的Forrest小组[11]在2003年报道了蓝光铱配合物FIrpic,这是目前文献报道中提到最多的蓝光配合物。但是他们的色饱和度为(0.16,0.29),y值偏大,发光颜色偏向绿光,在色纯度上有明显不足。因此很好地将蓝光材料的发射波长调到深蓝光区域(CIE y<0.15)意义重大。为了实现金属铱配合物发射光谱蓝移,有效的途径是降低HOMO能级或是提高LUMO能级。金属铱配合物的HOMO主要是由苯环的π轨道和金属离子的d轨道组成,所以降低HOMO能级可以通过在苯环上引入吸电子的基团,如:F[11-13],-CF3[14-15],-CN[16]等。另一个策略是引入强场配体以稳定金属dπ轨道,从而升高MLCT,使发光蓝移。通过把FIrpic中的辅助配体吡啶羧酸换成具有更强吸电子能力的基团,如:FIr6[17](CIE x,y为(0.16,0.26))中氮杂环硼化吡唑、FIrN4[18](CIE x,y为(0.15,0.24))中吡啶四唑和FIrtaz[18]中吡啶三唑,实现了波长的蓝移。提高分子的LUMO能级可以通过在吡啶基团中引入给电子基团(如甲基、甲氧基、胺基等[19-21])或者是用LUMO能级更高的N杂环(如吡唑、噁唑、咪唑等[22-26])取代吡啶来实现。
据文献[27]报道,嘧啶及其衍生物的铱配合物作为电致磷光材料具有高的效率和长的器件寿命。但是蓝色磷光嘧啶铱配合物鲜见报道[28],本文以4,6-二甲基-2-(2,4-二氟苯基)嘧啶(MDFPPM)为螯合配体,5-(2-吡啶基)-1H-四唑为辅助配体成功制备了蓝色磷光铱配合物Ir(N4)(MDFPPM)2,并对其晶体结构和光物理性能进行了详细研究。
1 实验部分
1.1 试剂
2-氯-4,6-二甲基嘧啶(分析纯,金坛市合恩泰化工有限公司);5-(2-吡啶基)-1H-四唑(98%,Matrix Scientific);三水合三氯化铱(99%,西安凯立化工有限公司);2,4-二氟苯基硼酸(分析纯,宁波应发硼纳有限公司)、三苯基膦(分析纯,国药集团化学试剂有限公司);醋酸钯(分析纯,西安凯立化工有限公司)。其他试剂均为市售分析纯,没有经过进一步的提纯。
1.2 仪器和测试方法
所用仪器:BRUKER Ac-400型超导核磁共振仪;BRUKER D8 Focus红外光谱仪;Rigaku Mercury 70 CCD型X射线衍射仪;上海辰华CHI600A电化学工作站;Hitachi F-4600荧光分光光度计;Shimadzu UV-2550型紫外-可见光谱仪;Elementar Vario EL元素分析仪。
通过循环伏安法(CV)测定铱配合物的电化学性质。测试条件为:测量时所用的工作电极为铂电极、辅助电极为铂丝,参比电极为饱和甘汞电极;使用浓度为0.1 mol·L-1的四正丁基高氯酸铵(TBAP)作为支持电解质,测试样品配制成1 mmol·L-1的乙腈溶液,氮气保护下测定它们的循环伏安特性,扫描速率为100 mV·s-1。
利用Shimadzu UV-2550型紫外-可见光谱仪测定金属配合物的吸收光谱。吸收光谱测试条件为:分别称取一定量的配合物Ir(N4)(MDFPPM)2于容量瓶中,用二氯甲烷稀释至刻度,得到一定浓度的溶液,室温下测定,紫外光谱的扫描波长范围是200~550 nm。配合物在溶液和固态下的光致发光(photoluminescent,PL)光谱用Hitachi F-4600荧光光谱仪测定,荧光光谱测定的狭缝宽度为5 nm。其中,低温发射光谱测试用液氮冷却样品。配合物的光致发光寿命用transientspectrofluorimeter(Edinburgh Instruments,FLSP920)瞬态荧光/磷光光谱仪测定,使用时间相关的单光子计数技术,扫描波长范围是190~870 nm,荧光/磷光发光寿命的测量范围是10 ps~10 s。
1.3 配体和配合物的合成
配体的合成方法参照文献[29],配合物的合成按文献[18]改进方法制备。合成路线如图1所示。
1.3.1 4,6-二甲基-2-(2,4-二氟苯基)嘧啶
(MDFPPM)的合成
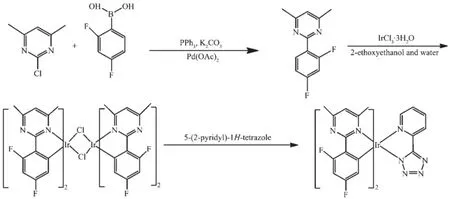
图1 配体(MDFPPM)和配合物Ir(N4)(MDFPPM)2的合成路线Fig.1 Synthesis route of(MDFPPM)and Ir(N4)(MDFPPM)2
在100 mL三颈烧瓶中依次加入3.996 1 g(25 mmol)2-氯-4,6-二甲基嘧啶,4.745 3 g(30 mmol)2,4-二氟苯基硼酸,25 mL乙二醇二甲醚,0.655 7 g(2.5 mmol)三苯基磷,34 mL饱和碳酸钾溶液。氮气保护下,加入0.14 g(0.625 mmol)醋酸钯,加热回流18 h,冷却至室温,分出有机相,水相用乙酸乙酯(60 mL× 4)萃取。合并有机相后,分别用80 mL的蒸馏水和80 mL饱和食盐水洗涤,无水硫酸镁干燥,过滤,浓缩滤液,以二氯甲烷-丙酮混合溶剂(10∶1,V/V)作为洗脱剂进行硅胶柱层析,得到淡黄色固体,产率78%。m.p.41~42℃;1H NMR(CDCl3,400 MHz)δ:8.01(t,1H),6.95(t,3H),2.51(m,6H);元素分析按C12H10F2N2,计算值(%):C 65.45,H 4.58,N 12.72;实验值(%):C 65.41,H 4.54,N 12.69。
1.3.2 配合物Ir(N4)(MDFPPM)2的合成
称取0.978 5 g(4.4 mmol)2-(2,4-二氟苯基)嘧啶和0.725 1 g(2 mmol)IrCl3·3H2O于100 mL反应瓶中,再加入30 m L乙二醇单乙醚和10 mL水,在氮气保护下回流24 h,反应液冷却到室温,加入到100 mL水中,过滤,用水、乙醇洗涤,得黄色固体[Ir (MDFPPM)2Cl]2,产率32%。
称取0.536 5 g(0.4 mmol)[Ir(MDFPPM)2Cl]2和0.201 5 g(0.6 mmol)5-(2-吡啶基)-1H-四唑于100 mL反应瓶中,再加入10 mL二氯甲烷和3 mL乙醇,氮气保护下反应6 h。过滤,在滤液中加入30 mL正己烷,静置待固体析出,抽滤,丙酮洗涤,得黄色固体.粗产品用硅胶柱层析分离,洗脱剂为二氯甲烷和丙酮混合溶剂(10∶1,V/V),得黄色固体Ir(N4)(MDFPPM)2,产率82%。1H NMR(CDCl3,400 MHz)δ:8.62(d,1H),8.12(d,1H),7.82(s,1H),7.75(d,1H),6.83(t,4H),6.71 (m,1H),2.74(m,12H);元素分析按C30H22F4IrN9,计算值(%):C 46.39,H 2.85,N 16.23;实验值(%):C 46.47,H 2.83,N 16.18;IR(KBr,cm-1):ν(Ar=C-H)2 924(w),ν(Ar-C=C)1 602(s),ν(C=N)1 538(s),ν(Ar-CH3)1 433(m)。
1.4 Ir(N4)(MDFPPM)2的单晶X-射线结构分析
配合物Ir(N4)(MDFPPM)2的2种单晶分别是从不同体积比的二氯甲烷和乙醇混合溶液中通过溶剂缓慢挥发得到的,并用X-射线单晶衍射仪进行了结构分析。配合物的晶体结构是在室温下,用经石墨单色化的Mo Kα射线(波长为0.071 073 nm)作为辐射光源,由Rigaku Mercury 70 CCD X射线单晶衍射仪上收集衍射数据。不含二氯甲烷的晶体在3.03°≤θ≤26.37°范围内共收集了22 270个衍射点,其中独立衍射点5 806个,含二氯甲烷的晶体在3.27°≤θ≤26.37°范围内收集14 200个衍射点,其中独立衍射点6 285个,全部数据经过吸收校正。用SHELXS-97程序完成结构解析[30],SHELXL-97程序完成结构精修[31]。对于所有非氢原子采用各向异性和全矩阵最小二乘法进行修正。配合物的晶体学数据列于表1,主要键长和键角列于表2。
CCDC:1043237,Ir(N4)(MDFPPM)2;1043238,Ir(N4)(MDFPPM)2·CH2Cl2。

表1 配合物Ir(N4)(MDFPPM)2和Ir(N 4)(M DFPPM)2·CH2Cl2的晶体学数据Tab le 1 Crystallographic data of Ir(N4)(MDFPPM)2and Ir(N4)(MDFPPM)2·CH2Cl2
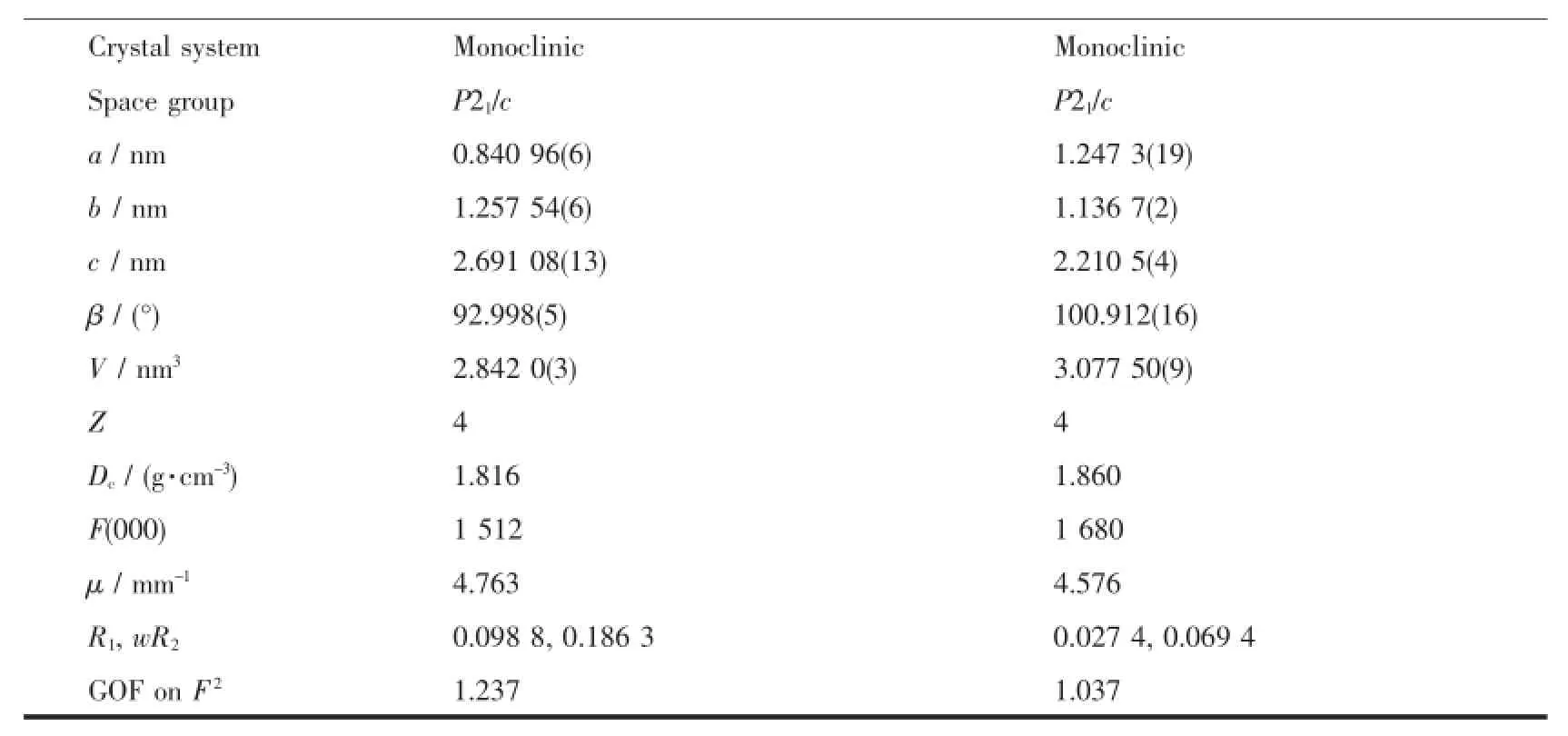
续表1
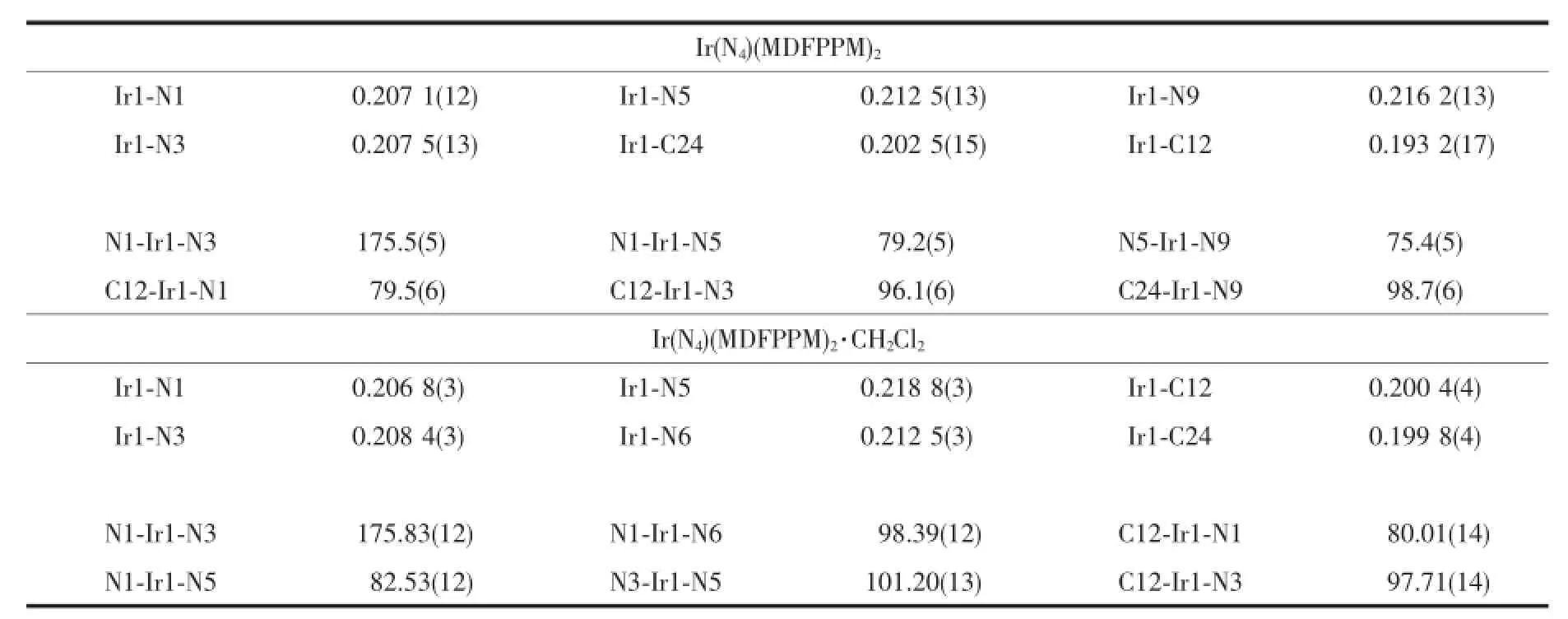
表2 配合物Ir(N4)(MDFPPM)2和Ir(N 4)(M DFPPM)2·CH2Cl2的主要的键长(nm)和键角(°)Table2 Selected bond lengths(nm)and angles(°)of the complex Ir(N4)(MDFPPM)2and Ir(N4)(MDFPPM)2·CH2Cl2
2 结果与讨论
2.1 晶体结构
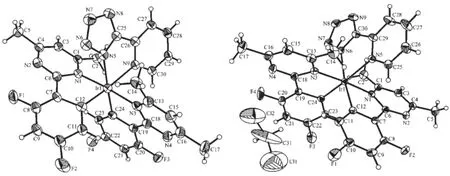
图2 Ir(N4)(MDFPPM)2(左)和Ir(N4)(MDFPPM)2·CH2Cl2(右)的椭球图Fig.2 Ellipsoid(30%)structures of Ir(N4)(MDFPPM)2(left)and Ir(N4)(MDFPPM)2·CH2Cl2(right)
从不同体积比的二氯甲烷和乙醇混合溶液中通过溶剂缓慢挥发得到了配合物Ir(N4)(MDFPPM)2的 2种晶体。293 K温度下测定其晶体,发现它们具有不同的单晶结构,其中1个晶体结构中不含溶剂二氯甲烷,另一个晶体结构中含有溶剂二氯甲烷,这可能与晶体生长的环境有关系。两个晶体的空间构型均为单斜,空间群均为P21/c。从图2的晶体椭球图中可以看出:Ir(N4)(MDFPPM)2和Ir(N4)(MDFPPM)2· CH2Cl2都为单核晶体,配合物中铱原子是六配位,与大多数金属铱配合物相同,中心原子铱与配位原子氮和碳形成扭曲的八面体。在4,6-二甲基-2-(2,4-二氟苯基)嘧啶配体中,2个配位碳原子采取顺式构象,而2个氮原子采取顺式构象。从表2可以看出:2个晶体相应的键长和键角基本相同,并且所有键长和键角都在正常值范围之内,与类似的配合物如Ir (PyTz)的键长近似[30]。Ir-C和Ir-N键长在1.932(17) nm和2.188(3)nm之间,Ir-N键长略长于Ir-C键。另外,与文献[30-32]报道的类似,Ir-N(N^N)键长比Ir-N (C^N)键长要长。不同的是,在Ir(N4)(MDFPPM)2分子由氢键和范德华作用力组成的3D超分子结构框架内,由于溶剂分子CH2Cl2的存在,导致2种配合物的晶胞参数与晶胞体积不一致。
2.2 配合物Ir(N4)(MDFPPM)2的光物理性质
Ir(N4)(MDFPPM)2的紫外-可见吸收光谱如图3所示,在紫外吸收区230~350 nm,配合物展示了较强的多重吸收带,该吸收带源自于配体自旋允许的1LC(1π→π*)的跃迁。350~450 nm较弱的吸收带来源于1MLCT(金属到配体的电荷转移),1LLCT(配体-配体电荷转移),3MLCT,3LLCT和配体本身的3π→π*跃迁。由于铱的重原子效应,原来自旋禁阻的3MLCT,3LLCT和3π→π*跃迁变得部分允许[33],在吸收光谱中表现出一定的强度。
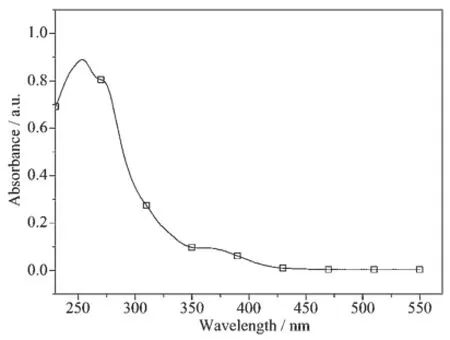
图3 Ir(N4)(MDFPPM)2在CH2Cl2溶液中的UV-Vis吸收光谱Fig.3 UV-Vis absorption spectra of Ir(N4)(MDFPPM)2in CH2Cl2solution
在室温下,Ir(N4)(MDFPPM)2在溶液中没有明显的磷光发射,但是配合物在固态下却有较强的磷光发射,这与文献[34-35]报道的现象类似,可能是聚集态引起的磷光发射(AIPE)。Ir(N4)(MDFPPM)2的固体发射光谱(25℃)和低温发射光谱(乙腈)如图4所示,配合物Ir(N4)(MDFPPM)2在低温77 K下的PL光谱的发射峰波长在449、480和513nm,CIE x,y色度坐标为(0.15,0.23)(见图5),同时测定其寿命为3.99 μs (91%)和1.52 μs(9%),可知该发射为磷光发射。室温固体PL光谱的发射峰波长在483和520nm,CIE x,y色度坐标为(0.19,0.44)(见图5),并且在长波区域出现了明显的拖尾,这可能是在固态下,配合物的分子间存在较强的相互作用引起的。另外,室温的固体PL光谱和溶液的低温PL光谱都有明显的精细结构,并且在低温77 K下的溶液PL光谱相对室温固体PL光谱的蓝移较小,说明配合物的发光具有显著的3π→π*性质。
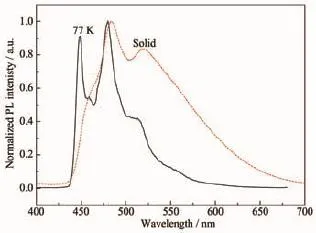
图4 Ir(N4)(MDFPPM)2的固体发射光谱和低温发射光谱(乙腈)Fig.4 Room-temperature(solid)and low-temperature (77 K,acetylene)emission spectrum of Ir(N4)(MDFPPM)2
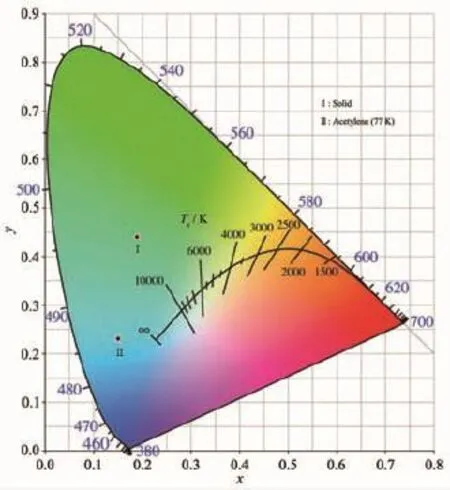
图5 Ir(N4)(MDFPPM)2的色坐标Fig.5 CIE chromaticity coordinates of Ir(N4)(MDFPPM)2
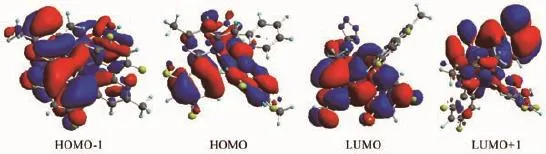
图6 配合物Ir(N4)(MDFPPM)2的选择的前线轨道三维图Fig.6 Contour plots of the selected frontier molecular orbitals of Ir(N4)(MDFPPM)2
图6 展示了Ir(N4)(MDFPPM)2的最高占据轨道(HOMO)与最低未占据轨道(LUMO)分布。由图4可知,Ir(N4)(MDFPPM)2的最高占据轨道(HOMO),其主要定域于金属Ir(III)和配体MDFPPM的苯环上,最低未占有轨道(LUMO)主要定域于配体MDFPPM的嘧啶环上。因此配合物的Ir(N4)(MDFPPM)2的发光类型除了有MLCT跃迁之外,还有配体-配体的电荷跃迁(LLCT)。Ir(N4)(MDFPPM)2的氧化过程主要是Ir的d轨道和苯环的π轨道失电子的过程,其还原过程是嘧啶环的π*轨道得电子的过程。理论计算得到的Ir(N4)(MDFPPM)2的HOMO和LUMO能级分别为-5.73和-1.87 eV,Eg为3.86 eV。
2.3 电化学特性
为了考察配合物的最高占有轨道能级(HOMO)和最低未占有空轨道能级(LUMO),室温下通过电化学工作站测得了配合物的循环伏安曲线(图7)。最低空轨道LUMO能级是由最高占据轨道分子能级和其吸收光谱的吸收带边推测出来的。在有机电化学体系当中,二茂铁作为内标时,相对于真空能级为-4.8 eV[36]。利用样品与二茂铁的相对电位,可以求得材料的HOMO和LUMO能级,计算公式如下:
EHOMO=-(Eox-E1/2,ferrocene)-4.8
Eg=ELUMO-EHOMO
从图中可以看出,Eox为1.56 V。通过公式计算出配合物的HOMO能级为-5.98 eV。接着,再由公式ELUMO=EHOMO-Eg计算LUMO能级,其中带隙值Eg= 1 240/λonset(eV)(λonset为紫外-可见吸收光谱的起峰波长)。由紫外-可见吸收光谱所得的带隙值Eg为2.76 eV,可得出其LUMO能级为-3.22 eV。配合物的电化学数据列于表3中。
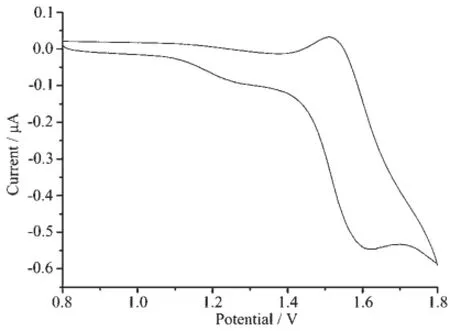
图7 Ir(N4)(MDFPPM)2在乙腈溶液中的循环伏安图Fig.7 Cyclic voltammetry curve of Ir(N4)(MDFPPM)2in CH3CN solution

表3 配合物Ir(N 4)(M DFPPM)2的电化学数据Table3 Electrochem ical data of Ir(N4)(MDFPPM)2
3 结论
本文以4,6-二甲基-2-(2,4-二氟苯基)嘧啶为主配体,5-(2-吡啶基)-1H-四唑为辅助配体,合成了一种铱配合物Ir(N4)(MDFPPM)2,利用X射线单晶衍射仪测定了该化合物的2种晶体结构,2个晶体的空间构型均为单斜,空间群均为P21/c。配合物Ir(N4) (MDFPPM)2的HOMO和LUMO能级分别为-5.98和-3.22 eV。在室温下,Ir(N4)(MDFPPM)2在溶液中没有明显的磷光发射,但是配合物在固态下却有较强的磷光发射,可能是聚集态引起的磷光发射(AIPE)。Ir(N4)(MDFPPM)2在77 K乙腈溶液中的发射峰波长在449、480和513 nm,CIE x,y色度坐标为(0.15,0.23),是一种潜在的蓝色磷光材料。
参考文献:
[1]Baldo M A,O′Brien D F,You Y,et al.Nature,1998,395 (6698):151-154
[2]Carlson B,Phelan G D,Kaminsky W,et al.J.Am.Chem. Soc.,2002,124(47):14162-14172
[3]Cheng Y M,Yeh Y S,Ho M L,et al.Inorg.Chem.,2005,44 (13):4594-4603
[4]Wu P C,Yu J K,Song Y H,et al.Organometallics,2003,22 (24):4938-4946
[5]Moussa J,Wong K M C,Chamoreau L M,et al.Dalton.Trans., 2007(32):3526-3530
[6]Kavitha J,Chang S Y,Chi Y,et al.Adv.Funct.Mater.,2005, 15(2):223-229
[7]Brooks J,Babayan Y,Lamansky S,et al.Inorg.Chem.,2002, 41(12):3055-3066
[8]W iegmann B,Jones P G,Wagenblast G,et al.Organometallics, 2012,31(15):5223-5226
[9]Chen X,Liao J L,Liang Y M,et al.J.Am.Chem.Soc., 2003,125(3):636-637
[10]Lamansky S,Djarovich P,Murphy D,et al.J.Am.Chem. Soc.,2001,123(18):4304-4312
[11]Holmes R J,Forrest S R,Tung Y J,et al.Appl.Phys.Lett., 2003,82(15):2422-2424
[12]Ragni R,Plummer E A,Brunner K,et al.J.Mater.Chem., 2006,16(12):1161-1170
[13]Lee S J,Park K M,Yang K,et al.Inorg.Chem.,2009,48(3): 1030-1037
[14]Xu M,Zhou R,Wang G,et al.Inorg.Chim.Acta,2008,361 (8):2407-2412
[15]Tokito S,Lijima T,Tsuzuki T,et al.Appl.Phys.Lett.,2003, 83:2459-2461
[16]Byun Y,Jeon W S,Lee T W,et al.Dalton Trans.,2008(35): 4732-4741
[17]Zhen Y,Eom S H,Chopra N,et al.Appl.Phys.Lett.,2008, 92(22):223301-223303
[18]Yeh S J,Wu M F,Song C T,et al.Adv.Mater.,2005,17(3): 285-289
[19]Mak C S K,Hayer A,Pascu S I,et al.Chem.Commun., 2005(7):4708-4710
[20]Laskar I R,Hsu S F,Chen T M.Polyhedron,2005,24:189-200
[21]Kim S H,Jang J,Lee S J,et al.Thin Solid Films,2008,517 (2):722-726
[22]Tamayo A B,Alleyne B D,Djurovich P I,et al.J.Am.Chem. Soc.,2003,125:7377-7387
[23]Lo S C,Shipley C P,Bera R N,et al.Chem.Mater.,2006, 18:5119-5129
[24]Chiu Y C,Hung J Y,Chi Y,et al.Adv.Mater.,2009,21(21): 2221-2225
[25]Yang C H,Li S W,Chi Y,et al.Inorg.Chem.,2005,44(22): 7770-7780
[26]Yang C H,Cheng Y M,Chi Y,et al.Angew.Chem,Int. Ed.,2007,46(14):2418-2421
[27]Tsuboyama A,Mizutani H,Okada S,et al.Eur.Patent Appl., EP1191612.2002.
[28]Ge G P,Yu X H,Guo H Q,et al.Synth.Met.,2009,159 (12):1178-1182
[29]Lohse O,Thevenin P,Waldvogel E.Synlett,1999(1):45-48
[30]Sheldrick G M.SHELXS 97,Program for X-ray Crystal Structure Solution,University of Göttingen,1997.
[31]Sheldrick G M.SHELXL 97,Program for X-ray Crystal Structure Refinement,University of Göttingen,1997.
[32]Stagni S,Colella S,Palazzi A,et al.Inorg.Chem.,2008,47 (22):10509-10521
[33]Song Y H,Yeh S J,Chen C T,et al.Adv.Funct.Mater., 2004,14:1221-1224
[34]Zhao Q,Liu S,Shi M,et al.Inorg.Chem.,2006,45:6152-6160 [35]Sprouse S,King K A,Spellane P J,et al.J.Am.Chem.Soc., 1984,106:6647-6653
[36]Zhao Q,Li L,Li F Y,et al.Chem.Commun.,2008(6):685-687
[37]Huang K W,Wu H Z,Shi M,et al.Chem.Commun.,2009 (10):1243-1245
[38]Liu Y,Liu M S,Jen A K Y.Acta Polym.,1999,50(2/3):105-108
Syntheses,Crystal Structures and Photophysical Properties of a Blue Phosphorescent IridiumPyrim idine Com p lex
GE Guo-Ping*WEI Chuan-Dong LI Chun-Yan LIANG Yun-Xiao LIANG Hong-Ze
(Faculty of Materials Science and Chemical Engineering,Ningbo University,Ningbo,Zhejiang 315211,China)
An iridiumcomplex of Ir(N4)(MDFPPM)2[MDFPPM=2-(2,4-difluorophenyl)-4,6-dimethylpyrimidine, N4=5-(2-Pridyl)-1H-tetrazole]has been prepared,and characterized by X-ray single crystal diffraction.The photophysical properties and energy-level structure of Ir(N4)(MDFPPM)2are studied by ultraviolet-visble(UV-Vis) absorption,fluorescence,cyclic voltammetry(CV),and time-dependent density functional theory(TD-DFT) calculation.X-ray diffraction studies have revealed that the complex belongs to monoclinic system with space group of P21/c.A theoretical calculation reveals that the HOMO of Ir(N4)(MDFPPM)2is mainly distributed on the iridium ion and the phenyl group of the cyclometalated ligand MDFPPM,while the LUMO is mainly centered on the pyrimidine group of the cyclometalated ligand MDFPPM.The highest occupied molecular orbital(HOMO)and the lowest unoccupied molecular orbital(LUMO)levels of Ir(N4)(MDFPPM)2are-5.98 and-3.22 eV,respectively. The complex of Ir(N4)(MDFPPM)2exhibits blue phosphorescent emission with a peak at 449,480 and 513 nm in acetonitrile solution at 77 K,and with International Commission on Illumination(CIE)coordinates of(0.15,0.23). CCDC:1043237,Ir(N4)(MDFPPM)2;1043238,Ir(N4)(MDFPPM)2·CH2Cl2.
iridiumcomplex;pyrimidine;phosphorescent material;OLED
O614.82+5
A
1001-4861(2015)04-0666-07
10.11862/CJIC.2015.104
2014-00-00。收修改稿日期:2014-00-00。
宁波市自然科学基金(No.2010A610164),宁波大学王宽诚基金资助项目。*

