水热法制备锂电池正极材料o-LiM nO2及其碳纳米管改性
刘立虎 陈述林 刘 凡 向全军 冯雄汉 邱国红
(华中农业大学资源与环境学院,武汉430070)
水热法制备锂电池正极材料o-LiM nO2及其碳纳米管改性
刘立虎 陈述林 刘 凡 向全军 冯雄汉 邱国红*
(华中农业大学资源与环境学院,武汉430070)
MnCl2、LiOH、EDTA和NaClO混合溶液一步水热反应合成锂离子电池正极材料正交LiMnO2(o-LiMnO2),进一步在反应体系中添加碳纳米管(CNTs)制备碳纳米管改性的o-LiMnO2(o-LiMnO2/CNTs复合材料)。采用X-射线衍射和扫描/透射电镜表征产物的晶体结构、微观形貌,循环伏安法和恒流充放电测试得活性材料电化学性能。结果表明,体系中nLi∶nMn控制为8∶1,在180℃反应24 h得到目标产物;反应体系中添加CNTs形成复合材料可降低o-LiMnO2颗粒粒径、提高导电率。o-LiMnO2首次放电容量为76.0 mAh·g-1,100周后容量保持为124.1 mAh·g-1;o-LiMnO2/CNTs复合材料首次及100周放电容量(基于o-LiMnO2/CNTs的质量)分别高达94.1和159.8 mAh·g-1。
锂离子电池;正极材料;正交LiMnO2;水热法;碳纳米管
锂离子电池以其高电压、高容量等优点而备受关注,在电动汽车、电子设备、军事和太空等领域有着广泛应用[1]。层状结构的正交LiMnO2和尖晶石型LiMn2O4具有资源丰富、成本低、环境友好和高倍率容量等特性,有望成为二次锂电池新一代正极材料,而前者理论容量近乎后者的2倍,且循环稳定性好而更具发展潜力。目前,制备o-LiMnO2的方法主要有高温固相法[2-5]、溶胶-凝胶法[6]、离子交换法[7]和水热法[8-10]等。上述方法多为先合成不同微结构的前驱体,如Mn2O3、MnCO3、NaMnO2和γ-MnOOH等,进一步转化生成o-LiMnO2[2-5,8-10]。Mn2O3可采用高温固相分解MnCO3或纯相二氧化锰而得到,制备过程需惰性气体保护[3,5],而多步及高温反应增加了能耗与成本。近来,采用KMnO4、MnCl2和LiOH溶液一步水热反应制备得到o-LiMnO2纳米颗粒,反应体系中nLi/ nMn高达30,锂源消耗量大[11]。以Mn2O3为前驱体的水热反应体系中添加有机溶剂延缓反应速度,可有效降低nLi/nMn而制备o-LiMnO2[12]。如能降低反应速率,则可望用低浓度LiOH一步水热反应制备o-LiMnO2,更能有效简化工序和降低生产成本。
一步水热反应难以合成o-LiMnO2,主要原因可能为其进一步氧化生成高价态锰氧化物,如Li2MnO3,因而氧化剂的选择较为重要[13]。我们前期研究发现,NaClO作为氧化剂可生成不同价态的锰(Mn(Ⅳ/Ⅲ/Ⅱ))矿物,如红磷锰矿和MnPO4·H2O[14-15];在反应体系中添加配位剂可有效降低Mn氧化速率[16]。基于此,本工作采用NaClO为氧化剂,以MnCl2和LiOH分别为二价锰源和锂源,添加乙二胺四乙酸四钠(EDTA)为配体,一步水热合成o-LiMnO2;进一步在反应体系中添加碳纳米管,形成o-LiMnO2/CNTs复合材料;对所得产物晶体结构和形貌等理化性质进行表征,并对其电化学储锂性能进行了比较。
1 实验方法
1.1 o-LiMnO2的制备
称取0.989 g MnCl2·4H2O(AR)、2.259 g EDTA (AR),溶解于一定量二次蒸馏水中;称取1.678 g LiOH·H2O(AR)溶解于7.5 mL NaClO溶液(有效氯含量不小于5.2%)。将两溶液快速混合,去离子水调节总体积为50 mL,然后转入有聚四氟乙烯内衬的高压釜中在180℃反应24 h。所得悬浊液离心分离,直至上清液电导约为20 μS·cm-1,再经无水乙醇超声分散后再次离心分离固相产物,最后60℃干燥24 h,得到o-LiMnO2。
在上述MnCl2与EDTA的混合溶液中加入0.1 g碳纳米管(管径:30~50 nm),其他条件不变,得到o-LiMnO2/CNTs复合材料。
1.2 理化性质表征
粉末X-射线衍射仪(Bruker D8 ADVANCE)分析产物晶体结构,采用Cu Kα(λ=0.154 06 nm),管压40 kV,管流40 mA,步长0.02°,扫描速度为4°·min-1。傅里叶变换红外光谱仪(FTIR,Nicolet Avatar 300)解析碳纳米管及合成产物的特征官能团。热重分析(TG,Diamond TG,PerkinElmer Instruments)测定产物碳含量,测试条件为空气氛围,升温速率为10℃· min-1。透射电镜(TEM,H-7650,Hitachi)和扫描电镜(SEM,JSM-6390/LV,日本电子)表征产物微观形貌。
1.3 电化学性能测试
经120℃热处理12 h后的活性物质、导电剂乙炔黑和PTFE乳液(60%)按质量比75∶15∶10称量,活性物质和乙炔黑研磨30 min使之充分混合均匀后转移至小烧杯中,加入PTFE乳液,用异丙醇分散,搅拌混合均匀后,擀制成厚度约0.1 mm薄膜,在110℃下真空干燥12 h后切制成0.4 cm2的圆形膜片(~3 mg),膜片压在铝网制成电池正极片。对电极与参比电极均为金属锂片。电解液为1 mol·L-1LiClO4/EC+EMC+DMC(体积比为1∶1∶1),隔膜为Celgard 2300聚丙烯微孔膜。在氩气气氛的手套箱中组装2032扣式电池,以电流密度为100 mA·g-1,电位窗口为2.4~4.3 V(vs.Li+/Li)进行恒流充放电测试(高精度电池测试仪,深圳新威尔电子有限公司)。采用电化学工作站CHI660B(上海辰华仪器有限公司)表征活性物质的循环伏安行为(扫速为0.1 mV· s-1)和反应过程交流阻抗分析。
2 结果与讨论
2.1 o-LiM nO2的制备及改性
图1所示为0.1 mol·L-1MnCl2、0.1 mol·L-1EDTA、0.8 mol·L-1LiOH和7.5 mL NaClO溶液在180℃水热反应24 h所得产物XRD图,结果表明,产物为纯相o-LiMnO2(JCPDS:86-0352)。本方法一步合成目标产物,较先前报道合成锰氧化物中间体的工艺更为简单[3-5,8-9,12]。在合成实验中,系统考察了EDTA、和温度对产物组分的影响。
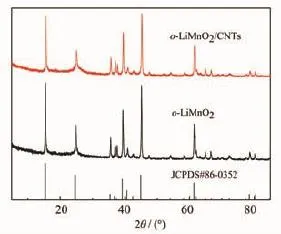
图1 o-LiMnO2和o-LiMnO2/CNTs复合材料XRD图Fig.1 XRD patterns of o-LiMnO2and o-LiMnO2/CNTs
在此反应过程中,添加剂EDTA与MnCl2先反应,形成配合态Mn2+,利于生成o-LiMnO2。为证实配位剂在反应中的作用,在水热体系中不添加EDTA,相同条件下所得产物为Mn3O4、Li2MnO3和o-LiMnO2混合物。纯相目标产物难以得到,可能是强碱溶液中形成的Mn(OH)2沉淀转化为Mn3O4,在热液条件下,在其表面生成LiMnO2和o-LiMnO2,阻碍了反应的进一步发生;而添加EDTA,可有效降低生成Mn3O4的速度,利于形成目标产物。在制备不同结晶度锰钾矿过程中,不同碳链长度的配位剂可有效调控水热反应速率[16]。降低反应温度,主要得到Li2MnO3、LiMn2O4和o-LiMnO2的混合物。前期研究结果也表明,添加剂EDTA和适当提高温度是合成o-LiMnO2关键[17]。

图2 o-LiMnO2、CNTs和o-LiMnO2/CNTs复合材料红外谱图Fig.2 FTIR patterns of CNTs,o-LiMnO2,and o-LiMnO2/CNTs composite
为证实所得产物为纯相o-LiMnO2和o-LiMnO2/ CNTs复合材料,对所得产物及商业化碳纳米管进行傅里叶变换红外光谱分析。如图2所示,吸收峰波段为3 447和1 635 cm-1分别为羟基伸缩振动和O-H面内弯曲振动吸收峰,也即商业化碳纳米管和合成的o-LiMnO2及其改性产物均存在表面吸附水。吸收峰1 405和1 042 cm-1为碳纳米管表面不同化学环境中C-O键吸收峰,与文献报道碳纳米管红外谱峰基本一致[18]。
吸收谱峰487和632 cm-1分别为o-LiMnO2晶体结构中Mn-O键非对称和对称伸缩振动吸收峰[2]。在439 cm-1处有小的吸收峰主要归属为LiO6八面体[19-20],1 507、1 436和860 cm-1处为Li2CO3吸收峰,原因可能为LiOH与CO2反应生成[21],也有可能为少量EDTA被NaClO被氧化生成CO32-。其含量低,XRD未能检测,此工作中未考虑杂相对电化学性能的影响。在o-LiMnO2/CNTs复合材料的红外谱图中,出现了商业碳纳米管和纯相o-LiMnO2特征吸收峰,进一步说明所得复合材料兼有o-LiMnO2和CNTs两相组分。
为确定电极材料o-LiMnO2/CNTs中o-LiMnO2的含量,对产物进行热重分析,如图3所示,在200~375℃区间o-LiMnO2的TG曲线上升6.7%,经计算是因为o-LiMnO2与空气中氧气反应生成Li1.6Mn1.6O4(理论上升6.3%),这与先前报道一致[22],在375~600℃时,样品失重为碳纳米管的完全氧化,由此可知,o-LiMnO2/CNTs中o-LiMnO2的含量为83.5%。
图4a、b所示为o-LiMnO2和o-LiMnO2/CNTs复合材料的扫描电镜照片,可见,o-LiMnO2的粒径分布主要为50~200 nm,o-LiMnO2/CNTs复合材料中CNTs均匀分布;从透射电镜也可以看出(图4c)o-LiMnO2与碳纳米管结合较为紧密,且颗粒粒径有减小的趋势;而仅掺混的产物碳纳米管与o-LiMnO2颗粒分布不均,且较为松散(图4d)。另外掺混的产物o-LiMnO2大颗粒粒径主要在200~400 nm范围,采用水热法制备得到碳纳米管负载的o-LiMnO2200~400 nm的大颗粒变少,100~200 nm的颗粒增多,这与XRD图谱中o-LiMnO2/CNTs较纯相o-LiMnO2衍射峰强有减弱趋势相一致。

图3 o-LiMnO2和o-LiMnO2/CNTs复合材料的热重曲线Fig.3 TG curves of o-LiMnO2and o-LiMnO2/CNTscomposite
2.2 电化学性能
图5a所示为o-LiMnO2和o-LiMnO2/CNTs复合材料的充放电循环稳定性曲线。纯相o-LiMnO2首次放电容量为76.0 mAh·g-1,循环至25周后出现最大值为139.1 mAh·g-1,而后趋于稳定,100周循环容量保持为124.1 mAh·g-1。o-LiMnO2/CNTs复合材料首次放电容量增加至94.1 mAh·g-1,循环至45周后出现最大值为181.4 mAh·g-1,100周循环容量保持为159.8 mAh·g-1。对比可见,碳纳米管改性能显著提高o-LiMnO2/CNTs放电容量,主要原因为o-LiMnO2颗粒间表面电阻降低,图5b为o-LiMnO2/CNTs的充放电的库伦效率图,第1周效率远低于100%,说明充电过程脱出的锂在放电过程中没有完全嵌入,这是o-LiMnO2由斜方结构向尖晶石结构转变,阻碍了锂离子的扩散路径所致。随着循环的进行,相变逐渐完成,锂离子的传输路径重新恢复,与之对应的比容量也逐渐增加[23],从图8中充放电后的XRD图谱也可以看出尖晶石相Li2Mn2O4的存在。

图5 o-LiMnO2、o-LiMnO2/CNTs复合材料及o-LiMnO2与CNTs混合物(o-LiMnO2+CNTs)前100次放电容量图(a)和o-LiMnO2/CNTs的库伦效率图(b)Fig.5(a)The discharge capacity of o-LiMnO2,o-LiMnO2/CNTs composite,and a mixture of o-LiMnO2and CNTs during 100 cycles,and(b)the coulombic efficiency of o-LiMnO2/CNTs composite at 100 mAh·g-1in the voltage range of 2.4~4.3 V(vs.Li+/Li)
为比较碳纳米管改性对提高o-LiMnO2电化学性能的效果及影响机制按照上述配比,称取一定量水热制备的o-LiMnO2和商业化CNTs研磨充分混合,按相同工序制成电池正极(o-LiMnO2+CNTs)并组装成模拟电池,其循环稳定性如图5a所示。研磨混有CNTs后,o-LiMnO2电化学储锂性能得以改善,首次放电容量可达93.5 mAh·g-1,40周后增加至148.9 mAhg-1,循环100周后为113.5 mAh·g-1,但从40周开始比容量逐渐降低,且降低速度较o-LiMnO2/ CNTs明显。可见,直接掺混碳纳米管虽可提高o-LiMnO2放电容量,但是循环稳定性没有水热反应直接形成的o-LiMnO2/CNTs复合材料好。
图6为o-LiMnO2和o-LiMnO2/CNTs复合材料不同周次充放电曲线。o-LiMnO2在充电过程中相变过程为:o-LiMnO2→无序化岩盐结构→尖晶石结构,o-LiMnO2自身电化学活性较差,但其发生相变后生成的岩盐结构和尖晶石结构活性较好[24]。2种材料首周充电曲线有明显差异,o-LiMnO2在3.2 V附近出现较短的充电平台,也有类似的报道[25],可能原因是此方法合成的o-LiMnO2导电性较差,首周活化过程中,相变较o-LiMnO2/CNTs慢。o-LiMnO2在4.3~3.6 V无显著放电平台,经多周活化后,在3.8 V出现新的放电平台,而主要放电平台为2.7 V左右[17]。经过CNTs改性后形成的复合材料,活化5周后,在4.1和3.95 V出现放电平台,而主要放电平台电压也增加至2.8 V。
o-LiMnO2放电总容量由两部分贡献,也即锂嵌入LiMn2O4八面体空穴(图6b中3.2~4.3 V区间)和四面体空穴的过程[26](图6b中2.4~3.2 V区间)。为进一步理解碳纳米管在o-LiMnO2充放电中的作用,将不同周次的放电容量分为两部分(表1),从表中可看出,o-LiMnO2与o-LiMnO2/CNTs在2.4~3.2 V区间放电比容量相差不大,而在3.2~4.3 V区间,o-LiMnO2/ CNTs相比o-LiMnO2比容量有明显提高,可见CNTs改性可使锂更快捷嵌入LiMn2O4的八面体空穴,提高其放电比容量。
2.3 o-LiMnO2充放电过程

图6 o-LiMnO2(a)和o-LiMnO2/CNTs(b)复合材料不同周次充放电曲线Fig.6 Charge/discharge profiles of o-LiMnO2(a)and o-LiMnO2/CNTs(b)composite at different cycles
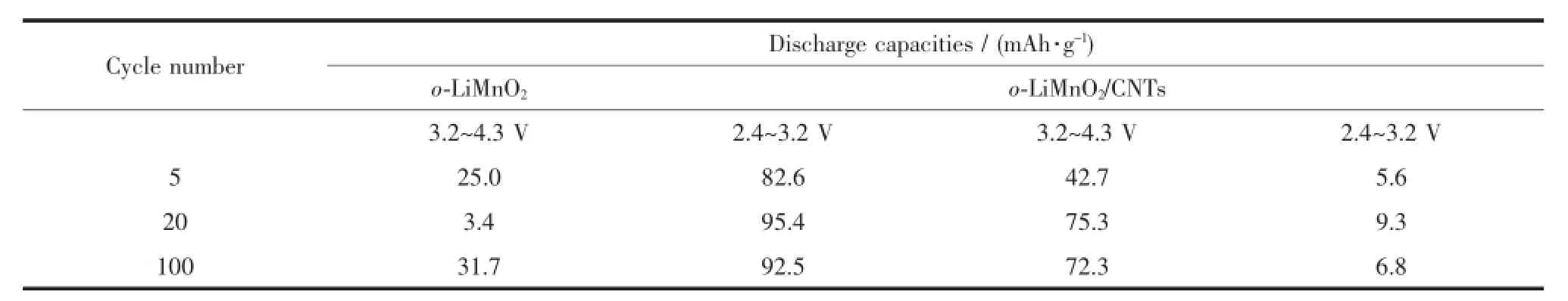
表1 不同样品在2.4~3.2 V与2.4~3.2 V区间放电比容量贡献Table1 Capacity contributions from 2.4~3.2 V and 3.2~4.3 V regions for different samp les

图7 o-LiMnO2和o-LiMnO2/CNTs复合材料循环伏安曲线Fig.7 CV curves of o-LiMnO2and o-LiMnO2/CNTs composite at scan rate of 0.1 mV·s-1

图8 o-LiMnO2电极充放电100周后产物XRD谱图Fig.8 XRD patterns of intermediate product after 100 cycles charge-discharge test of o-LiMnO2
图7 为o-LiMnO2和o-LiMnO2/CNTs复合材料的循环伏安曲线。氧化还原电流峰a/a′(3.9 V)和b/b′(4.1 V)分别为LiMn2O4⇌MnO2相互转化过程中锂离子可逆的脱出和嵌入行为,氧化还原电流峰c/c′(3.2 V/2.7 V)主要为LiMn2O4⇌Li2Mn2O4相互转化过程中锂离子的嵌入和脱出过程[27-28]。这与XRD(图8)结果一致。比较发现,o-LiMnO2/CNTs复合材料氧化电位发生负移及还原电位正移,该结果与充放电容量及平台变化规律一致,进一步说明经过碳纳米管改性后电阻降低,电化学活性增强。
图9所示为不同活性电极材料组装电池交流阻抗谱图。可见,形成o-LiMnO2/CNTs复合材料后,o-LiMnO2反应电阻由约260 Ω降低至近210 Ω。该结果进一步明确CNTs改性可降低反应电阻并提高相应电化学容量和稳定性。掺杂金属离子Co、Cr、Al可改变LiMnO2晶粒形貌和晶胞参数,进而改善放电容量和循环稳定性[29],而本实验中通过碳纳米管改性也可有效提高o-LiMnO2电化学储锂容量和循环稳定性。
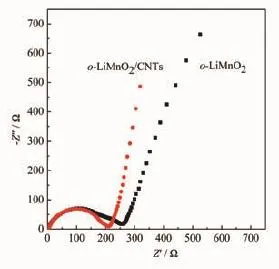
图9 o-LiMnO2和o-LiMnO2/CNTs电极材料Nyquist曲线Fig.9 Nyquist curves of o-LiMnO2and o-LiMnO2/CNTs composite
3 结论
采用水热法一步合成锂离子电池正极材料o-LiMnO2及其碳纳米管改性的o-LiMnO2/CNTs复合材料。在水热体系中nLi/nMn可降低至8∶1,经180℃反应24 h得到目标产物。反应体系中添加EDTA、提高水热温度有利于生成目标产物。充放电过程中,o-LiMnO2可转化生成m-LiMnO2、Li2Mn2O4和MnO2混合物。研磨掺混碳纳米管能提高o-LiMnO2电化学性能,而水热改性形成的o-LiMnO2/CNTs复合材料增强o-LiMnO2电导,颗粒尺寸也变小,相应充放电容量和循环稳定性增加,首次放电容量为94.1 mAh·g-1,经20周循环后趋于稳定,100周后容量保持为159.8 mAh·g-1。
[1]Armand M,Tarascon J M.Nature,2008,451(7179):652-657
[2]Liu C,Nan J M,Zuo X X,et al.Int.J.Electrochem.Sci., 2012,7(8):7152-7164
[3]FAN Guang-Xin(范广新),ZENG Yue-Wu(曾跃武),CHEN Rong-Sheng(陈荣升),et al.Chinese J.Inorg.Chem.(无机化学学报),2007,23(6):963-968
[4]LI Yi-Bing(李义兵),CHEN Bai-Zhen(陈白珍),HU Yong-Jun(胡拥军),et al.Chinese J.Inorg.Chem.(无机化学学报), 2006,22(6):983-987
[5]SU Zhi(粟智),YE Shi-Hai(叶世海),WANG Yong-Long (王永龙).Chemistry(化学通报),2009,72(11):993-997
[6]Guo Z P,Konstantinv K,Wang G X,et al.J.PowerSources,2003,119-121(1/2):221-225
[7]Bruce P G,Armstrong A R,Gitzendanner P L.J.Mater. Chem.,1999,9(1):193-198
[8]Xiao X L,Wang L,Wang D S,et al.Nano Res.,2009,2(12): 923-930
[9]Ji H M,Yang G,Miao X W,et al.Electrochim.Acta, 2010,55(9):3392-3397
[10]JIA Chun-Hui(家春晖),LU Dao-Rong(鲁道荣),HU De-Peng(胡德鹏).Metallic Funct.Mater.(金属功能材料),2012, 19(2):26-30
[11]Xie J L,Huang X,Zhu Z B,et al.Ceram.Int.,2011,37(1): 419-421
[12]He Y,Feng Q,Zhang S Q,et al.ACS Sustainable Chem. Eng.,2013,1(6):570-573
[13]Huang X K,Zhang Q S,Chang H T,et al.J.Electrochem. Soc.,2009,156(3):A162-A168
[14]Qiu G H,Gao Z Y,Yin H,et al.Solid State Sci.,2010,12 (5):808-813
[15]Yin H,Liu F,Chen X H,et al.Microporous Mesoporous Mater.,2012,153:115-123
[16]Qiu G H,Huang H,Dharmarathna S,et al.Chem.Mater., 2011,23(17):3892-3901
[17]Chen S L,Cao F F,Liu F,et al.RSC Adv.,2014,4(26): 13693-13703
[18]Stobinski L,Lesiak B,Kover L,et al.J.Alloys Compd., 2010,501(1):77-84
[19]Riley L A,Atta S V,Cavanagh A S,et al.J.Power Sources, 2011,196(6):3317-3324
[20]Chitra S,Kalyani P,Mohan T,et al.J.Electroceram., 1999,3(4):433-441
[21]Croguennec L,Deniard P,Brec R,et al.J.Mater.Chem., 1995,5(11):1919-1925
[22]WANG Lu(王禄),MA Wei(马伟),HAN Mei(韩梅),et al. Acta Chim.Sinica(化学学报),2007,65(12):1135-1139
[23]Yi J,Huang B Y,Wang H F,et al.J.Electrochem.Soc., 1999,146:3217-3223
[24]FAN Guang-Xi(范广新),ZENG Yue-Wu(曾跃武),CHEN Rong-Sheng(陈荣升),et al.Chinese J.Inorg.Chem.(无机化学学报),2008,24(6):944-949
[25]Ji H M,Yang G,Miao X W,et al.Electrochim.Acta,2010, 55:3392-3397
[26]Nagasubramanian A,Yu D Y W,Hoster H,et al.J.Solid State Electrochem.,2014,18:1915-1922
[27]Cook J B,Kim C J,Xu L P,et al.J.Electrochem.Soc., 2013,160(1):A46-A52
[28]Wu C,Wang Z X,Wu F,et al.Solid State Ionics,2001, 144(3/4):277-285
[29]CHEN Shang(陈上),WU Xian-Ming(吴显明),LIU Jian-Ben (刘建本),et al.J.Funct.Mater.(功能材料),2009,12(40): 1964-1966
Hydrothermal Preparation and Carbon Nanotube M odification of o-LiM nO2Cathode M aterials for Lithium Battery
LIU Li-Hu CHEN Shu-Lin LIU Fan XIANG Quan-Jun FENG Xiong-Han QIU Guo-Hong*
(College of Resources and Environment,Huazhong Agricultural University,Hubei Province,Wuhan,430070,China)
Rechargeable lithium battery cathode materials orthorhombic LiMnO2(o-LiMnO2)was directly synthesized using hydrothermal reaction of MnCl2,LiOH,EDTA and NaClO solutions,and carbon nanotube modified o-LiMnO2(o-LiMnO2/CNTs composite)was further obtained by adding CNTs into the reaction system.The asprepared samples were characterized by X-ray diffractometer and SEM/TEM,and their electrochemical performance was tested using constant current charge/discharge experiment and cyclic voltammetry.o-LiMnO2was formed when hydrothermal reaction was performed at 180℃for 24 h with LiOH/MnCl2molar ratio as low as 8∶1. o-LiMnO2exhibited the initial discharge capacity of 76.0 mAh·g-1,and cycling capacity of 124.1 mAh·g-1after 100 cycles.The formation of o-LiMnO2/CNTs composite decreased the particle size and electrochemical resistivity of single o-LiMnO2.The initial discharge capacity was 94.1 mAh·g-1,and increased and then kept stable after 45 cycles,and the cycling capacity was 159.8 mAh·g-1after 100 cycles.This work facilitates the preparation and electrochemical performance improvement of o-LiMnO2cathode materials for rechargeable lithium batteries.
lithium battery;cathode material;orthorhombic liMnO2;hydrothermal reaction;carbon nanotube
O611.4
A
1001-4861(2015)04-0703-07
10.11862/CJIC.2015.100
2014-09-30。收修改稿日期:2014-12-29。
国家自然科学基金(Nos.41171375、20807019)、教育部新世纪优秀人才支持计划(No.NCET-12-0862)、霍英东教育基金会高等院校青年教师基金(No.141024)、湖北省杰出青年人才基金(No.2012FFA031)和中央高校基本科研业务费专项资金(Nos.2013PY029、2011PY030)。
*通讯联系人。E-mail:qiugh@mail.hzau.edu.cn

