水溶蜂胶对人牙髓成纤维细胞的毒性作用研究*
刘颖婷,张玉皓
[云南省第一人民医院(昆明理工大学附属昆华医院)牙周种植科,云南 昆明 650032]
·论著·
水溶蜂胶对人牙髓成纤维细胞的毒性作用研究*
刘颖婷,张玉皓
[云南省第一人民医院(昆明理工大学附属昆华医院)牙周种植科,云南 昆明 650032]
目的探讨水溶性蜂胶对人牙髓成纤维细胞的毒性作用,为蜂胶的临床应用提供理论依据。方法用一种新的四唑类化合物MTS比色法检测人牙髓细胞在不同浓度的蜂胶、氢氧化钙溶液中体外培养48 h后细胞的相对增殖率(RGR),用5级毒性分类法评级。结果1 g/L及以下浓度的水溶蜂胶组对人牙髓成纤维细胞的毒性级别在2以下。结论1 g/L及以下浓度的水溶蜂胶液对人牙髓成纤维细胞的毒性作用较小,是治疗牙髓疾病的安全药物。
水溶蜂胶;人牙髓成纤维细胞;细胞毒性
蜂胶是蜜蜂采集胶源植物的芽孢渗出物中的天然树脂,混合其上颚腺的分泌物,花粉及蜂蜡形成的褐色胶状物质,是天然蜂产品之一。它含有多种生理活性物质,具有广泛的生理和药理作用,更是天然的抗生素,具有较强的抗菌性能,目前在根管消毒,牙周炎和口腔黏膜疾病的治疗领域有广泛的研究和应用。本研究采用最新的一种检测细胞毒性的四唑类化合物MTS[3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfopheny)-2H-tetrazolium,inner salt]比色方法检测国产水溶性蜂胶对人牙髓成纤维细胞的毒性作用,探讨蜂胶在牙髓治疗领域的可行性。
1 材料与方法
1.1 主要实验材料
水溶性固体蜂胶:上海辰蜂生物技术公司提供,氢氧化钙粉:上海二医张江生物材料有限公司生产。
1.2 主要试剂与仪器
DMEM细胞培养基(Hyclone)、澳洲胎牛血清(普飞)、0.5 g/L胰蛋白酶(Hyclone)和96孔细胞培养板均由诺贝生物科技有限公司提供。MTS(普洛麦格生物技术有限公司),二氧化碳培养箱(美国Therm-Fisher Forma 3111),超净工作台(SW-CJ-1D型,苏州净化设备有限公司),高速低温离心机(日本HITACHI集团CR22G),小鼠抗人波形丝蛋白单克隆抗体(福州迈新公司),小鼠抗人角蛋白单克隆抗体(福州迈新公司),酶标仪(ST360,上海科化实验系统有限公司)。
1.3 人牙髓成纤维细胞的培养及传代
牙髓标本取自昆明医学院附属口腔医院颌面外科门诊,取临床青少年因正畸减数需要拔除的健康恒前磨牙4~5颗,立即置入含有3%双抗的DMEM培养液中带回。在科室用碘酊、乙醇依次消毒牙冠,无菌高速涡轮机头除去表面牙周组织,裂钻环形切割牙颈部至近髓后立即置入培养液中带到实验室。在超净工作台内,骨凿劈开牙冠,用无菌的K锉谨慎从根管中抽出牙髓迅速剪去根尖1/3,置入浸有培养液的培养皿中,用无菌眼科剪剪成0.5 mm3组织块,然后用DMEM培养液冲洗3次,探针将组织块挑入培养瓶底部,以0.5 mm的间距均匀铺置,对侧壁滴入培养液,瓶底向上置入二氧化碳培养箱中,静置4 h贴壁后翻转,再加入适量培养液静置于培养箱中培养,组织块未游出细胞前每周换液一次,细胞游出后每3天换液一次,在倒置显微镜下观察细胞游出及生长情况,待细胞达到汇合点时,用0.5 g/L的胰酶消化,按1∶2传代,原代培养的人牙髓细胞传至第4代后,免疫组织化学染色鉴定细胞的组织来源。细胞继续传代至第5代,取生长良好的第5代牙髓细胞进行细胞接种备用。
1.4 蜂胶水溶剂的配制
取国产水溶蜂胶用三蒸水将其配成1 g/10 ml的蜂胶溶液,0.2μm的无菌过滤器滤后再用含有10%胎牛血清的DMEM培养液稀释成4、2、1、0.6和0.2 g/L 5个浓度备用。对照的氢氧化钙溶液配制:将200 mg氢氧化钙干粉剂溶于50 ml的三蒸水中,3 000 r/min条件下离心10 min,取上清液,0.2μm的无菌过滤器滤后用含有10%胎牛血清的DMEM培养液稀释成10%、8%、4%、1%4个浓度备用。
1.5 人牙髓细胞相对增殖率的测定
Cell Titer 96@A Queous One Solution Cell Proliferation Assay(a)是一种用比色法来检测细胞增殖和细胞毒实验中的活细胞数量的新的检测试剂,此试剂含有一个新型的四唑化合物MTS和一种电子偶联剂PES。PES具有增强的化学稳定性,这使它可与MTS混合形成稳定的溶液,是方便的单溶液模式。MTS被细胞生物还原成为一种有色的甲臜产物,可直接溶解于培养基中,这种转换是由代谢活跃的细胞中的脱氢酶产生的还原型烟酰胺腺嘌呤二核甘酸磷酸(NADPH)或烟酰胺腺嘌呤二核甘酸磷酸(NADH)的作用下完成的。检测时,只需将少量的Cell Titer 96@AQueous One Solution Reagent试剂直接加入培养板孔的培养基中,孵育1~4 h,然后用酶标仪读取490 nm的吸光度值,操作步骤比MTT更少,更方便快捷。在490 nm处检测到的甲臜产物的量与培养中的活细胞数成正比。
本实验采用MTS比色法,检测不同浓度的蜂胶水溶剂和氢氧化钙溶液作用于人牙髓细胞后的吸光度(OD值),计算细胞相对增殖率(relative growth rate,RGR):RGR=实验组OD值/阴性对照组OD值×100%,根据RGR换算细胞毒性的级别。
具体方法如下:取生长良好的第5代牙髓细胞,0.5 g/L胰蛋白酶消化,离心后用含有10%胎牛血清的DMEM培养液吹打成单细胞悬液,用细胞计数板调整细胞浓度至2×104/ml,接种于96孔板,每孔100μl。放置到37℃、5%二氧化碳培养箱中培养48h,倒置显微镜下观察大多数细胞贴壁并生长。弃去孔内液体及不贴壁的细胞,将各稀释药液加入96孔板中,每种加5孔,每孔100μl;阴性对照组加含有10%胎牛血清的DMEM培养液,每孔100μl。在预实验中,笔者发现蜂胶的颜色也对吸光度产生一定的影响,因此在每组蜂胶实验组的上方还设一组不含细胞的蜂胶液对比孔,在该对照孔中加对应浓度的蜂胶液100μl。用该蜂胶组的OD值减去该孔的OD值以排除蜂胶色度对实验组吸光度的影响,96孔板置37℃,体积分数5%二氧化碳条件下培养48 h后,每孔加入20μl配好的MTS试剂,再放回培养箱中放置4 h取出,在酶标仪上振荡30 s,于490 mm波长下测OD值,每种浓度孔的OD值取平均值。计算细胞RGR,根据细胞毒性评级标准(见表1),用RGR值换算细胞毒性级。

表1 细胞毒性评级标准
1.6 统计学方法
采用SPSS 11.0统计软件进行数据分析,对实验结果组间进行方差分析,对蜂胶与氢氧化钙总体细胞毒性进行两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞的培养和形态学观察
本研究用传统的组织块培养法,12~15 d内可见有的组织块周边有少量梭形细胞长出,2~3 d后细胞迅速扩增,约18~20 d左右细胞长满瓶底。按1∶2传代,2~3 d可传一代。原代及传代培养的细胞胞体呈长梭形,星形胞体细长,胞浆丰富,核位于中央,排列紧密多呈近于平行的束状,细胞界限清楚,呈“漩涡状”。见图1。
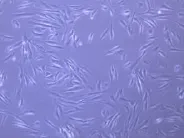
图1 牙髓成纤维细胞图(×200)
2.2 细胞来源鉴定
取第4代对数生长期人牙髓细胞爬片,按试剂盒说明书进行波形丝蛋白,角蛋白免疫组织化学染色,光镜下观察。牙髓成纤维细胞呈典型的成纤维样细胞,细胞浆内波形丝蛋白染色为阳性,角蛋白染色呈阴性。波形丝蛋白是成纤维细胞的特征性蛋白,而角蛋白是上皮细胞的特征性蛋白,因此证实培养的是中胚层来源的人牙髓成纤维细胞。见图2、3。
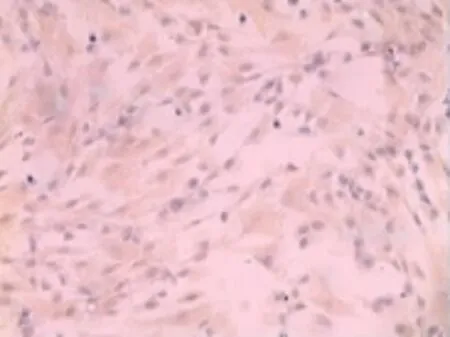
图2 波形丝蛋白染色阳性(×100)
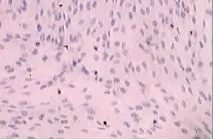
图3 角蛋白染色阴性(×100)
2.3 细胞相对增殖率结果及毒性分级
第5代人牙髓成纤维细胞以2×104/ml,接种于96孔板,培养48 h后,各孔细胞密度均匀。细胞贴壁生长,形态正常,胞体呈长梭形。加样48 h后,阴性对照组细胞密度增加,形态正常;加药物的实验组和对照组,低浓度的各孔中细胞形态基本正常,随着浓度的增加,培养孔中出现变性死亡细胞,部分细胞漂浮起来。各孔加入MTS试剂后,放回培养箱中孵育4 h,取出后用酶标仪测定各孔的吸光度。不同浓度蜂胶水溶液与氢氧化钙溶液对人牙髓成纤维细胞作用48 h后的吸光度值、换算的细胞相对增殖率及毒性级别如下,见表2。
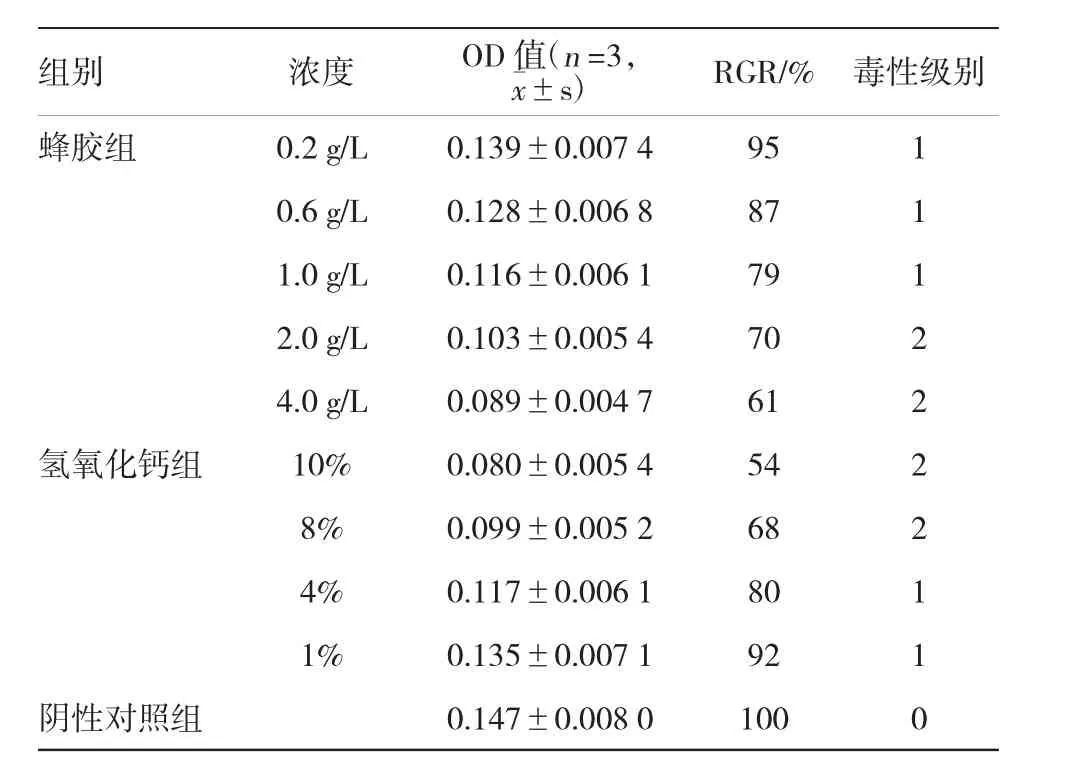
表2 蜂胶和氢氧化钙溶液对人牙髓成纤维细胞作用48 h后的OD值及毒性级别结果
对蜂胶组各浓度OD值进行方差分析,F=30.618,P<0.05,差异有统计学意义,认为不同浓度下的蜂胶OD值不同。对氢氧化钙组各浓度OD值进行方差分析,F=44.275,P<0.05,差异有统计学意义,认为不同浓度下的氢氧化钙OD值不同。对蜂胶和氢氧化钙总体细胞毒性进行两独立样本t检验,t=0.882,P<0.386,差异无统计学意义,表明蜂胶和氢氧化钙总体细胞毒性无差异。
3 讨论
由于牙髓组织具有形成牙本质和营养硬组织的功能,对外来刺激能产生一系列防御性反应,因此保存活髓具有十分重要的意义。理想的盖髓材料要有良好的封闭性,能有效地隔绝外界刺激,杀灭细菌,消除牙髓炎症,保护牙髓。诱导牙髓细胞分化成成牙本质细胞形成修复性牙本质桥,并能提供牙髓修复,牙本质生物矿化所需要的微量元素及适宜的微环境[1]。
氢氧化钙是目前应用最广泛的盖髓材料,它能有效地促进牙髓细胞分化,形成修复性牙本质封闭露髓孔,并且其强碱性也具有一定的抑菌和杀菌作用。但临床应用也发现它有明显的缺陷,例如它会引起接触部位牙髓炎症坏死;会发生牙髓退行性改变,出现根管内营养不良性钙化,钙化蔓延到整个根管,出现堵塞或牙内吸收等[2]。为进一步改善性能,有研究试图用氢氧化钙复合其他材料或激光处理的方法提高治疗效果[3-4]。也有学者在探索新的盖髓材料,目前有矿化三氧化物凝聚体(MTA);牙本质粘接剂;磷酸钙类材料(羟基磷灰石、磷酸钙骨水泥,陶瓷化骨粉等);生物活性材料(骨形成蛋白、表皮生长因子、牙本质胶原蛋白、富血小板血浆等);抑菌类材料(各类抗生素);中药类(黄芩苷等)[5-11]。但各种材料各有优缺点:如磷酸钙类材料无抗菌性;生物活性材料易被破坏;粘接剂密封性好,但有刺激性等等,单一的材料均不能达到理想的盖髓材料应具备的性能。进一步探索具有生物诱导活性,良好的生物相容性,消炎杀菌及物理机械性能都良好的复合盖髓材料,提高活髓保存的成功率是该领域的研究方向。由于盖髓治疗常因微渗漏或牙本质深层藏存的细菌感染而失败,因此盖髓剂能否杀灭露髓孔内残余细菌,消除牙髓炎症有重要的意义。因此有研究者试图复合几种材料的性能,如束红蕾[12]等把甲硝唑,红霉素,克林霉素加入到磷酸钙骨水泥,陶瓷化骨粉中用于实验动物的盖髓,实验研究也取得了较好的效果。
近年来,人们越来越热衷于绿色天然药物的开发和应用,蜂胶含有多种生理活性物质,具有广泛的生理和药理作用,临床上多用于治疗溃疡、烧伤、糖尿病及心血管病等[13]。最重要的是蜂胶的强抗菌功能是其他天然物质无可比拟的,由于蜂胶含有大量的黄酮类及芳香酸、脂肪酸及烯类等多种化合物,它具有广谱抗菌作用,能抑制多种细菌和病毒,有研究证实1%~10%的蜂胶对真菌和霉菌都有抑制作用[14]。在口腔领域关于蜂胶的研究也很广泛,国内已有研究表明,蜂胶的生物安全性很好[15]。蜂胶对龋病、牙周病和感染根管的致病菌有明显的杀灭及抑制作用,已有研究将其引入龋病、牙周病及感染根管消毒治疗领域[16-17]。国外有研究还发现,蜂胶能有效杀灭对氢氧化钙消毒耐受的细菌,能有效杀灭难治性根尖周炎根管内的粪肠球菌[18-19]。蜂胶的消炎镇痛、表面麻醉、促进增生、改善微循环的作用使其对复发性口疮、扁平苔藓等口腔黏膜病也有较好的疗效[20],已有蜂胶的牙膏,漱口水、口腔溃疡贴膜生产用于口腔临床。对于牙髓治疗领域,由于蜂胶含醛,有凝固蛋白的作用,国内有学者报道用蜂胶复合普鲁卡因等制成的复方蜂胶失和剂可以失和牙髓[21]。国外学者研究报道,较低浓度的蜂胶醇溶剂在保持有效的杀菌效力的同时对人牙髓、牙周及牙龈成纤维细胞的细胞毒性远低于氢氧化钙,生物安全性好,用于盖髓治疗能诱导修复性牙本质形成[22-24],但尚无进一步深入的研究报道。国内目前尚无水溶蜂胶对人牙髓细胞的细胞毒性及蜂胶用于盖髓治疗的实验报告。
为进一步明确蜂胶在盖髓治疗中的性能,研究能否利用蜂胶的天然强抗菌性,丰富的物质含量和改善微循环、促进增生等多种生物活性消除暴露牙髓的炎症,从而诱导牙髓—牙本质复合体反应形成修复性牙本质,笔者采用国产水溶蜂胶做人牙髓细胞的细胞毒性实验。由于以前多数研究为蜂胶乙醇提取液,对蜂胶水提取液的研究非常少。在本实验中,为降低对牙髓的刺激,并填补蜂胶水溶剂用于盖髓治疗的研究空白,采用国产水溶蜂胶制备不同浓度的蜂胶水溶剂。采用体外细胞培养技术培养人牙髓细胞,用MTS比色法检测不同浓度的蜂胶水溶剂作用于人牙髓细胞后的OD值。计算细胞RGR,根据RGR换算细胞毒性的级别。观察不同浓度的蜂胶水溶剂对人牙髓细胞增殖的影响,并对其细胞毒性进行评级。
实验结果表明,水溶蜂胶及氢氧化钙对人牙髓细胞的细胞毒性各浓度组间差异有统计学意义(P<0.05);对蜂胶与氢氧化钙总体细胞毒性进行两独立样本t检验,差异无统计学意义(P>0.05),表明蜂胶和氢氧化钙总体细胞毒性无差异。1 g/L及以下国产水溶蜂胶溶液对人牙髓细胞的毒性在2以下,具有低毒性,可考虑用于临床治疗。
[1]孙皎,吴婕.盖髓材料[J].中国实用口腔科杂志,2010,3(8):451-454.
[2]ESTRELA C,HOLLAND R.Calcium hydride study based on scientific evidences[J].J Appl Oral Sci,2003,11(4):269-282.
[3]FERRIELLO V,FARIA MR,CAVALCANTI BN.The effects of low-level diode laser treatment and dental pulp-capping material on the proliferation of L-929 fibroblasts[J].J Oral Sci,2010,52 (1):33-38.
[4]李梅,张开宣.ND:YAG激光在直接盖髓术中的应用[J].口腔医学纵横杂志,2000,16(4):282-284.
[5]CAMILLERI J.Characterization of hydration products of mineral trioxide aggregate[J].Int Gndod J,2008,41(5):408-417.
[6]DA SLILVA LA,DE FREITAS AC,DE CARVALHO FK,et al. Directpulpcappingwithaselfetchingadhesivesystem: histopathologic evaluation in dog's teeth[J].Oral Surg Oral Med Oral pathol Oral Radiol Endod,2009,108(1):34-40.
[7]苏勤,叶玲,周学东.纳米羟基磷灰石/聚酰胺66盖髓的动物实验研究[J].四川大学学报(医学版),2005,36(1):43-45.
[8]YASUDA Y,OGAWA M,ARAKAWA T,et al.The formation of tertiary dentin after pulp capping with a calcium phosphate cement loaded with PLGA microparticles containing TGF-betal[J].J Endod,2008,34(9):1057-1060.
[9]陆玉,刘天佳,皮根莉,等.可乐丽菲露SE BOND用于直接盖髓术的组织学评价[J].实用口腔医学研究,2005,21(4):504-506.
[10]李威,卢友光,苏柏华,等.富血小板血浆复合MTA盖髓的组织学观察[J].口腔医学研究,2006,22(5):478-481.
[11]李俊,李政权,高原.牙本质非胶原蛋白诱导牙髓—牙本质复合体反应的动物实验观察[J].口腔医学研究,2009,25(4):439-441.
[12]束红蕾,蔡传啟,吴东,等.磷酸钙骨水泥复合盖髓剂用于活髓保存的临床研究[J].口腔医学纵横,2001,17(1):54-56.
[13]郭伽,周立东.蜂胶化学研究进展[J].中国养蜂,2000,51(2):17.
[14]关玉.蜂胶的药理实验与临床应用[J].中国实用医药,2009,4(28): 125-126.
[15]马丁,和红兵,吴恩格.蜂胶的生物安全性评价[J].实用口腔医学杂志,2007,23(1):71-74.
[16]GEBARA EC,PUSTIGLION AN,DE LIMA LA,et al.Propolis extract as an adjuvant to periodontal treatment[J].Oral Health Prev Dent,2003,1(1):29-35.
[17]储雯,税艳青,雷雅燕.蜂胶在口腔临床中的应用进展[J].中国实用口腔科杂志,2008,1(10):625-633.
[18]SANTOS FA,BASTOS EM,UZEDA M,et al.Antibacterial activity of Brazilian propolis and fractions agaist oral anaerobic bacterial[J].Journal of Ethnopharmacology,2002,80(2002):1-7.
[19]ONCAG O,COGULU D,UZEL A,et al.Efficacy of propolis as an intercanal medicament against Entercocus faecalis[J].Gen-Dent,2006,54:319-322.
[20]姚嫣,王玲.蜂胶酊治疗复发性口腔溃疡31例[J].河南医科大学学报,2003,24(1):16.
[21]朱国光.蜂胶制剂失和牙髓效果观察[J].口腔材料器械杂志,1998, 7(2):83-84.
[22]AL-SHAHER A,WALLACE J,AGARWAL S,et al.Effect of propolis on human fibroblasts from the pulp and periodontal ligament[J].J Endod,2004,30(5):359-340.
[23]SULE S,LEVENT K,MINE Y,et al.The effect of bee propolis on oral pathogens and human gingival fibroblast[J].Journal of Ethnopharmacology,2005,102:371-376.
[24]PAROLIA A,KUNDABALA M,RAO NN,et al.A comparative histological analysis of human pulp following direct pulp capping with propolis,mineral trioxide aggregate and dycal[J].Aust Dent J,2010,55(1):59-64.
(张蕾 编辑)
Evaluation on cytotoxicity of water-solubile propolis to human dental pulp fibroblasts*
Ying-ting LIU,Yu-hao ZHANG
[Departmenent of Periodontology and Implant Dentistry,the First People's Hospital of Yunnan Province(Kunhua Hospital Affiliated to Kunming University of Sicence and Technology),Kunming,Yunan 650032,P.R.China)
【Objective】To evaluate the cytotoxicity of water-solubile propolis to human dental pulp fibroblasts and provide information for local application of propolis to dental diseases.【Methods】Human dental pulp fibroblasts were incubated in propolis and calcium hydroxide solution at different concentrations for 48 hours.The relative growth rate(RGR)was examined by a new method of MTS assay and cytotoxicity was classified by the five-class method.【Results】The cytotoxicity of 1 g/L and lower-concentration water-solubile propolis solution to human dental pulp fibroblasts was below the second class.【Conclusion】Water-solubile propolis solution at 1 g/L and lower concentration has weak cytotoxicity for human dental pulp fibroblasts and it is safe for local application to dental pulp diseases.
water-solubile propolis;human dental pulp fibroblast;cytotoxicity
R781.3
A
1005-8982(2015)30-0018-05
2015-03-03
云南省科技厅应用基础研究项目(No:2011FZ277)

