CDH17表达及其SNPs在胃癌发生发展中的意义
潘地铃张声王行富陈余朋任彩虹陈祥娜
CDH17表达及其SNPs在胃癌发生发展中的意义
潘地铃①②张声①王行富①陈余朋①任彩虹①陈祥娜①
摘要目的:探讨CDH17表达与胃癌临床病理学特征的关系及其SNPs与胃癌遗传易感性的关系。方法:制作模拟胃癌侵袭转移动态的组织芯片,免疫组织化学SP法检测CDH17蛋白的表达,PCR-LDR技术检测CDH17基因2个SNPs位点rs2514813 和rs3214050的多态性并行测序验证。结果:胃癌CDH17表达上调与组织学分化程度呈正相关(P<0.01);肠型胃癌表达高于弥漫型胃癌;随着侵袭过程的进展,黏膜层、肿瘤中央区、侵袭前沿区胃癌的CDH17表达水平呈下降趋势;CDH17表达与胃癌术后生存时间未见明显相关(P=0.209)。胃癌CDH17基因SNP位点rs3214050等位基因C、T频率及CC、CT和TT的基因型频率与对照组相比差异有统计学意义(P<0.01),携带等位基因T的胃癌患者术后生存时间长于CC基因型(P<0.01)。rs2514813位点基因型与等位基因频率与对照组相比无显著性差异(P>0.05)。结论:CDH17表达升高与胃癌腺样结构的维持及进展相关,rs3214050位点为T等位基因者患胃癌风险低且预后好,提示该位点与中国福建汉族人群胃癌的遗传易感性及预后有关。
关键词钙黏连蛋白-17胃癌侵袭转移免疫组织化学单核苷酸多态性
细胞间黏附能力的改变及细胞运动能力的失调是肿瘤侵袭转移的重要机制之一。钙黏连蛋白家族成员CDH17(cadherin-17)是一类钙离子依赖介导细胞间黏附作用的糖蛋白,通过激活NF-κB信号通路,调控Wnt/β-catenin信号途径,调节整合素蛋白活性及激活Ras/Raf/MEK/ERK信号通路,参与肿瘤的进展[1-3]。研究发现CDH17在胃癌、肝癌、结肠癌及胰腺癌等过表达[4],但与肿瘤侵袭转移的关系尚不清楚,其SNPs与胃癌遗传易感性的关系鲜见报道。本研究通过构建模拟胃癌侵袭转移动态过程的组织芯片,应用免疫组织化学染色检测CDH17蛋白的表达水平,探讨其表达变化与胃癌侵袭转移及预后的关系,应用PCR-LDR方法检测CDH17基因SNPs基因型和等位基因频率,探讨其SNPs与胃癌遗传易感性的关系。
1 材料与方法
1.1材料
1.1.1蛋白表达的研究对象收集福建医科大学第一临床医学院病理科2001年1月至2010年12月手术切除的胃癌标本存档蜡块370例,其中男性270例,女性100例;年龄24~86岁,平均年龄(59.79± 11.78)岁,所有患者均为福建籍汉族人,随访资料完整,生存时间0~109个月。根据2010年WHO《消化系统肿瘤分类》标准分类。SNPs研究对象:胃癌组404例,其中男性305例,女性99例;年龄24~88岁,平均年龄(60.86±10.63)岁;病理诊断明确,术前未行放疗和(或)化疗。对照组467例,均为福建医科大学附属第一医院健康体检人群,其中男性269例,女性198例;年龄16~87岁,平均年龄(49.66±14.72)岁,体检结果健康,无肿瘤及遗传性疾病。两组人群均为福建省境内的福建籍汉族人。本研究经福建医科大学第一临床医学院医学伦理委员会审查批准。
1.1.2组织芯片的制备构建模拟胃癌侵袭转移动态过程的组织芯片:癌旁正常胃黏膜、黏膜层癌组织、肿瘤中央区癌组织(即黏膜层与侵袭前沿中央的胃癌组织)、侵袭前沿区癌组织(即肿瘤纵向侵袭胃壁最远处)及淋巴结转移灶。
1.1.3 SNP标本采集与保存方法对照组健康体检者外周静脉血1 mL于含EDTA的3 mL抗凝管内,迅速置入-20℃冰箱保存以备提取基因组DNA[5]。胃癌组样本为石蜡包埋组织,选取正常胃黏膜组织,每例切10 μm薄片3枚置入Eppendorf管中以提取基因组DNA[6]。
1.1.4 DNA提取及PCR-LDR主要试剂总DNA抽提试剂盒TaKaRa Dexpattm试剂(日本TaKaRa公司),AxyPrep-96全血基因组DNA试剂盒(美国AXYGEN公司),HotStar Taq DNA Polymerase(德国QIAGEN生物技术有限公司)。
1.1.5引物及探针合成选择2个CDH17频率最高的SNP位点rs2514813及rs3214050,Primer 3.0在线设计引物,根据碱基互补配对原则设计每个SNP位点相对应的特异性探针。rs2514813位点引物的上游序列5'-TCCCATGTCCTTCACTGAGA-3'和下游序列5'-GGGAGCCATCTCTCTTACCC-3',产生的PCR产物含199 bp,LDR反应探针rs2514813_modify(47 bp),rs2514813_C(47bp),rs2514813_T(49bp)。rs3214050位点引物的上游序列5'-TGGTTGGTTTGGGTTTCAAT-3'和下游序列5'-AGAGAGATGGCTCCCGTTTT-3',产生的PCR产物含212 bp,LDR反应探针rs3214050_modify (49 bp),rs3214050_C(49 bp),rs3214050_T(51 bp)。
1.2方法
1.2.1免疫组织化学染色羊抗人LI-cadherin多克隆抗体(稀释度1∶50)购自美国SantaCruz公司,链霉素抗生物素蛋白-过氧化物酶(SP)免疫组织化学染色超敏试剂盒购自福州迈新生物技术有限公司。操作严格按照说明书进行。用正常小肠黏膜组织切片作阳性对照,用PBS代替一抗作阴性对照。
1.2.2免疫组织化学染色结果判定标准CDH17阳性定位于细胞膜,呈棕黄色。观察每个点阵的全部腺上皮的染色情况(×400),根据胃黏膜上皮或肿瘤细胞膜的染色程度以及染色细胞百分比进行分析评分,以阳性对照片的表达程度作为判定标准。将染色程度分为4级:基本不着色为0分,淡棕黄色为1分,棕黄色为2分,深棕黄色为3分;着色细胞占计数细胞百分率≤5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分。将芯片每个点阵组织的染色程度与染色细胞百分率得分乘积得分:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++)。其中CDH17(-)与(+)为低表达,CDH17(++)与(+++)为高表达。
1.2.3 DNA提取及PCR-LDR石蜡包埋组织基因组DNA提取和对照组全血基因组DNA的抽提按Dexpattm试剂盒说明进行。0.8%琼脂糖凝胶电泳检测基因组DNA多重PCR反应产物的完整性。PCR扩增SNP位点所在片段:95℃15 min、94℃30 s、59℃1 min、72℃1 min、72℃7 min,35个循环,3.0%琼脂糖凝胶,0.5×TBE电泳分析。
1.2.4 PCR产物的连接酶检测反应(LDR)取1 μL LDR连接产物与1 μL ABI GS-500 ROX荧光标记分子和去离子甲酰胺上样液混合,95℃加热变性2 min,冰中骤冷,于5%聚丙烯酰胺和5 mol/L尿素中3 000 V电泳2.5 h,应用GeneScanTM672软件进行数据收集、泳道线校正、迁移片段大小测量和校正内在分子量标准;应用Genemapper v3.0软件进行数据分析和基因分型。测序仪测序检验PCR-LDR的实验结果。
1.3统计学处理
应用SPSS 19.0统计学软件及SHEsis软件对检测结果进行统计学分析。Pearson和Fisher检验比较不同基因型及基因频率在胃癌组和对照组的频率分布。Kaplan-Meier法及Log-rank检验分析基因多态性与胃癌患者术后生存时间的关系,以优势比OR(odds ratio)和95%可信区间表示相对危险度。以α=0.05为检验显著性水准,P<0.05为差异有统计学意义。
2 结果
2.1 CDH17蛋白在胃癌组织中表达
CDH17阳性染色定位于细胞膜,正常胃黏膜腺上皮一般不表达或仅少数腺上皮细胞膜染色(图1),胃癌细胞CDH17阳性表达率52.7%(195/370)明显高于正常胃黏膜的8.4%(31/370)(P<0.01,表1);370例胃癌CDH17表达水平与组织学分化程度呈正相关并随着组织学分化程度的降低,表达水平呈下降趋势(P<0.01);肠型胃癌和混合型胃癌阳性表达率62.1% (157/253)明显高于弥漫型胃癌32.5%(38/117)。CDH17表达水平与患者的性别、年龄、部位、浸润深度未见明显相关(P>0.05,表1)。
2.2 CDH17蛋白在胃癌侵袭过程中表达219例进展期胃癌中,黏膜层、肿瘤中央区、侵袭前沿区癌细胞CDH17蛋白的表达伴随侵袭的进展逐渐降低,当转移至淋巴结时表达回升,高于侵袭前沿(P<0.01,表2)。Log-rank检验未见CDH17蛋白表达与术后生存时间存在相关性(P>0.05,图2)。
2.3 CDH17基因SNPs位点rs2514813和rs3214050基因型和等位基因频率的分布及与胃癌易感性的关系中国福建汉族人群CDH17两个SNPs位点等位基因和基因型频率的分布见表3。表4提示467例对照组CDH17 SNP位点rs3214050等位基因C、T的频率分别为73.3%和26.7%,404例胃癌组等位基因C、T的频率为67.7%和32.3%,有显著性差异(P<0.01),胃癌组等位基因T的频率分布明显高于对照组,将具有稀有等位基因T视为暴露因素,则携带等位基因T的个体胃癌患病风险降低(OR=0.762,95%CI:0.619~0.937)。
对照组CC、CT和TT基因型频率分别为54.0%、38.8%和7.2%,胃癌组为47.1%、41.3%和11.6%,结果显示胃癌组CT和TT基因型分布频率上升,CC基因型下降(P<0.01)。提示rs3214050位点CT和TT基因型个体胃癌的患病风险下降。
Kaplan-Meier生存曲线显示rs3214050位点不同基因型胃癌患者生存率存在明显差异,CT和TT基因型个体胃癌的生存率明显高于CC基因型胃癌患者(P=0.008,图3)。
CDH17基因rs2514813位点基因型与等位基因频率在胃癌组与对照组间差异无统计学意义(P>0.05),提示rs2514813位点的SNPs与胃癌易感性无关,位点rs2514813不同基因型间胃癌患者生存时间的差异无统计学意义。
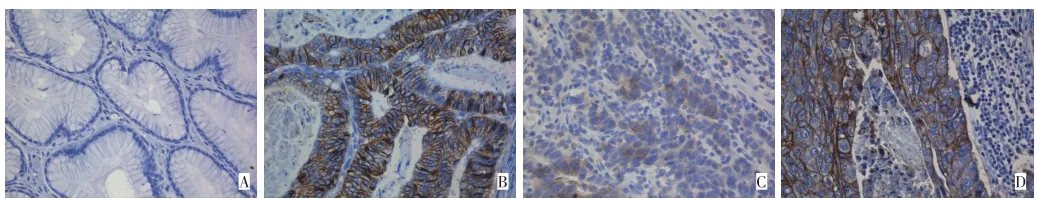
图1正常胃黏膜及胃癌组织CDH17表达(SP×400)Figure 1 CDH17 expression in normal mucosa and gastric cacinoma(SP×400)
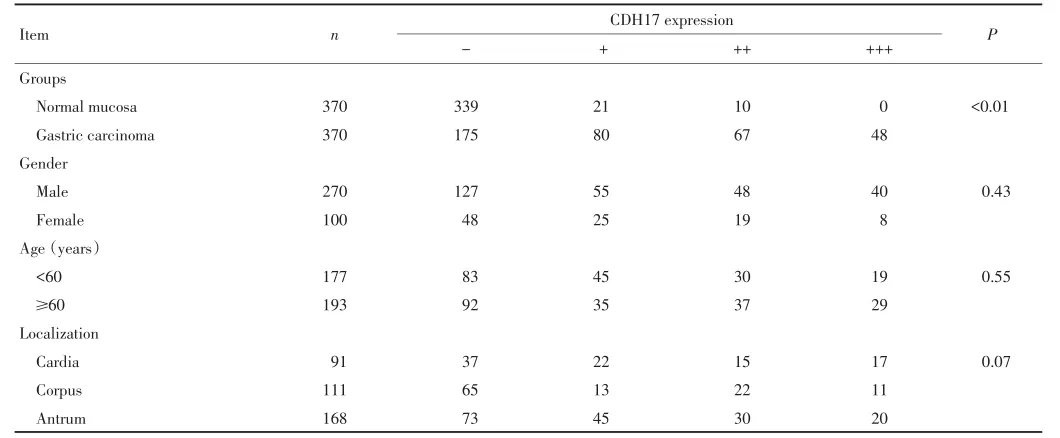
表1胃癌正常胃黏膜与黏膜层CDH17的表达Table 1 Expression of CDH17 in normal mucosa and gastric carcinoma
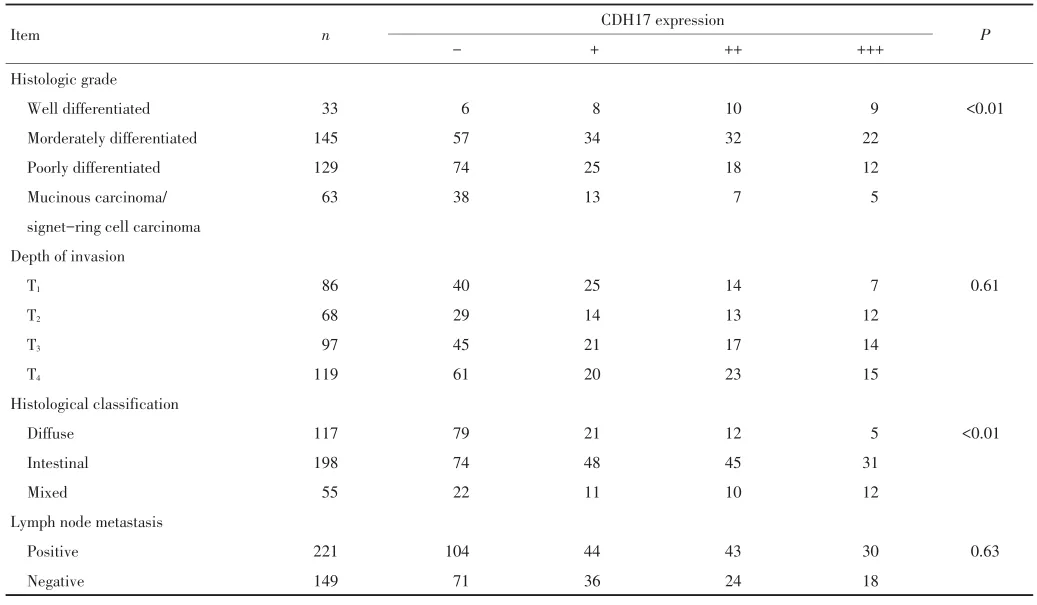
表1胃癌正常胃黏膜与黏膜层CDH17的表达(续表1)Table 1 Expression of CDH17 in normal mucosa and gastric carcinoma(continued)

表2胃癌侵袭转移过程中CDH17蛋白表达变化Table 2 Expression of CDH17 in four sites of advanced gastric carcinoma
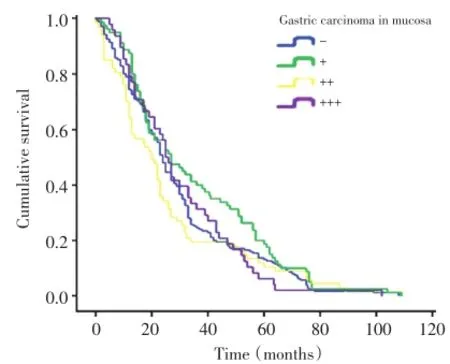
▶图2胃癌黏膜层组织CDH17表达分级与生存时间的关系Figure 2 Relationship of CDH17 expression in gastric carcinoma in mucosa with the surviv⁃al of gastric carcinoma patients
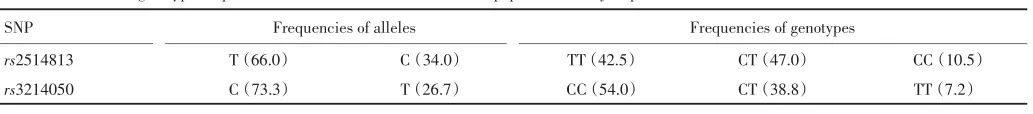
表3中国福建汉族人群CDH17两个SNPs位点等位基因和基因型频率的分布(%)Table 3 Allele and genotype frequencies of CDH17 two SNPs loci in Han population of Fujian province,China(%)

表4 CDH17基因rs3214050位点等位基因和基因型频率在胃癌组及对照组的分布(%)Table 4 Allele and genotype frequencies of CDH17 SNP rs3214050 locus in gastric carcinoma and the control groups(%)
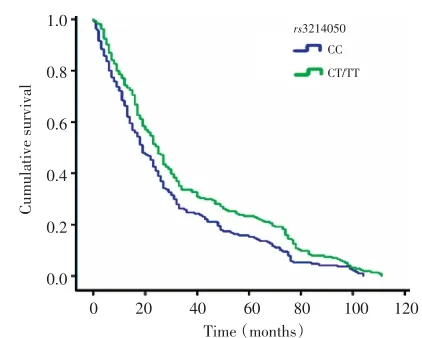
▶图3 rs3214050基因型与胃癌患者术后生存时间的关系Figure 3 Relationship of the rs3214050 genotype in gastric carcinoma with the survival of gastric carcinoma patients
3 讨论
CDH17是钙黏连蛋白超家族成员,隶属于7D-钙黏连蛋白家族,其结构由7个钙黏蛋白胞外重复序列和1个仅包含20个氨基酸残基的较短的胞质尾区组成[7]。正常情况下CDH17仅表达于小鼠的肝脏和大、小肠腺上皮细胞(故又称为肝肠钙黏连蛋白),人类胚胎发育期可表达于肝脏和胃肠道,健康成人肝脏和胃组织停止表达[8]。有关CDH17的研究主要见于消化道上皮性肿瘤如胃癌、肝癌、结肠癌、胰腺癌等[4]。本研究显示胃癌组织CDH17表达明显高于正常胃黏膜组织,肠型和混合型胃癌表达明显高于弥漫型胃癌,其表达水平随着组织学分化程度的降低而降低,并首次发现CDH17 6号外显子SNP位点rs3214050多态性与胃癌易感性及预后有关。
3.1 CDH17蛋白表达与胃癌生物学行为的关系
本研究通过构建模拟胃癌侵袭转移动态过程的组织芯片,免疫组织化学染色检测CDH17蛋白表达水平,显示胃癌组织CDH17表达明显高于正常胃黏膜组织,肠型和混合型胃癌表达明显高于弥漫型胃癌,其表达水平随着组织学分化程度的降低而降低,提示CDH17的表达与胃癌腺样结构的维持有关。Motoshita等[9]证实肠型胃癌CDH17过表达高于弥漫型。Sakamoto等[10]发现上皮细胞生长因子受体(epi⁃dermal growth factor receptor,EGFR)激活能诱导CDH17在胃癌中表达上调,并参与胃癌肠型的分化。本研究结果显示高分化腺癌、中分化腺癌、低分化腺癌-未分化癌以及黏液腺癌/印戒细胞癌四组的CDH17蛋白在黏膜层胃癌组织的表达呈下降趋势,有显著性差异。CDH17基因编码的蛋白属于7D-钙黏连蛋白家族,是一类钙离子依赖性介导同源细胞间连接的多基因超家族,研究显示CDH17发挥黏附作用可能与细胞支架直接连接固定有关[11]。CDH17蛋白表达降低,细胞间的连接结构受到破坏,癌细胞间失黏附,胃癌腺样结构丧失,表现为胃癌的分化程度降低,即CDH17在恶性程度高的细胞中低表达。Ito等[12]也发现高分化胃癌CDH17高表达。Liu等[13]应用重组慢病毒标记CDH17的体内外实验研究发现CDH17表达下调抑制低分化胃癌细胞株BGC823癌细胞的增殖、黏附及侵袭,并阻滞细胞周期进程,同时下调胃癌相关致癌因子基质金属蛋白酶MMP-2及MMP-9的活性,推测CDH17可能参与调控胃癌细胞的增殖、分化和侵袭。
本研究发现伴随胃癌侵袭的进展,CDH17表达明显降低,推测表达降低也可能通过上皮-间质转化(epithelial-mesenchymal transitions,EMT)机制导致胃癌细胞间的黏附性下降,促进侵袭的进展;而当胃癌转移至淋巴结时,CDH17表达回升,明显高于侵袭前沿区,提示CDH17表达升高可能参与胃癌淋巴结转移过程中MET的发生。Pitts等[14]通过评估结肠癌CRC细胞株暴露于PAK抑制剂PF-03758309的敏感性实验,发现维持上皮表型的基因CDH17上调抑制癌细胞对PF-03758309的敏感性,可能与EMT机制有关。Wang等[2]应用RNA干扰技术抑制CDH17在MKN-45胃癌细胞株中表达,可抑制癌细胞扩散、黏附、侵袭,阻滞细胞周期进程,灭活NF-κB信号通路,伴随VEGF-C 和MMP-9表达减少,抑制胃癌的生长与转移,并证实CDH17表达与胃癌淋巴结转移呈正相关。Qiu等[3]应用体内外实验发现抑制胃癌CDH17表达,可导致Wnt/ β-catenin信号通路失活,细胞周期G0/G1期阻滞,抑制胃癌侵袭转移的进展,同时通过多变量分析认为CDH17表达升高的胃癌患者预后差于CDH17阴性表达者。Lee等[15]认为CDH17可以直接作为早期胃癌或无淋巴结转移患者的独立预后指标。本研究未发现CDH17表达与胃癌患者术后生存时间存在相关性。
3.2 CDH17基因SNPs与胃癌遗传易感性的关系
人类CDH17基因SNPs与肿瘤的关系报道甚少。Chen等[16]发现CDH17基因SNP位点c.2216A>C多态性与结直肠癌患者的TNM分期、淋巴结转移相关,携带C等位基因的结直肠癌患者伴淋巴结转移和更高TNM分期的风险升高,与结直肠癌患者预后明显相关。Wang等[17]发现CDH17基因两个SNPs位点651C>T和IVS6+35A>G与中国人肝癌易感性相关,发现CDH17 mRNA剪切装置跳过6号与7号外显子产生2种不同的剪接变异体,50%肝癌患者中存在跳过7号外显子的CDH17剪接变异体,认为与预后不良有关。本研究首次发现CDH17的6号外显子SNP位点rs3214050等位基因C、T的频率和CC、CT和TT基因型频率在胃癌组与对照组间存在显著性差异,胃癌组CT和TT基因型分布频率上升,CC基因型下降,提示rs3214050位点CT 和TT基因型个体胃癌的患病风险下降,生存曲线显示rs3214050位点不同基因型胃癌患者生存时间存在显著性差异,提示rs3214050位点基因型与胃癌易感性及预后有关。本研究未发现CDH17 SNPs位点rs2514813多态性与胃癌易感性及预后有关。
综上所述,胃癌CDH17表达升高可能与胃癌腺样结构的维持有关,表达降低可能通过上皮间质转化机制导致胃癌细胞间的黏附性下降,促进侵袭的进展。CDH17基因rs3214050位点等位基因CT及TT基因型个体胃癌患病风险降低且预后较好,与胃癌遗传易感性有关。
参考文献
[1]Lin Z, Zhang C, Zhang M, et al. Targeting cadherin-17 inacti⁃vates Ras/Raf/MEK/ERK signaling and inhibits cell proliferation in gastric cancer[J]. PLoS One, 2014, 9(1):e85296.
[2]Wang J, Kang WM, Yu JC, et al. Cadherin-17 induces tumori⁃genesis and lymphatic metastasis in gastric cancer through activa⁃tion of NFκB signaling pathway[J]. Cancer Biol Ther, 2013, 14(3): 262-270.
[3]Qiu HB, Zhang LY, Ren C, et al. Targeting CDH17 suppresses tumor progression in gastric cancer by downregulating Wnt/βcatenin signaling[J]. PLoS One, 2013, 8(3):e56959.
[4]Su MC, Yuan RH, Lin CY, et al. Cadherin-17 is a useful diag⁃nostic marker for adenocarcinomas of the digestive system[J]. Mod Pathol, 2008, 21(11):1379-1386.
[5]Zhou MR, Wang N, Liu ZX, et al. Association between PLCε1 gene polymorphisms and susceptibility to esophageal carcinoma[J]. Chin J Clin Oncol, 2014, 41(22):1437-1441.[周容秒,王娜,刘朝旭,等.PLCε1基因多态性与食管癌遗传易感性的关联研究[J].中国肿瘤临床,2014,41(22):1437-1441.]
[6]Tang Y, Zhu J, Chen L, et al. Associations of matrix metallopro⁃teinase-9 protein polymorphisms with lymph node metastasis but not invasion of gastric cancer[J]. Clin Cancer Res, 2008, 14(9):2870-2877.
[7]Wendeler MW, Drenckhahn D, Gessner R, et al. Intestinal LI-cadherin acts as a Ca2+-dependent adhesion switch[J]. J Mol Biol, 2007, 370(2):220-230.
[8]Berndorff D, Gessner R, Kreft B, et al. Liver-intestine cadherin: molecular cloning and characterization of a novel Ca(2+)-depen⁃dent cell adhesion molecule expressed in liver and intestine[J]. J Cell Biol, 1994, 125(6):1353-1369.
[9]Motoshita J, Nakayama H, Taniyama K, et al. Molecular charac⁃teristics of differentiated-type gastric carcinoma with distinct mu⁃cin phenotype: LI-cadherin is associated with intestinal pheno⁃type[J]. Pathol Int, 2006, 56(4):200-205.
[10]Sakamoto N, Oue N, Sentani K, et al. Liver-intestine cadherin in⁃duction by epidermal growth factor receptor is associated with in⁃testinal differentiation of gastric cancer[J]. Cancer Sci, 2012, 103(9):1744-1750.
[11]Kreft B, Berndorff D, Böttinger A, et al. LI-cadherin-mediated cell-cell adhesion does not require cytoplasmic interactions[J]. J Cell Biol, 1997, 136(5):1109-1121.
[12]Ito R, Oue N, Yoshida K, et al. Clinicopathological significant and prognostic influence of cadherin-17 expression in gastric can⁃cer[J]. Virchows Arch, 2005, 447(4):717-722.
[13]Liu QS, Zhang J, Liu M, et al. Lentiviral-mediated miRNA against liver-intestine cadherin suppresses tumor growth and invasiveness of human gastric cancer[J]. Cancer Sci, 2010, 101(8): 1807-1812.
[14]Pitts TM, Kulikowski GN, Tan AC, et al. Association of the epi⁃thelial- to- mesenchymal transition phenotype with responsive⁃ness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models[J]. Front Pharmacol, 2013, 4:35.
[15]Lee HJ, Nam KT, Park HS, et al. Gene expression profiling of metaplastic lineages identifies CDH17 as a prognostic marker in early stage gastric cancer[J]. Gastroenterology, 2010, 139(1):213-225.
[16]Chen RY, Cao JJ, Chen J, et al. Single nucleotide polymorphisms in the CDH17 gene of colorectal carcinoma[J]. World J Gastroen⁃terol, 2012, 18(48):7251-7261.
[17]Wang XQ, Luk JM, Garcia-Barcelo M, et al. Liver intestine-cad⁃herin(CDH17)haplotype is associated with increased risk of he⁃patocellular carcinoma[J]. Clin Cancer Res, 2006, 12(17):5248-5252.
(2015-08-03收稿)
(2015-09-14修回)
(编辑:邢颖)
潘地铃专业方向为肿瘤病理学。
E-mail:pandiling269@qq.com

·临床研究与应用·
作者单位:①福建医科大学第一临床医学院病理科(福州市350005);②福建省妇幼保健院病理科
Significance of CDH17 expression and its single nucleotide polymorphisms in oncogenesis and progression of gastric carcinoma
Diling PAN1,2, Sheng ZHANG1, Xingfu WANG1, Yupeng CHEN1, Caihong REN1, Xiangna CHEN1
Correspondence to: ZHANG Sheng, E-mail: zhgshg@126.com
1Department of Pathology, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China;2Department of Pathology, Fujian Maternity and Children Health Hospital, Fuzhou 350001, China.
AbstractObjective: To explore the relationship of CDH17 expression with clinico-pathological features and the correlation between the single nucleotide polymorphisms(SNPs)of CDH17 gene and genetic susceptibility of gastric carcinoma(GC). Methods: A tissue microarray was performed to simulate the dynamic process of invasion and metastasis of GC. Immunohistochemical staining was performed to detect the expression of CDH17 protein, and PCR-based LDR was performed to detect the 2 SNP loci(rs2514813 and rs3214050)genotypes of CDH17 gene. Results: The expression of CDH17 protein in GC was more significantly up-regulated and greatly increased in the intestinal type than in the diffuse type. The expression of CDH17 protein in GC was positively correlated with the histological grading(P<0.01)and was not associated with the survival(P=0.209). With the progression of the cancer invasion, the expression of CDH17 protein in GC showed a downtrend from the gastric mucosa layer to the invasive front edge. The frequencies of the C and Talleles and the CC, CT, and TTgenotypes at the CDH17 rs3214050 locus between the GC patients and the control groups were significantly different(P<0.01). However, no significant differences were observed at rs2514813(P>0.05). The individuals with the T alleles had longer survival time than those with the CC genotype(P<0.01). Conclusion: The up-regulation of CDH17 expression is involved in the maintenance of histological phenotype and progression of GC. Individuals with T alleles at the CDH17 rs3214050 locus have decreased risk of GC and had better prognosis(OR=0.762, 95%CI:0.619-0.937), thereby suggesting that screening for these alleles would help with the assessment of genetic susceptibility and prognosis of GC in the Fujian population.
Keywords:Cadherin-17, gastric carcinoma, invasion, metastasis, immunohistochemistry, single nucleotide polymorphism
作者简介
通信作者:张声zhgshg@126.com
doi:10.3969/j.issn.1000-8179.2015.19.835

