12-LOX在神经胶质瘤中的表达及临床意义*
葛瑞祥盛莉莉徐善水刘银华徐国祥陈三送毛捷
12-LOX在神经胶质瘤中的表达及临床意义*
葛瑞祥①盛莉莉②徐善水①刘银华③徐国祥③陈三送①毛捷①
摘要目的:研究12-脂氧合酶(12-lipoxygenase,12-LOX)在神经胶质瘤中的表达及其临床意义。方法:免疫组织化学法检测40例神经胶质瘤组织和10例正常脑组织中12-LOX表达,结合临床随访资料探讨其表达与预后的相关性。结果:正常脑组织中12-LOX呈弱阳性表达,神经胶质瘤组织中强阳性表达率为72.5%,差异有统计学意义(P<0.05)。12-LOX强阳性表达与神经胶质瘤病理级别相关,差异有统计学意义(P=0.012),与患者性别、年龄、肿瘤大小、KPS评分无关。12-LOX强阳性表达患者中位无瘤生存期明显低于与弱阳性表达患者(P<0.05)。结论:12-LOX在神经胶质瘤中异常表达,其表达差异与神经胶质瘤的病理级别相关,与预后密切相关。
关键词12-LOX胶质瘤预后
神经胶质瘤是最常见的原发性颅内肿瘤,现阶段治疗方式以手术切除为主,结合放疗及化疗等综合治疗。由于其具有高度的侵袭及增殖能力,预后常表现为高复发率和低生存率的特征,这是神经外科医师治疗神经胶质瘤中所面临的难题。12-脂氧合酶(12-lipoxygenase,12-LOX)是脂氧合酶同工酶的一种,参与花生四烯酸的代谢。近年研究发现,12-LOX在前列腺癌、肝癌及卵巢癌等肿瘤细胞增殖和凋亡中发挥作用,影响患者预后[1-2]。然而,至今12-LOX在神经胶质瘤中表达及其作用尚不明确。本研究通过免疫组织化学法对神经胶质瘤组织中的12-LOX表达进行检测,探讨其在神经胶质瘤组织中的表达特点,结合临床随访资料分析12-LOX表达与神经胶质瘤临床预后相关性,为神经胶质瘤临床治疗及预后判断提供理论依据。
1 材料与方法
1.1临床资料
选取2010年1月至2014年1月皖南医学院第一附属医院初诊胶质瘤患者40例作为实验组,其中男性23例,女性17例;年龄25~75岁,平均年龄(46.3± 6.5)岁。按照2007年WHO中枢系统肿瘤病理分型标准[3]进行分级:低度恶性组(WHOⅠ/Ⅱ)24例,其中Ⅰ级7例,Ⅱ级17例;高度恶性组(WHOⅢ/Ⅳ)16例,其中Ⅲ级6例,Ⅳ级10例。术前患者均未接受任何放疗、化疗等辅助治疗。另取10例颅内减压术中取出的正常脑组织作为对照组,其中男性7例,女性3例;年龄23~62岁,平均年龄(31.2±2.3)岁。
1.2方法
1.2.1主要试剂鼠抗人12-LOX单克隆抗体购自英国Abcam公司,免疫组织化学SP法兔抗山羊二抗试剂盒、DAB试剂盒购自北京中杉金桥公司。
1.2.2免疫组织化学染色严格按照说明书步骤进行免疫组织化学试验,用已知胶质瘤阳性切片作为实验组,正常脑组织作为对照组。随机选择10个高倍镜视野计数(×400),评分标准:计数阳性细胞百分比:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两种计数相加为最后得分:0分为阴性(-),2分为(+),3~4分为(++),5~6分为(+++)。染色强度评分标准:不着色为0分,黄色为1分,棕黄色为2分,黄褐色为3分。阳性细胞所占比例评分标准:阳性细胞数<10%为0分;10%~40%为1分;40%~70%为2分;>70%为3分。两种评分相加0~2分为弱表达,3~6分为强表达。
1.2.3随访以患者接受手术之日为开始时间,随访截止时间为2015年6月,研究人群随访率为85.0% (34/40)。随访方式为电话随访、门诊复查或者上门追踪随访以尽量避免失访等。随访内容除临床检查、神经功能检查、影像学检查外,完成患者术前术后不同随访时间的KPS评分工作,记录患者病情进展以及目前生存状况及死亡原因。
1.3统计学方法
应用SPSS 13.0统计学软件分析,计量数据以x±s表示。临床病理等计数资料分析采用χ2或Fisher精确概率法,P<0.05为差异有统计学意义。用Kaplan-Meier法进行生存分析并绘制生存曲线,采用Log-rank检验比较两组之间生存率差别,α=0.05位检验水准,结果以双侧P<0.05为差异有统计学意义。
2 结果
2.1 12-LOX在神经胶质瘤和正常脑组织中的表达
如表1所示,10例正常脑组织均呈弱阳性表达,神经胶质瘤组织中12-LOX强阳性表达率为72.5% (29/40),显著高于正常脑组织,两组差异有统计学意义(P<0.05)。12-LOX在低度恶性组(WHOⅠ/Ⅱ)中呈弱阳性表达,在高度恶性组(WHOⅢ/Ⅳ)中呈强阳性表达。12-LOX在神经胶质瘤组织和正常脑组织中的表达见图1。
2.2 12-LOX表达与临床病理因素的关系
12-LOX强阳性表达率随神经胶质瘤病理级别的增高呈递增趋势。各级之间差异有统计学意义(χ2=10.95,P=0.012)。12-LOX表达与患者年龄、性别、肿瘤大小、位置、KPS评分无关(表2)。

表1 12-LOX在神经胶质瘤和正常脑组织中的表达 例Table 1 Expression of 12-LOX in glioma tissues and normal human brain tissues n

图1 12-LOX在神经胶质瘤组织和正常脑组织中的表达(SP×400)Figure 1 12-LOX expression in glioma tissues and normal brain tissues(SP×400)
2.3 12-LOX阳性表达与无瘤生存期之间的关系
本组患者随访时间2~56个月,其中12-LOX强阳性表达组术后中位无瘤生存时间为(13.2±1.2)个月,12-LOX弱阳性表达组术后中位无瘤生存时间为(25.6±1.1)个月。经Log-rank检验,两组间差异有统计学意义(χ2=11.503,P<0.05,图2)。
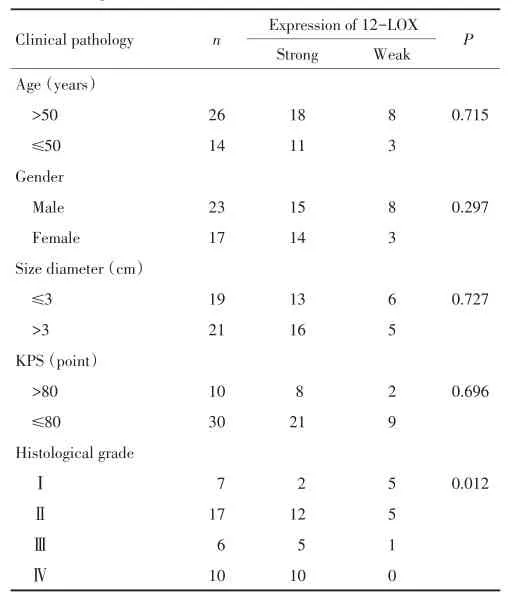
表2 12-LOX表达与临床病理因素之间的关系 例Table 2 Relationship between 12-LOX expression and clinicopathologi⁃cal factors in glioma n
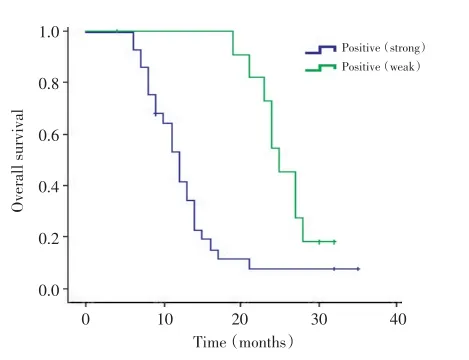
图2 12-LOX强阳性表达和弱阳性表达胶质瘤患者生存曲线Figure 2 Survival curves of the patients with astrocytoma stratified by 12-LOX expression
3 讨论
脂氧合酶(lipoxygenase,LOXs)是一类非血红素含铁酶,能催化花生四烯酸生成羟二十碳四烯酸(hydroxyeicosatetraenoicacid,HETE)和白三烯(leukotri⁃ ene,LT)等生物活性物质,参与细胞信号转导、生长代谢等过程。根据LOX对底物加氧的位置不同可将其分为5-、8-、12-、15-LOX四种分型。近年有研究报道,12-LOX在多种肿瘤细胞中表达。Ding等[4]通过RT-PCR实验发现,12-LOX在PANC-1、MiaPaca2、Capan2、ASPC-1四种人类胰腺癌细胞系中均存在表达而在正常胰腺组织中不表达,提示抑制12-LOX的表达可有效抑制胰腺癌细胞的增殖。Piotrowska等[5]通过酶联免疫法检测88例前列腺癌组织标本及正常前列腺组织中12-LOX的表达情况,发现12-LOX在正常前列腺组织中不表达,而在前列腺癌组织中12-LOX表达明显,上调12-LOX的表达可促进前列腺癌细胞的增殖与侵袭,推测12-LOX在前列腺癌组织中可能是一种癌基因产物。上述研究结果提示,12-LOX的表达可能与肿瘤的生长与增殖存在密切的关系。其中作用机制可能为12-LOX代谢产物12-羟基二十碳四烯酸(12-hydroxyeicosatetraenoic ac⁃id,12-HETE)通过诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)基因的转录和翻译促进肿瘤血管重构,在肿瘤的发生发展过程中起重要作用[6]。
近年有报道12-LOX广泛分布在神经系统中,在神经元细胞中表达较为明显。神经系统中12-LOX过表达可消耗大量谷胱甘肽,并产生神经毒性的谷氨酸,诱导神经细胞的凋亡[7-10],提示12-LOX参与神经元和神经胶质细胞生长和代谢过程,12-LOX过表达可能是神经系统病变潜在信号。本研究结果显示,在正常脑组织中12-LOX呈弱阳性表达;12-LOX在神经胶质瘤组织中呈强阳性表达,且强阳性表达率为72.5%(29/40)。这表明12-LOX在正常脑组织中表达,但表达强度明显弱于神经胶质瘤组织,两组之间表达差异排除实验条件与组织切片等因素,提示12-LOX在神经胶质瘤中呈过表达。Chiu等[11]研究发现在神经胶质瘤U87细胞系中,12-LOX特异性拮抗剂Baicalein能显著抑制神经胶质瘤细胞的增殖和侵袭。这表明下调12-LOX在神经胶质瘤细胞中的表达,可以抑制神经胶质瘤的增殖和侵袭,提示12-LOX的过表达可能在胶质瘤的发生发展过程中发挥着重要作用。
Gao等[12]通过实验发现,12-LOX在前列腺癌中表达,且随着病理级别的增高,在肿瘤细胞中的表达增强,推测12-LOX在肿瘤细胞中的表达差异与病理分期呈正相关。从本研究结果可以看出,12-LOX表达水平与神经胶质瘤细胞的病理分级也存在着密切的关系,提示12-LOX在神经胶质瘤细胞中表达与神经胶质瘤的级别呈正相关,与年龄、性别、KPS评分和肿瘤大小无明显相关。通过随访发现,神经胶质瘤组织12-LOX表达较高的患者中位生存期明显低于12-LOX表达较低的患者,提示12-LOX的表达可能影响患者的术后生存时间。其机理可能与12-LOX的代谢产物促进肿瘤细胞增殖、侵袭及血管生成,引起神经胶质瘤术后预后不良相关[13]。
本研究探索了12-LOX在胶质瘤表达情况,由于12-LOX在正常脑组织和神经胶质瘤中表达有显著的差异,因此可以作为一种潜在的肿瘤标记物。然而,12-LOX影响肿瘤发生具体机制和信号通路仍不明确,其他脂氧酶及其代谢产物对12-LOX协调作用并未深入研究,因此12-LOX在胶质瘤发生过程中具体作用机制尚需进一步研究。
参考文献
[1]Xu XM, Yuan GJ, Deng JJ, et al. Inhibition of 12-lipoxygenase reduces proliferation and induces apoptosis of hepatocellular carci⁃noma cells in vitro and in vivo[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(2):193-202.
[2]Guo AM, Liu X, Al-Wahab Z, et al. Role of 12-lipoxygenase in regulation of ovarian cancer cell proliferation and survival[J]. Can⁃cer Chemother Pharmacol, 2011, 68(5):1273-1283.
[3]Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classi⁃fication of tumours of the central nervous system.[J]. Acta Neuro⁃pathol, 2007, 114(2):97-109.
[4]Ding X, Iversen PM, Knezetic J, et al. Lipoxygenase inhibitors abolish proliferation of human pancreatic cancer cells[J]. Biochem Biophys Res Commun, 1999, 261(1):218-223.
[5]Piotrowska M, Szefel J, Skrzypczak-Jankun E, et al. The concen⁃tration of 12-lipoxygenase in platelet rich plasma as an indication of cancer of the prostate.[J]. Contemp Oncol(Pozn), 2013, 17(4): 389-393.
[6]Mccabe NP, Selman SH, Jankun J. Vascular endothelial growth factor production in human prostate cancer cells is stimulated by overexpression of platelet 12-lipoxygenase[J]. Prostate, 2006, 66(7):779-787.
[7]Chu J, Zhuo J, Praticò D. Transcriptional regulation of βsecre⁃tase-1 by 12/15-lipoxygenase results in enhanced amyloidogene⁃sis and cognitive impairments[J]. Ann Neurol, 2012, 71(1):57-67.
[8]Li Y, Maher P, Schubert D. A Role for 12-lipoxygenase in Nerve Cell Death Caused by Glutathione Depletion[J]. Neuron, 1997, 19(2):453-463.
[9]Yoshihiro H, Hideji T, Yoshiki K, et al. Arachidonic acid pro⁃motes glutamate-induced cell death associated with necrosis by 12- lipoxygenase activation in glioma cells[J]. Life Sci, 2007, 80(20):1856-1864.
[10]Wang H, Li J, Follett P L, et al. 12-Lipoxygenase plays a key role in cell death caused by glu-tathione depletion and arachidon⁃ic acid in rat oligodendrocytes.[J]. Eur J Neurosci, 2004, 20(8): 2049-2058.
[11]Chiu WT, Shen SC, Chow JM, et al. Contribution of reactive ox⁃ygen species to migration/invasion of human glioblastoma cells U87 via ERK-dependent COX-2/PGE(2)activation[J]. Neurobi⁃ol Dis, 2010, 37(1):118-129.
[12]Gao X, David J Grignon, Taibi Chbihi, et al. Elevated 12-lipoxy⁃genase mRNA expression correlates with advanced stage and poor differentiation of human prostate cancer.[J]. Urology, 1995, 46(2): 227-237.
[13]Pidgeon GP, Lysaght J, Krishnamoorthy S, et al. Lipoxygenase metabolism: roles in tumor progression and survival[J]. Cancer Metastasis Rev, 2007, 26(3-4):503-524.
(2015-07-26收稿)
(2015-09-09修回)
(编辑:邢颖)
葛瑞祥专业方向为神经胶质瘤基础及临床研究。
E-mail:geruixiang2013@163.com

·临床研究与应用·
作者单位:①安徽省芜湖市皖南医学院第一附属医院神经外科(安徽省芜湖市241000);②肿瘤研究所;③病理科*本文课题受皖南医学院第一附属医院引进人才项目(编号:2014047)资助
Expression and significance of 12-lipoxygenase in human glioma
Ruixiang GE, Lili SHENG, Shanshui XU, Yinhua LIU, Guoxiang XU, Sansong CHEN, Jie MAO
Correspondence to: Jie MAO; E-mail: myw921@yahoo.com
1Department of Neurosurgery,2Tumor Research Institute;3Department of Pathology, the First Affiliated Hospital of Wannan Medi
cal College, Wuhu 241000, China.
This work was supported by the project Talent Introduction of the First Affiliated Hospital of Wannan Medical College(No.
2014047).
AbstractObjective: To investigate the expression and clinical significance of 12-lipoxygenase(12-LOX)in glioma. Methods: 12-LOX expression in 40 glioma cases and 10 normal human-brain tissues was assayed by immunohistochemistry. Clinicopathological data were analyzed to reveal the association between 12-LOX expression and prognosis of glioma patients. Results: 12-LOX was weakly expressed in the normal human brain tissues, whereas 12-LOX was strongly expressed(72.5%)in glioma tissues(P<0.05). The strong 12-LOX expression was correlated with the histopathological grading of glioma(P=0.012), whereas 12-LOX expression was not correlated with factors such as patient gender and age, tumor size, and Karnofsky Performance Score. Median survival time was longer in the group with low 12-LOX expression(25.6 months)than in the group with high 12-LOX expression(13.2 months)(P<0.05). Conclusion: Abnormal 12-LOX expression is implicated in glioma. 12-LOX expression was correlated with the histopathological grading of glioma and was closely associated with patient prognosis.
Keywords:12-LOX, glioma, prognosis
作者简介
通信作者:毛捷myw921@yahoo.com
doi:10.3969/j.issn.1000-8179.2015.19.799

