浅表血栓性静脉炎管壁的细胞凋亡水平变化*
孙延平,吴洪娟,王磊,徐永波,唐金元,李坤,张晶晶,李虎,褚海波
(1.解放军第89医院普外中心,山东 潍坊 261021;2.潍坊医学院电镜室,山东 潍坊 261042;3.潍坊医学院研究生部,山东 潍坊 261042)
·临床论著·
浅表血栓性静脉炎管壁的细胞凋亡水平变化*
孙延平1,吴洪娟2,王磊3,徐永波1,唐金元1,李坤1,张晶晶1,李虎1,褚海波1
(1.解放军第89医院普外中心,山东 潍坊 261021;2.潍坊医学院电镜室,山东 潍坊 261042;3.潍坊医学院研究生部,山东 潍坊 261042)
目的检测浅表血栓性静脉炎管壁的细胞凋亡水平变化,探讨细胞凋亡与静脉管壁扩张的相关性。方法收集大隐静脉曲张标本50例,其中浅表血栓性静脉炎(血栓组)和单纯静脉曲张标本各25例(曲张组)。正常大隐静脉标本15例(对照组)。采用末端标记法(TUNEL)、免疫荧光法、免疫组织化学法及电镜,观察细胞凋亡水平和超微结构变化。结果血栓组和曲张组管壁内膜和中膜凋亡细胞比率明显低于对照组,差异有统计学意义(P<0.01);血栓组和曲张组管壁Bcl-xl阳性蛋白呈高表达,对照组管壁Bax阳性蛋白呈高表达。电镜显示,3组凋亡细胞形态学特征为线粒体嵴模糊、髓样变、核染色质边集。结论浅表血栓性静脉炎和曲张静脉通过内源性通道引发细胞凋亡调节异常,导致静脉管壁扩张、增厚,推测其可能是静脉曲张的发病机制之一。
浅表血栓性静脉炎;静脉曲张;隐静脉;细胞凋亡
研究表明,下肢静脉曲张管壁的改变先于瓣膜功能不全[1]。血管重塑理论的提出为研究静脉曲张的病理发生、发展过程奠定理论基础[2]。细胞凋亡参与曲张静脉管壁重塑过程,两者关系密切。检测静脉管壁细胞凋亡的方法诸多,如细胞核凋亡、细胞蛋白凋亡、酶的裂解及细胞超微结构变化,但曲张静脉管壁细胞凋亡的结果尚未一致(增加或减少)[3-9]。本研究通过末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)、免疫荧光染色法、Bax和Bcl-xl免疫组织化学法以及电镜观察、检测静脉曲张合并浅表血栓性静脉炎、单纯静脉曲张以及正常大隐静脉管壁细胞凋亡水平,探讨细胞凋亡与静脉管壁扩张的相关性。
1 资料与方法
1.1一般资料
选取2012年1月-2014年8月在本院行高位结扎剥脱加旋切治疗的大隐静脉曲张患者50例,分为浅表血栓性静脉炎(血栓组)和单纯静脉曲张(曲张组),每组25例。其中,血栓组男性14例,女性11例;平均年龄35岁(28~45岁)。曲张组男性13例,女性12例;平均年龄36岁(27~46岁)。对照组为创伤行截肢术而大隐静脉无损伤患者15例,男性9例,女性6例;平均年龄32岁(20~39岁)。术前50例患者经彩色多普勒超声检查,确诊为原发性大隐静脉曲张。血栓组为慢性血栓性静脉炎(血栓形成时间>30 d),按临床、病因、解剖、病理生理分类为C2、C3。排除标准:下肢严重水肿,静脉曲张伴皮肤改变,急性或亚急性血栓性静脉炎(血栓形成时间<14或30 d),非血栓性静脉炎,动脉疾病及糖尿病患者。
1.2实验方法与试剂
1.2.1标本收集和处理术中取膝关节下方大隐静脉主干标本3~4 mm,10%福尔马林溶液固定,常规脱水、包埋,4μm厚连续切片,备1张行苏木精-伊红染色。每个标本切片15份,每组5份分别行TUNEL染色、免疫荧光及免疫组织化学法检测。获取新鲜标本1 mm3,置3%戊二醛中固定24~48 h,常规脱水、包埋、烘干。采用超薄切片,厚70 nm,切片经水洗后放入醋酸铀饱和水溶液浸泡,双蒸水清洗后放入枸橼酸铅溶液浸泡,最后用双蒸水清洗干净。采用日本日立公司生产的H-7500型透射电镜观察内皮和平滑肌细胞超微结构变化。
1.2.2TUNEL染色、免疫荧光及免疫组织化学法具体方法分别参考DUCASSE[9]和HEISING等[10]的研究。在400倍光镜下对每张切片选取5个视野进行组织学分析。依据核染色强度、密度及染色质形态确定凋亡细胞的免疫组织化学表达。结果判断由两位病理医师采用双盲法读取。采用Image-Pro Plus 6.0软件分析处理图像,计算每个高倍视野中管壁内膜和中膜凋亡的阳性细胞数。取同一标本5个视野中静脉管壁内膜和中膜测量值凋亡的阳性细胞数之和,计算平均数,得出同一标本凋亡阳性细胞个数。细胞凋亡率(%)=每个高倍视野中凋亡细胞数/总细胞数×100%。羊血清由北京中杉金桥生物技术有限公司提供,微波缓冲液自配,试剂由北京化工厂提供,Roche细胞凋亡试剂由瑞士罗氏生物科技公司提供,Bax和Bcl-xl试剂盒由北京中杉金桥生物技术有限公司提供。
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组比较用两独立样本t检验,多组比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1静脉管壁凋亡细胞分布
TUNEL法和免疫荧光法结果一致。血栓组和曲张组管壁内膜和中膜偶见单个的凋亡细胞,凋亡细胞在两组的分布基本相同(见图1A、B、D、E);对照组静脉管壁内膜和中膜可见较多凋亡细胞,以内膜和中膜内层明显(见图1C、F)。
2.2静脉管壁凋亡细胞比率比较
血栓组和曲张组管壁内膜和中膜的凋亡细胞比率明显低于对照组,差异有统计学意义(P<0.01);血栓组与曲张组比较,差异无统计学意义(P>0.05);3组内膜、中膜的凋亡细胞比率比较,差异无统计学意义(P>0.05)。见附表。
2.3静脉管壁凋亡蛋白的阳性表达分布
血栓组与曲张组管壁内膜和中膜可见散在分布的Bax凋亡蛋白阳性表达,较多的Bcl-xl凋亡蛋白阳性表达(见图2A、B、D、E);对照组的内膜和中膜中,Bax和Bcl-xl凋亡蛋白阳性表达的分布与血栓组和曲张组相反(见图2C、F)。
2.4静脉管壁凋亡蛋白的阳性表达率比较
血栓组和曲张组管壁的内膜和中膜中,Bax凋亡蛋白阳性表达率减少,Bcl-xl凋亡蛋白阳性表达率增加;对照组管壁的内膜和中膜中,Bax凋亡蛋白阳性表达率增加,Bcl-xl凋亡蛋白阳性表达率减少。见图3。
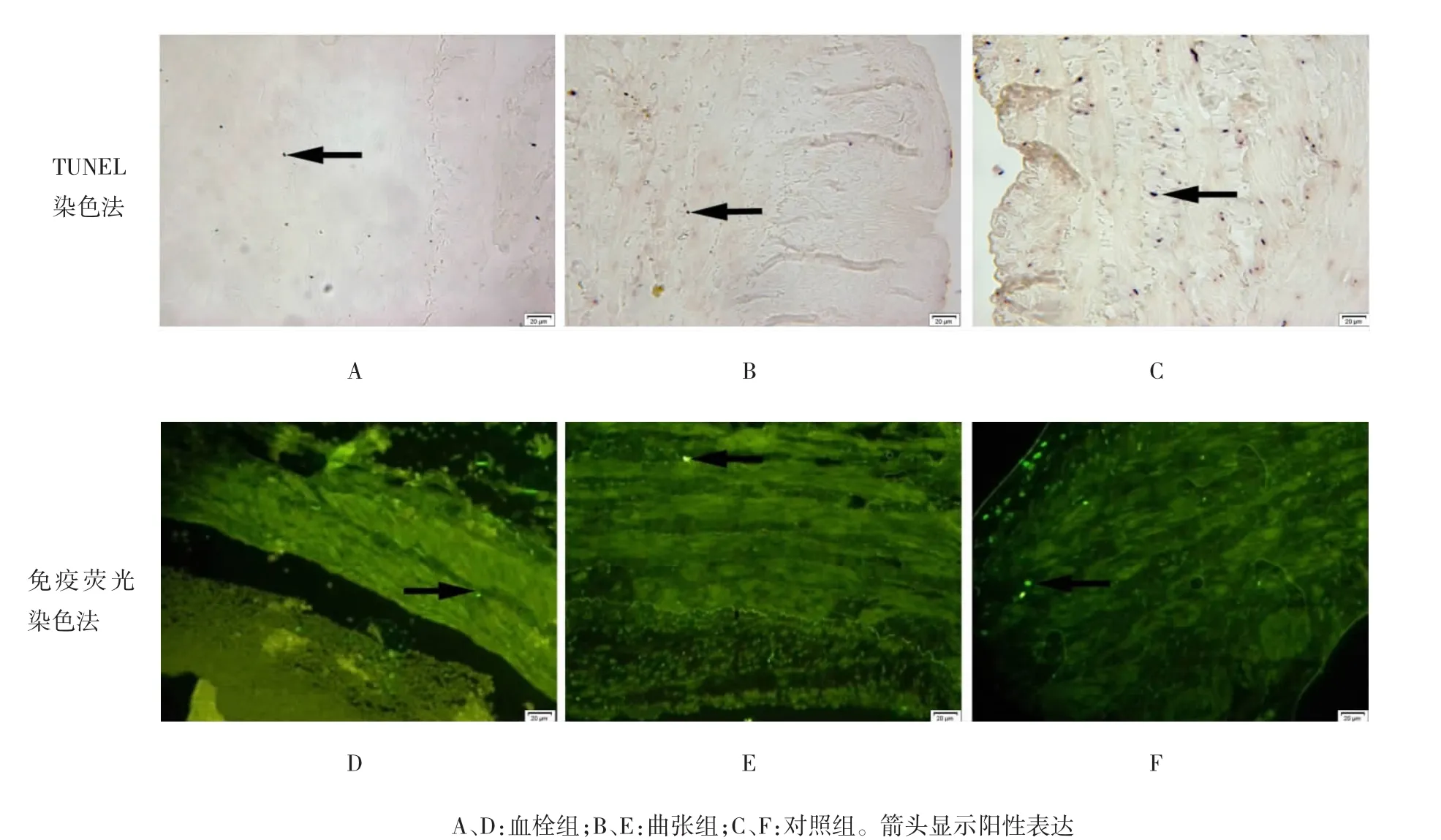
图1 静脉管壁TUNEL和免疫荧光染色法(×400,bar=20μm)
附表3组静脉管壁内膜和中膜的凋亡细胞比率比较(%±s)
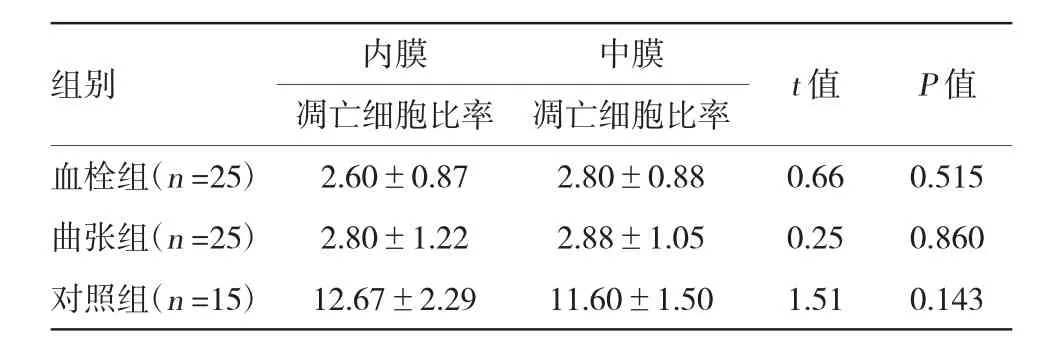
附表3组静脉管壁内膜和中膜的凋亡细胞比率比较(%±s)
组别内膜中膜t值P值凋亡细胞比率凋亡细胞比率血栓组(n=25)2.60±0.872.80±0.880.660.515曲张组(n=25)2.80±1.222.88±1.050.250.860对照组(n=15)12.67±2.2911.60±1.501.510.143
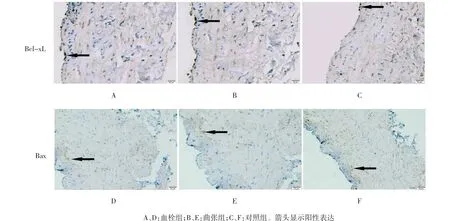
图2 静脉管壁Bcl-xl和Bax免疫组织化学法(×400,bar=20μm)
2.5静脉管壁凋亡细胞的超微结构变化
3组静脉管壁内皮细胞(endothelial cells,ECs)和平滑肌细胞(smooth muscle cells,SMCs)凋亡形态学特征为线粒体模糊、嵴断裂、髓样变、粗面内质网增宽、脱颗粒、核染色质边集(见图4A~C和E~G)。正常形态学特征为线粒体、粗面内质网、核染色质正常(见图4D、H)。
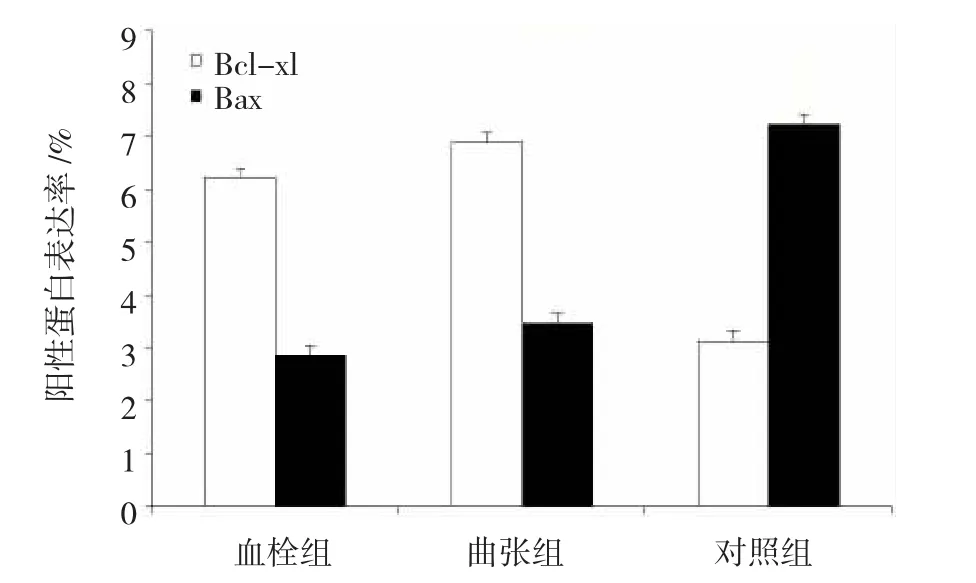
图3 静脉管壁Bcl-xl和Bax凋亡蛋白的阳性表达率
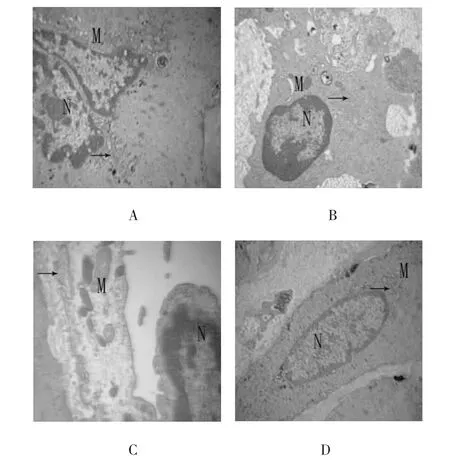
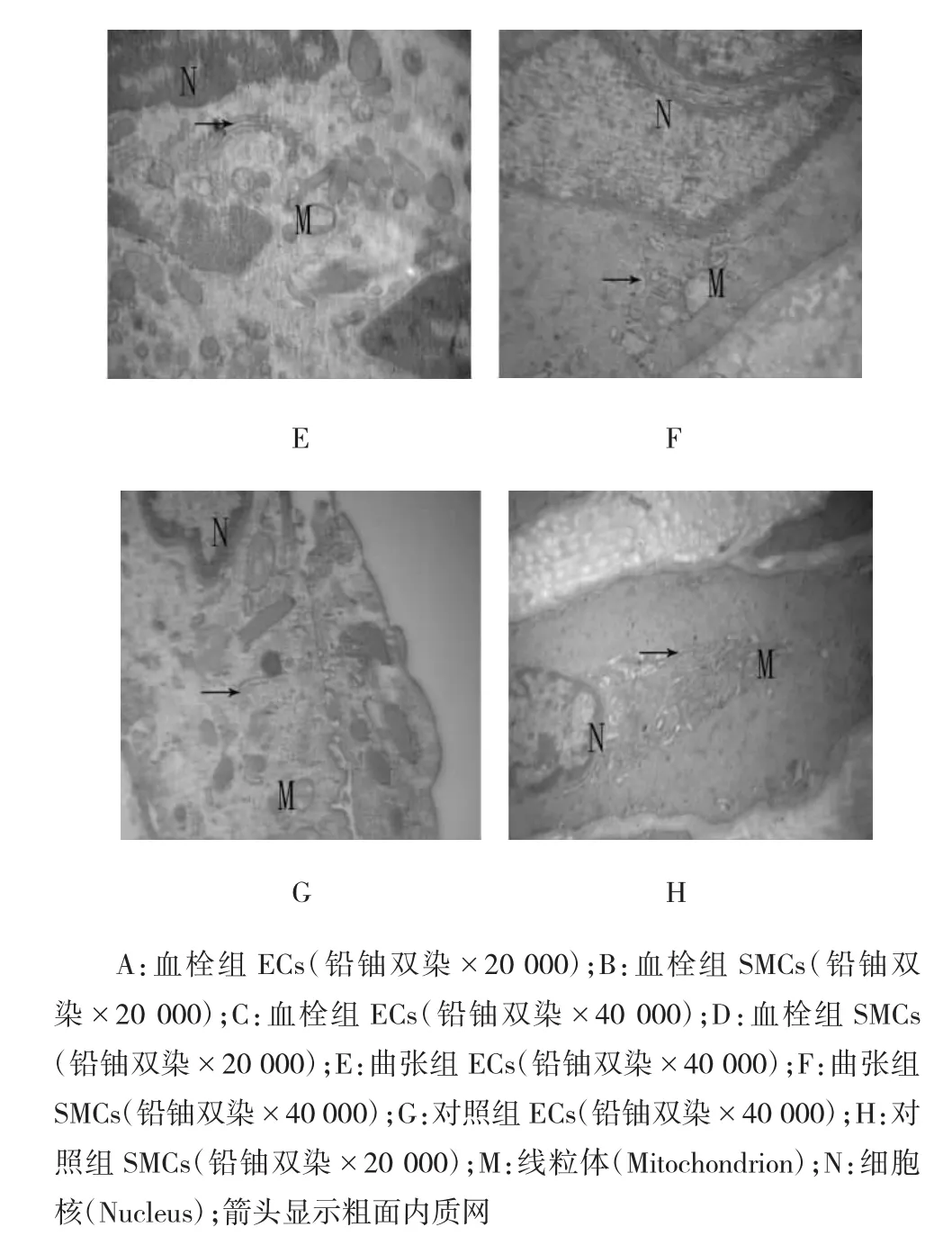
图4 静脉管壁ECs和SMCs的超微结构变化
3 讨论
在多细胞生物体中,细胞的增殖与死亡平衡是维持内环境稳定的重要环节[11]。细胞凋亡是一种生理性、程序性的细胞死亡方式。细胞凋亡的形态学及生物学特征是核质浓缩,核膜核仁破碎,DNA降解成180~200 bp片段,胞膜结构仍然完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体[12]。研究表明,细胞凋亡失调与静脉疾病的病理变化密切相关[13]。细胞凋亡包括内源性和外源性两条通道。内源性通道又称线粒体通道,通过调节细胞凋亡启动蛋白(Bax或Bcl-2)及半胱天冬酶(Caspase)刺激线粒体释放细胞色素C进入胞浆与凋亡蛋白酶活化因子-1(apoptotic protease activating factor 1,APAF-1)结合,引发细胞凋亡。外源性通道又称跨膜通道,在细胞凋亡信号的刺激下,Fasl和肿瘤坏死因子-α作用于相应的受体,导致细胞凋亡[14-16]。研究发现,缺氧可导致细胞凋亡下调,缩短细胞周期,引起静脉壁的平滑肌细胞过度增生,由此引发静脉管壁重塑[4,17]。当Bax基因蛋白下降时,平滑肌细胞凋亡下调,曲张静脉管壁细胞凋亡明显低于正常静脉[3]。正常情况下,一氧化氮和γ-干扰素能促进静脉管壁的细胞凋亡。组织内存在高铁离子时,T细胞增殖会替代细胞凋亡[18]。可见曲张静脉管壁细胞凋亡使内皮细胞和平滑肌细胞代谢失衡,内源性凋亡通道抑制,出现细胞堆积、老化、结构异常,管壁的成分与结构发生相应改变。
关于曲张静脉管壁细胞凋亡的文献已有报道,但结果不一,各持己见。DUCASSE等[9]研究表明,曲张静脉管壁结构紊乱,其胶原纤维和弹性纤维比例失调。TUNEL染色显示,中膜细胞凋亡明显减少。在正常静脉中,过氧化物酶、Bax和Caspase-9凋亡蛋白表达明显降低。ASCHER等[3]研究发现,曲张组Bax凋亡蛋白呈低表达,正常组Bcl-x凋亡蛋白呈高表达。曲张组内膜和中膜聚合酶呈低表达,外膜不表达;正常组聚合酶则呈高表达,结果表明,在静脉高压和缺氧条件下,控制细胞凋亡的内源性通道失调,导致静脉壁扩张和增厚。有学者认为,细胞凋亡与年龄有关。>50岁患者静脉管壁内皮细胞和平滑肌细胞凋亡明显增多,这可能与其他信号通道开放有关[19-20]。FILIS等[6]则发现,曲张静脉管壁Bax、Caspase-3、Bcl-xl、Bcl-xs及Ki-67表达升高,细胞凋亡增多,远端主干比近端主干更明显。由此可见,细胞凋亡与静脉管壁重塑密切相关,并受诸多因素影响。
本实验行TUNEL染色和免疫荧光检测后发现,血栓组和曲张组管壁(内膜和中膜)中可见散在的凋亡细胞,其分布基本相同。对照组管壁(内膜和中膜)则见较多的凋亡细胞。血栓组和曲张组管壁Bax凋亡蛋白阳性表达减少,Bcl-xl凋亡蛋白阳性表达增加;对照组则与血栓组和曲张组相反。定量分析表明,血栓组和曲张组管壁(内膜和中膜)凋亡细胞比率明显低于对照组。电镜显示,3组静脉管壁存在ECs和SMCs凋亡,其形态学特征为线粒体模糊、嵴断裂、髓样变、粗面内质网增宽、脱颗粒、核染色质边集。本研究结果与DUEASSE等[21]报道一致。结果提示,静脉高压和缺氧可能导致静脉管壁内源性通道细胞凋亡失调,以降低细胞的更新[4,22-23]。一方面组织缺氧会导致细胞应激,增加抗凋亡蛋白(Bcl-2),减少Caspase-9裂解作用及线粒体外膜的渗透性,由此阻断内源性线粒体通道[24-25];另一方面Fas和Caspase-8激活,导致跨膜通道受阻[26-27]。本研究结果证实,血栓组和曲张组管壁细胞凋亡与静脉管壁结构改变关系密切,该结论符合笔者前期的研究结果(光镜下血栓组和曲张组内皮细胞异常或不连续,平滑肌细胞肥大或增生,胶原纤维大量增多,滋养血管增多和异常。电镜下内皮细胞变性或缺失,平滑肌细胞去分化由收缩型转为分泌型)[28]。笔者认为,静脉管壁组织学和形态学改变是细胞凋亡的动态平衡基础。凋亡的上调和下调是组织本身一种代偿性、生理性自我保护。血栓性静脉炎和曲张静脉管壁细胞凋亡水平明显下降,提示静脉管壁内源性凋亡通道抑制,推测静脉高压可能是影响细胞凋亡的启动因素之一。本研究存在一定的局限性,观察者间和观察者内的差异性及人口学因素均可影响实验结果。另外,单中心的结果有待多中心研究进一步验证。
致敬本课题得到潍坊医学院病理教研室张宝刚教授和电镜室张圣明教授的大力帮助,在此表示衷心的感谢!
[1]LIM CS,DAVIES AH.Pathogenesis of primary varicose veins[J]. Br J Surg,2009,96(11):1231-1242.
[2]GIBBONS GH,DZAU VJ.The emerging concept of vascular remodeling[J].N Engl J Med,1994,330(20):1431-1438.
[3]ASCHER E,JACOB T,HINGORANI A,et al.Expression of molecular mediators of apoptosis and their role in the pathogenesis of lower-extremity varicose veins[J].J Vasc Surg,2001,33(5): 1080-1086.
[4]URBANEK T,SKOP B,ZIAJA K,et al.Sapheno-femoral junction pathology:molecular mechanism of saphenous vein incompetence[J].Clin Appl Thromb Hemost,2004,10(4):311-321.
[5]BUJAN J,JIMENEZ-COSSIO JA,JURADO F,et al.Evaluation of the smooth muscle cell component and apoptosis in the vein wall[J].Histol Histopathol,2000,15(3):745-752.
[6]FILIS K,KAVANTZAS N,ISOPOULOS T,et al.Increased vein wall apoptosis in varicose vein disease is related to venous hypertension[J].Eur J Vasc Endovasc Surg,2011,41(4):533-539.
[7]FILIS K,KAVANTZAS N,DALAINAS I,et al.Evaluation of apoptosis in varicose vein disease complicated by superficial vein thrombosis[J].Vasa,2014,43(4):252-259.
[8]ASCHER E,JACOB T,HINGORANI A,et al.Programmed cell death(apoptosis)and its role in the pathogenesis of lower extremity varicose veins[J].Ann Vasc Surg,2000,14(1):24-30.
[9]DUCASSE E,GIANNAKAKIS K,CHEVALIER J,et al.Dysregulated apoptosis in primary varicose veins[J].Eur J Vasc Endovasc Surg,2005,29(3):316-323.
[10]HEISING S,GIEBEL J,OSTROWITZKI AL,et al.Evaluation of apoptotic cells and immunohistochemical detection of FAS, FAS-L,Bcl-2,Bax,p53 and c-Myc in the skin of patients with chronic venous leg ulcers[J].Int J Mol Med,2008,22(4): 497-505.
[11]KORSMEYER SJ,SHUTTER JR,VEIS DJ,et al.Bcl-2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J]. Semin Cancer Biol,1993,4(6):327-332.
[12]TERAKI Y,SHIOHARA T.Apoptosis and the skin[J].Eur J Dermatol,1999,9(5):413-426.
[13]BOEHM I.Apoptosis in physiological and pathological skin:implications for t herapy[J].Curr Mol Med,2006,6(4):375-794.
[14]WALLACH D,VARFOLOMEEV EE,MALININ NL,et al.Tumor necrosis factor receptor and fas signaling mechanisms[J]. Annu Rev Immunol,1999,17:331-367.
[15]YUAN J.Transducing signals of life and death[J].Curr Opin Cell Biol,1997,9(2):247-251.
[16]REED JC.Cytochrome c:can't live with it;can't live without it[J].Cell,1997,91(5):559-562.
[17]LEE JD,YANG WK,LAI CH.Involved in trinsic apoptotic pathway in the varicocele and varicose veins[J].Ann Vasc Surg, 2010,24(6):768-774.
[18]SIMKA M,RYBAK Z.Hypothetical molecular mechanisms by which local iron overload facilitates the development of venous leg ulcers and multiple sclerosis lesions[J].Med Hypotheses, 2008,71(2):293-297.
[19]SIMOVART HE,AREND A,LIEBERG J,et al.Associations of NF-kappaB and bax with apoptosis in varicose veins of women of different age groups[J].Int J Vasc Med,2011,DOI:10.1155/ 2011/639720.
[20]BASTOS AN,ALVES MM,MONTE-ALTO-COSTA A,et al. α-smooth muscle actin,fibrillin-1,apoptosis and proliferation detection in primary varicose lower limb veins of women[J].Int Angiol,2011,30(3):262-271.
[21]DUCASSE E,GIANNAKAKIS K,SPEZIALE F,et al.Association of primary varicose veins with dysregulated vein wall apoptosis[J].Eur J Vasc Endovasc Surg,2008,35(2):224-229.
[22]LEE JD,LU LY,CHENG WH,et al.Dysregulated apoptosis through the intrinsic pathway in the internal spermatic vein of patients with varicocele[J].J Formos Med Assoc,2009,108(8): 612-618.
[23]LEE JD,YANG WK,LEE TH.Increased expression of hypoxia-inducible factor-1alpha and bcl-2 in varicocele and varicose veins[J].Ann Vasc Surg,2012,26(8):1100-1105.
[24]COOPER AL,BEASLEY D.Hypoxia stimulates proliferation and interleukin-1 alpha production in human vascular smooth muscle cells[J].Am J Physiol,1999,277:1326-1337.
[25]WANG JH,WU QD,BOUCHIER-HAYES D,et al.Hypoxia upregulates Bcl-2 expression andsuppresses interferongamma induced antiangiogenic activity in human tumor derived endothelial cells[J].Cancer,2002,94(10):2745-2755.
[26]CHIPUK JE,GREEN DR.Do inducers of apoptosis trigger caspase-independent cell death[J].Nat Rev Mol Cell Biol,2005,6(3): 268-275.
[27]MARSDEN VS,O’CONNOR L,O’REILLY LA,et al.Apoptosis initiated by Bcl-2-regulated caspase activation independently of the cytochrome c/Apaf-1/caspase-9apoptosome[J].Nature, 2002,419(6907):634-637.
[28]JIAN FG,CHU HB,LIU GZ,et al.Morphological characteristics of the walls of thrombophlebitic saphenous vein[J].Phlebology,2014,29(3):164-170.
(童颖丹 编辑)
Changes in levels of apoptosis in walls of superficial thrombophlebitis*
Yan-ping SUN1,Hong-juan WU2,Lei WANG3,Yong-bo XU1,Jin-yuan TANG1, Kun LI1,Jing-jing ZHANG1,Hu LI1,Hai-bo CHU1
(1.Department of General Surgery,the 89th Hospital of PLA,Weifang,Shandong 261021, P.R.China;2.Department of Electron Microscope,3.Department of Postgraduate, Weifang Medical College,Weifang,Shandong 261042,P.R.China)
【Objective】To investigate the relationship between apoptosis and great saphenous varicose veins by detecting the changes in levels of apoptosis in venous walls.【Methods】Totally 50 specimens of great saphenous veins[25 specimens with superficial thrombophlebitis(thrombosis group)and 25 specimens of simple varicose veins(varicose group)]as well as 15 specimens of normal great saphenous veins(control group)were collected.Apoptosis as well as Bax and Bcl-xl protein expressions were evaluated by the TUNEL assay and immunofluorescence staining.The morphology of apoptotic cells was observed with electromicroscope.【Results】In the thrombosis and varicose groups,the apoptotic cell rates in the venous walls(intima and media)were significantly lower than those in the corresponding regions in the control group(P<0.01).The high expression of Bcl-xl protein was detected in the thrombosis and varicose groups,while the high expression of Bax protein was observed in the control group.Electromicroscopic observation confirmed that endothelial and smooth muscle cells in the three groups exhibited apoptotic morphologic features,such as fuzzy mitochondrial cristae,medullary changes and margination of the nuclear chromatin.【Conclusions】Our results showed that dysregulation of apoptosis via the intrinsic pathways in varicose veins leads to the downregulation of apoptosis,which results in wall thickening and an increase in the lumen.This may be one of the mechanisms of venous diseases.
superficial thrombophlebitis;varicose vein;saphenous vein;apoptosis
R543.6;Q253
A
1005-8982(2015)32-0049-006
2015-08-12
潍坊市科技发展计划(No:2014zj1058);解放军第89医院科研资助基金(No:yz2013890201)
褚海波,E-mail:haibochuwf@163.com;Tel:0536-8439081;13863679579

