黄韧带骨化病因研究进展
续开亮赵宇李文菁
(1.首都医科大学密云教学医院骨科,北京101500;2.中国医学医学院北京协和医学院北京协和医院骨科,北京100730)
·综述·
黄韧带骨化病因研究进展
续开亮1赵宇2*李文菁2
(1.首都医科大学密云教学医院骨科,北京101500;2.中国医学医学院北京协和医学院北京协和医院骨科,北京100730)
黄韧带骨化(ossification of ligament flavum,OLF)是引起脊髓压迫症的重要原因之一[1,2]。OLF引起脊髓病的最常见症状为下肢运动功能障碍和感觉障碍,可有疼痛、麻木、跛行,甚至可出现大小便障碍等截瘫症状,严重影响患者的生活质量[3]。了解OLF病因可为其相关脊髓疾病的预防和治疗提供理论指导。
OLF的病理改变为软骨内化骨过程,早期为纤维结构排列紊乱,弹性纤维减少,胶原纤维大量增生、肿胀、黏液样变性,进一步发展为黄韧带组织中的未分化间充质细胞软骨性化生形成纤维软骨细胞,继而软骨钙化,随着新生血管长入,最终钙盐结晶体沉着钙化、骨化[4]。骨化的黄韧带往往存在由浅至深的四个移行区[5]:韧带区、纤维软骨区、钙化软骨区、骨化区。任何影响此骨化过程中某个环节的因素均可能成为OLF的原因。OLF的病因尚不清楚,主要分为内因学说和外因学说,以往认为内因更加重要,近年来逐渐认识到外因的重要性[6]。现将近年来有关胸椎OLF病因的相关文献综述如下。
1 外因学说
OLF的外因学说主要包括生物力学改变、解剖与力学因素、退变因素等。
1.1 生物力学改变
后纵韧带骨化(ossification of the posterior longitudinal ligament,OPLL)和OLF被认为是由韧带增厚引起椎管狭窄和脊髓压迫进而导致脊髓病的原因。Kim等[7]根据MRI建立T12~L1脊髓的三维有限元模型,用von-M ises应力分析法研究OPLL和OLF患者脊髓不同类型及不同程度受压时的脊髓内部和横断面的应力分布情况,发现当最大应力增加致脊髓横断面面积减少30%~40%时即可出现脊髓受压症状,即当OPLL者脊髓前后径减少至原来的60%,或OLF者脊髓发生4mm受压形变时。上述结果提示当脊髓受压超过这个阈值时便可引起脊髓受压症状,与临床观察一致。Cai等[8]发现静息状态下OLF细胞中β-链蛋白(β-catenin)、Runx2、Sox9和骨桥蛋白(osteopontin)的mRNA显著高于非OLF细胞。对OLF细胞施加反复张应力后可引起第24小时的βcatenin、Runx2、Sox9和osteopontin的mRNA表达水平显著升高。钙化区周围的肥大软骨细胞为Runx2和osteopontin,免疫阳性。在纤维软骨区未成熟软骨细胞中β-catenin和Sox9的免疫反应显著。认为反复张应力通过介导β-catenin信号系统高表达,继而引起转录因子、生长因子和细胞因子增加,促进软骨细胞分化,进一步促进软骨内骨化的过程。
1.2 解剖与力学因素
OLF好发部位依次是下胸椎、上胸椎和中段胸椎[9],最常见的部位是T10和T11之间,可能是因为此节段所受张应力最大[10]。秦德安等[11]发现胸椎椎板倾斜角(椎板后表面与椎体水平面的夹角)以T7~T10为波谷段,胸椎OLF以T8~T10为好发部位,两者分布具有相关性,椎板倾斜角最小的下胸段与OLF好发部位一致。椎板倾斜角小可能是OLF多发于下胸段的解剖学和力学因素之一。有研究显示腰椎、颈椎的屈伸活动及侧方弯曲幅度比胸椎幅度大,但是轴向旋转活动幅度腰椎最小,胸椎最大,这与OLF好发于胸椎一致,胸椎关节突关节面呈前后位,可允许轴向旋转,这可能是OLF好发于胸椎的另一个解剖因素;研究同时显示旋转幅度越大的椎体,OLF的范围也越大,提示旋转应力是引起OLF的一个重要因素[12,13]。在长期的旋转运动刺激下,关节的稳定性下降,微小运动及微小创伤增加,反复慢性损伤可导致韧带退变,在此基础上发生软骨化和骨化。Li等[14]认为东亚人种发生OLF更多的一个原因可能是由于这些群体更频繁采取蹲的姿势。颈椎较胸椎、腰椎的OPLL发病率高,部分病例可合并OLF,且OLF与OPLL位于相同节段,因此认为OPLL引起的机械应力变化可能是促使OLF的一个因素[15]。但是这无法解释胸椎OLF发病率高而OPLL发病率低的问题,因此OPLL与OLF的因果关系尚不确定。
1.3 退变因素
OLF多发于中老年人,且常合并有颈椎OPLL、弥漫性特发性骨肥厚症(diffuse idiopathic skeletal hyperostosis,DISH)、关节突关节退变等退行性疾病[16,17]。Lang等[17]通过对993例有胸部症状的患者进行CT检查发现发病率最高的年龄组为50~59岁。Liao等[18]发现有症状的OLF节段常合并椎管前方骨赘形成和椎间盘突出,认为下胸椎活动度大,机械应力易对黄韧带造成损伤,继而使黄韧带进行特异的纤维结构重建,促进OLF,因此认为OLF是韧带对微小损伤的一种退变反应。有研究发现退变、突出的椎间盘和关节突关节可通过产生炎性细胞因子影响黄韧带而引起其肥大和骨化[19,20]。
2内因学说
内因学说主要有遗传、饮食、代谢、分子调控、转录因子、炎性细胞因子等因素。
2.1 遗传与饮食因素
OLF的报道世界范围内可见,但最常见于日本人,说明基因可能是OLF的一个影响因素。M obbs和Dvorak[21]报道1例生于低危基因地区的中国OLF患者,其自幼生活在日本,采取日本的生活方式和饮食习惯,提示饮食和生活方式可能是OLF的一个影响因素。颜廷宾等[22]认为人类HLA-DQA*0401与OLF发病呈显著正相关,可能是其易感基因,而HLADQA*0201与OLF发病呈显著负相关,可能是其保护基因。OLF患者的HLA-DQA*0401病因分数大于HLA-DQA*0201预防分数,提示易感基因强于保护基因可能是导致胸椎OLF发病的一个危险因素。Liu等[23]通过研究中国汉族OPLL和OLF患者RUNX2、骨形态发生蛋白-2(bonemorphogenetic protein-2,BMP-2)、COL6A1和维生素D受体(vitam in D receptor,VDR)基因的多态位点,发现病例组和对照组之间Runx2的基因位点RS1321075和RS12333172存在差异。这两个位点均位于6号染色体上,并表现出连锁不平衡。这两个区域中一个是单体型,提示该区域与OPLL和OLF的发病率升高有关,认为RUNX2基因多态性可能跟中国汉族人群的脊柱韧带异位骨化有关,而COL6A1、BMP-2和VDR基因的多态性位点和这些疾病无明显关系。而Kong等[24]发现中国汉族人群染色体21q22.3上COL6A1的单核苷酸多态性与OLF发病关系密切,与Liu等[23]的研究结果不一致,因此COL6A1与OLF的关系尚待明确。
2.2 代谢因素
一系列的激素、维生素、无机盐等代谢异常可能在OLF发病中起重要作用,甲状旁腺激素、胰岛素、脂肪因子、1,25-二羟维生素D和局部生长因子与OLF有关[25]。患有肥胖症、糖尿病、强直性脊柱炎、氟骨症、钙磷代谢异常等代谢性疾病者更易发生OLF[26]。Wang等[27]发现黄韧带中钙(Ca)含量和Ca/镁(Mg)比值在对照组、退变组和骨化组中依次增高,有显著差异;退变组和骨化组中黄韧带的锌(Zn)、锰(Mn)、钼(Mo)含量低,铜(Cu)含量高;骨化组的氟(F)含量显著高于退变组和对照组。这说明Ca的含量变化在OLF中有重要作用,基本代谢元素的在不同组之间的含量变化提示OLF可能是由退变逐渐发展到骨化的过程。Zhang等[28]发现高氟环境刺激大鼠成骨细胞系和培养的成骨样细胞激活,增殖能力增强,cfos、c-jun在mRNA和蛋白质水平的表达增强,提示高氟亦可能影响到黄韧带的骨化过程。M atsui等[29]报道发生低磷抗维生素D佝偻病患者可合并OLF,提示作用于脊柱的机械应力和钙盐沉积增加与胸椎OLF有关。
2.3 分子调控
OLF的发病与一系列的分子调控行为密切相关。Zhong等[30]发现OLF细胞独特地表达骨钙素和Ⅱ型胶原蛋白,而骨钙素是成骨细胞的标志,Ⅱ型胶原蛋白是软骨细胞的标志,说明OLF的细胞中有成骨细胞和软骨细胞的表型特征,即韧带细胞向软骨细胞表型和成骨细胞表型分化,这可能在OLF的起始和发展中起重要作用。BMPs的诱导成骨作用已被广泛研究。脊柱韧带的弹性纤维对反复张应力刺激敏感,张应力可使BMP-2、转化生长因子-β(transform ing grow th factor-β,TGF-β)、血管内皮生长因子(vascular endothelial grow th factor,VEGF)、软骨形成和分化相关转录因子Sox9的表达均明显升高,引起间质成纤维细胞向软骨细胞和骨细胞转化[31]。在张应力刺激下,黄韧带细胞内的碱性磷酸酶(alkaline phosphatase,ALP)活化,成骨细胞发育相关的转录因子Osterix、Runx2的mRNA表达水平明显升高,介导了黄韧带细胞向骨细胞的分化过程。Moon等[32]将腺病毒介导的BMP-2基因转染黄韧带细胞,在应力作用下,黄韧带细胞中胶原Ⅰ、Ⅲ、Ⅴ的基因表达水平增加,TGF-β1水平也有明显的提升,证实经刺激的黄
韧带可通过自分泌和旁分泌BMP的方式诱导周围正常黄韧带细胞向成骨细胞分化。TGF-β1可以介导成纤维细胞样的间充质细胞向黄韧带浸润,同时使成纤维细胞进入非骨化的软骨中,从而介导骨化的发生。BMP信号系统可促进成纤维细胞向成骨细胞转化,Runx2是该信号系统的组成成分[33]。BMP-2与Ⅰ型和Ⅱ型跨膜丝氨酸/苏氨酸激酶受体蛋白形成的异四聚体复合物结合,经BMP激活后,这些受体可使细胞内信号分子Smad1/5/8磷酸化,然后联合Smad4转移到细胞核,与转录因子Runx2发生作用,上调成骨细胞基因的表达[34],介导OLF形成。向软组织内注射BMPs可引起皮下组织的异位骨化。全部的BMP信号系统包含许多重要转录因子的参与,如Dlx5、Dlx3、Runx2、M sx2和Osterix等。但与BMP-2活化相比,单独的Runx2或Osterix不足以使成纤维细胞转化为成骨细胞。Runx2主要与骨分化有关,为参与软骨内骨化和膜内骨化的分化基因的调节所必需。Zhong和Chen[30]发现重组人生长分化因子-5(recombinanthuman grow th differentiation factor5,rhGDF-5)处理使ALP活性和骨钙素的表达增加,呈时间和剂量依赖性,并可诱导矿化结节的形成。rhGDF-5的介导作用与细胞外信号调节激酶1/2(extracellular-signal regulated kinase,ERK1/2)和p38的活化有关,而与JNK无关。应用ERK1/2和p38抑制剂可导致ALP活性和骨钙素蛋白表达的降低,提示rhGDF-5通过激活ERK1/2和p38MAPK途径诱导人黄韧带细胞的成骨分化。
2.4 转录因子
基因背景、机械应力、退变基质、其他因素等可通过影响转录因子的表达来影响OLF过程。一些研究提示控制骨形成的BMP和TGF-β的主要活性是通过与RUNX2相互作用而介导的[34]。当张应力增加,黄韧带中BMP-2、TGF-β和Sox亦增加,成纤维细胞分化为成软骨细胞和成骨细胞,最后韧带骨化形成[31]。Uchida等[5]的研究表明在黄韧带的骨化区有明显的基质变性,并且在骨化斑块和非骨化纤维区之间有一些骨化区的存在。软骨细胞在骨化区分化明显,在钙化区亦可见明显聚集。因此认为在转录因子的影响下,软骨细胞分化在骨化过程中起着重要作用。成纤维细胞转化为成骨细胞,需要关键信号传导通路的活化,包括BMP通路。Runx2被认为是BMP通路的组成部分。Kim等[33]通过腺病毒表达Runx2或BMP-2的方法测定成纤维细胞向成骨细胞转化的过程,发现原代培养的黄韧带细胞中Runx2或BMP-2的表达导致诸多细胞增殖和分化。BMP-2与Runx2的联合作用比单独某一成分作用能更好地促进向成骨细胞分化,表明Runx2和BMP-2通路既有共同的又有独立的靶基因。Runx2和BMP-2联合介导了成纤维细胞样的黄韧带细胞向成骨细胞样细胞的高效转化。
2.5 炎性细胞因子
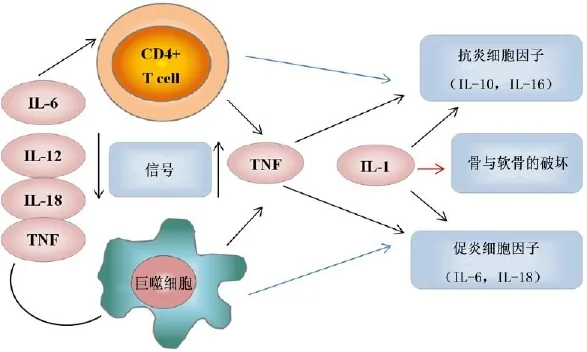
图1 细胞因子和细胞在TNF依赖的细胞因子级联反应中相互作用,显示了TNF在OLF细胞因子网络中的作用[35]
细胞因子是作为细胞之间的信使的小型分泌蛋
白,在很大程度上参与了再生、生长和发育、正常的稳态调节、损伤反应和人体免疫力自我修复的调节。炎性细胞因子,如白细胞介素(interleukin,IL)、肿瘤坏死因子(tumornecrosis factor,TNF)、TGF和趋化因子,是对损伤和感染的免疫反应的一部分,可加重或减轻炎症反应(图1)[35]。促炎性细胞因子与早期反应有关,如IL-1α、IL-1β、IL-6和TNF-α[36]。其他促炎性介质还包括IL-20家族、干扰素-γ(interferon-γ, IFN)、IFN-γ、IL-17、IL-18和多种其他趋化因子的成员。这些细胞因子作为内源性热原(IL-1、IL-6、TNF-α),上调次级介质的合成。促炎性细胞因子可刺激产生急性期蛋白,吸引炎性细胞。与此相反,抗炎细胞因子如IL-4、IL-10、IL-16和TGF-β,可通过抑制促炎性细胞因子的产生或抵消其某些生物学作用,来控制体内炎症反应的幅度。病理学上,钙化和骨化的过程与弹性纤维变性和骨化区炎性细胞因子的显著表达有关,如BMP-2、TGF-β和血管内皮生长因子(vascular endothelial grow th factor,VEGF)[31]。Kang等[20]发现退化的椎间盘可自发产生炎性细胞因子,包括IL-1α、IL-6、TNF-α、PGE2和NO等。这些细胞因子可进一步刺激CD4+T细胞和巨噬细胞,通过改变椎管局部环境影响相邻黄韧带,使黄韧带发生肥厚和骨化。Park等[19]经过体外实验发现分别经炎性细胞因子IL-6、前列腺素E2(prostaglandin E2,PGE2)、TNF-α及NO处理培养的人黄韧带细胞中,Ⅰ、Ⅴ、Ⅺ型胶原蛋白和骨钙素的DNA和mRNA合成显著增加,黄韧带细胞中形成骨结节,说明这些炎性细胞因子可使黄韧带胶原合成和骨形成增加,最终促进黄韧带的肥厚和骨化。而经IL-1α处理的黄韧带细胞中未发现骨结节形成和Ⅰ、Ⅺ型胶原蛋白及骨钙素的DNA和mRNA表达的增加,说明IL-1α对OLF有抑制作用。
3 动物模型研究
Ikegawa[37]经实验研究证实rhBMP-2诱导大鼠发生OLF的过程与临床相似,对大鼠硬膜外应用rh-BMP-2后1周时黄韧带可见骨化,3周、9周时骨化明显增加,组织蛋白H3的修饰和骨形成转录因子(Osterix、Runx2)在骨化黄韧带的纤维软骨区表达,证实重组BMP-2介导的OLF是典型的软骨内骨化。该动物模型可能对进一步研究OLF过程中某些起关键作用的分子有重要意义。组蛋白修饰与OLF密切相关,进一步研究并定量分析这些修饰和特定的成骨基因之间的相关性亦很重要。用脚尖行走的老鼠是研究OPLL的一个动物模型,它们是发生广泛钙化后,跟腱、耳、脊柱韧带等部位会随后发生骨化的自然突变体,这种特征是由纯合子核苷酸焦磷酸酶(一种产生焦磷酸盐的细胞膜酶)基因的无义突变引起的,其作为研究异位钙化和骨化的模型,可进一步被用于研究OLF相关感兴趣基因和其他影响因素[37]。
4 其他因素
血管生成因素可能参与脊柱韧带骨化的发生。正常的韧带中微血管很少,而韧带和骨化的移行部存在丰富的微血管以及CD34+内皮祖细胞[38,39]。Takaishi等[40]认为异位骨化的过程中,新生血管促进了自体源性造血细胞对骨质疏松的填充。而造血干细胞和成骨干细胞/祖细胞可能对脊柱异位骨质增生有促进作用。秦德安等[38]的研究提示变性或骨化韧带的微血管密度均高于正常韧带,而变性与骨化韧带之间微血管的密度则无明显差异,提示血管生成在韧带由正常向变性阶段进展过程中发挥作用,在变性的基础上进而导致韧带的骨化。钙化区肥大软骨细胞通过分泌生长因子调节血管生成,如VEGF,新生血管可增加间质细胞滤过和基质矿化,利于骨化形成。有病例报道提示脊柱后凸和结核后胸椎后凸者发生OLF,故不能排除后凸畸形或其他脊柱畸形可引起OLF的发生[41,42]。软骨发育不全者亦可发生胸椎OLF[43]。
近来证明组织型谷氨酰胺转移酶(tissue transglutam inase,TG2)可直接促进骨基质矿化并在骨化中起重要作用,TG2活性对成骨细胞的分化和矿化的形成至关重要。Yin等[44]发现OLF者的黄韧带细胞具有成骨细胞样活性且BMP-2的mRNA表达增加,与非OLF者相比,细胞TG2的mRNA、蛋白表达水平以及酶活性均升高,认为TG2可能参与OLF的病理过程。
另有体外实验发现在人脊柱韧带中有间充质干细胞(mesenchymalstem cells,MSCs)的存在,虽然从间充质干细胞向成骨细胞分化的具体过程尚未完全阐明,但通过可溶性因子、激素、组织特异性转录因子以及细胞—细胞外基质和细胞—细胞的相互作用可对此过程进行调节[45,46]。通过双重免疫荧光染色可见脊柱韧带的血管周围区域和胶原基质中有MSCs
的免疫定位,在血管周围区域可发现MSCs和周细胞的标记共同表达。与非OLF组相比,OLF组发现散在的韧带基质中有大量新生血管形成,在血管周围存在大量MSCs。OLF组胶原基质内MSCs的数量显著高于非OLF组。OLF者骨化区附近的软骨细胞也见到MSCs标记物的表达,提示间充质干细胞可能通过软骨内骨化促进OLF的异位骨化过程。
综上,OLF的病因及发病机制目前仍未完全明确,各个病因之间的相互联系及主次关系尚不明朗,OLF主要易感基因的确认、发病关键分子的相互作用及主要信号通路的辨识、深入的分子病理学机制等均有待进一步研究和探索,而如何将这些基础研究进展应用于临床实践将是摆在我们面前的又一重大难题。
[1]Ahn DK,Lee S,Moon SH,etal.Ossification of the ligamentum flavum.Asian Spine J,2014,8(1):89-96.
[2]李文菁,赵宇.胸椎黄韧带骨化症合并硬脊膜骨化的研究进展.中华骨科杂志,2013,33(6):670-673.
[3]Kang KC,Lee CS,Shin SK,et al.Ossification of the ligamentum flavum of the thoracic spine in the Korean population.JNeurosurg Spine,2011,14(4):513-519.
[4]Ono K,Yonenobu K,M iyamoto S,etal.Pathology of ossification of the posterior longitudinal ligament and ligamentum flavum.Clin Orthop RelatRes,1999,(359):18-26.
[5]Uchida K,Yayama T,CaiHX,etal.Ossification process involving the human thoracic ligamentum flavum:roleof transcription factors.ArthritisRes Ther,2011,13(5):R144.
[6]Fukuyama S,Nakamura T,Ikeda T,et al.The effect ofmechanical stresson hypertrophy of the lumbar ligamentum flavum.JSpinalDisord,1995,8(2):126-130.
[7]Kim YH,Khuyagbaatar B,K im K.Biomechanical effects of spinal cord compression due to ossification of posterior longitudinal ligament and ligamentum flavum:a finite element analysis.M ed Eng Phys,2013,35(9):1266-1271.
[8]CaiHX,Yayama T,Uchida K,etal.Cyclic tensile strain facilitates the ossification of ligamentum flavum throughβcatenin signaling pathway:in vitro analysis.Spine(Phila Pa 1976),2012,37(11):E639-E646.
[9]Park BC,M inWK,Oh CW,etal.Surgical outcome of thoracic myelopathy secondary to ossification of ligamentum flavum.Joint Bone Spine,2007,74(6):600-605.
[10]Okada K,Oka S,Tohge K,et al.Thoracic myelopathy caused by ossification of the ligamentum flavum.Clinicopathologic study and surgical treatment.Spine(Phila Pa 1976),1991,16(3):280-287.
[11]秦德安,张佐伦,李晓东,等.胸椎椎板倾斜角在胸椎黄韧带骨化中的解剖学意义.中国临床解剖学杂志,2006,24 (6):634-636.
[12]Guo JJ,Luk KD,Karppinen J,et al.Prevalence,distribution,andmorphology of ossification of the ligamentum flavum:a population study of one thousand seven hundred thirty-six magnetic resonance imaging scans.Spine(Phila Pa 1976),2010,35(1):51-56.
[13]Chen J,Wang X,Wang C,etal.Rotationalstress:role in developmentof ossification of posterior longitudinal ligament and ligamentum flavum.Med Hypotheses,2011,76(1):73-76.
[14]Li F,Chen Q,Xu K.Surgical treatmentof 40 patientsw ith thoracic ossification of the ligamentum flavum.JNeurosurg Spine,2006,4(3):191-197.
[15]KotaniY,TakahataM,Abum iK,etal.Cervicalmyelopathy resulting from combined ossification of the ligamentum flavum and posterior longitudinal ligament:report of two cases and literature review.Spine J,2013,13(1):e1-e6.
[16]Guo Q,Ni B,Yang J,etal.Simultaneous ossification of the posterior longitudinal ligament and ossification of the ligamentum flavum causing upper thoracic myelopathy in DISH:case report and literature review.Eur Spine J,2011, 20Suppl2:S195-S201.
[17]Lang N,Yuan HS,Wang HL,et al.Epidem iological survey of ossification of the ligamentum flavum in thoracic spine: CT imaging observation of 993 cases.Eur Spine J,2013,22 (4):857-862.
[18]Liao CC,Chen TY,Jung SM,et al.Surgical experience w ith symptomatic thoracic ossification of the ligamentum flavum.JNeurosurg Spine,2005,2(1):34-39.
[19]Park JO,Lee BH,Kang YM,etal.Inflammatory cytokines induce fibrosis and ossification of human ligamentum flavum cells.JSpinalDisord Tech,2013,26(1):E6-E12.
[20]Kang JD,Georgescu HI,Mc Intyre-Larkin L,etal.Herniated lumbar intervertebral discs spontaneously producematrix metalloproteinases,nitric oxide,interleukin-6,and prostaglandin E2.Spine(Phila Pa 1976),1996,21(3):271-277.
[21]Mobbs RJ,Dvorak M.Ossification of the ligamentum flavum:dietand genetics.JClin Neurosci,2007,14(7):703-705.
[22]颜廷宾,张佐伦,于锡欣,等.胸椎黄韧带骨化与HLADQA1等位基因的相关性研究.中国矫形外科杂志,2002, 10(z2):50-52.
[23]Liu Y,Zhao Y,Chen Y,etal.RUNX2 polymorphisms associated w ith OPLL and OLF in the Han population.Clin Orthop RelatRes,2010,468(12):3333-3341.
[24]Kong Q,Ma X,Li F,etal.COL6A1 polymorphisms associated w ith ossification of the ligamentum flavum and ossification of the posterior longitudinal ligament.Spine(Phila Pa 1976),2007,32(25):2834-2838.
[25]LiH,Jiang LS,Dai LY.Hormones and grow th factors in the pathogenesis of spinal ligament ossification.Eur Spine J,
2007,16(8):1075-1084.
[26]WangW,Kong L,Zhao H,etal.Thoracic ossification of ligamentum flavum caused by skeletal fluorosis.Eur Spine J, 2007,16(8):1119-1128.
[27]Wang Z,Li XD,LiMQ,et al.Changes in basicmetabolic elements associated with the degeneration and ossification of ligament flava.JSpinalCord Med,2008,31(3):279-284.
[28]ZhangWL,CuiYN,Gao S,etal.Expression of proto-oncogenes c-fos and c-jun in osteoblasts activated by excessive fluoride.ZhonghuaYu Fang YiXue Za Zhi,2003,3.4):246-250.
[29]Matsui H,Katoh Y,Tsuji H.Untreated hypophosphatemic vitamin D-resistant ricketsw ith symptomatic ossification of the ligamentum flavum.JSpinalDisord,1991,4(1):110-113. [30]Zhong ZM,Chen JT.Phenotypic characterization of ligamentum flavum cells from patientsw ith ossification of ligamentum flavum.YonseiMed J,2009,50(3):375-379.
[31]Yayama T,Uchida K,Kobayashi S,etal.Thoracic ossification of the human ligamentum flavum:histopathological and immunohistochem ical findings around the ossified lesion.JNeurosurg Spine,2007,7(2):184-193.
[32]Moon SH,Park SR,Kim H,etal.Biologicmodification of ligamentum flavum cellsbymarkergene transferand recombinant human bone morphogenetic protein-2.Spine(Phila Pa1976),2004,29(9):960-965.
[33]K im HN,M in WK,Jeong JH,et al.Combination of Runx2 and BMP2 increases conversion of human ligamentum flavum cells into osteoblastic cells.BMB Rep,2011,44(7): 446-451.
[34]Javed A,Bae JS,Afzal F,etal.Structural coupling of Smad and Runx2 for execution of the BMP2 osteogenic signal.J BiolChem,2008,283(13):8412-8422.
[35]Ren L,Hu H,Sun X,etal.The roles of inflammatory cytokines in the pathogenesis of ossification of ligamentum flavum.Am JTranslRes,2013,5(6):582-585.
[36]Podichetty VK.The aging spine:the role of inflammatory mediators in intervertebral disc degeneration.Cell MolBiol (Noisy-le-grand),2007,53(5):4-18.
[37]Ikegawa S.Animalmodels for bone and joint disease.ttw (tiptoe walking),amodelmouse of OPLL(ossification of the posterior longitudinal ligamentof the spine).Clin Calcium,2011,21(2):294-300.
[38]Qin DA,Zhang ZL,Liu F,etal.Function and clinic significance of angiogensis in spinalossification of ligamentum flavum.JClin Exp Pathol,2006,22(1):69-72.
[39]张鑫.脊柱韧带骨化机制的分子生物学研究进展.中国骨与关节外科,2010,3(5):405-409.
[40]Takaishi H,Shiono Y,Matsumoto M.Updates on ossification of posterior longitudinal ligament.Bonemetabolism in ossification of posterior longitudinal ligament.Clin Calcium,2009,19(10):1442-1447.
[41]Otani K,Aihara T,Tanaka A,etal.Ossification of the ligamentum flavum of the thoracic spine in adult kyphosis.Int Orthop,1986,10(2):135-139.
[42]Chen Y,Lu XH,Yang LL,etal.Ossification of ligamentum flavum related to thoracic kyphosis after tuberculosis:case report and review of the literature.Spine(Phila Pa 1976), 2009,34(1):E41-E44.
[43]Suzuki K,Kanamori M,Nobukiyo M.Ossification of the thoracic ligamentum flavum in an achondroplastic patient:a case report.JOrthopSurg(Hong Kong),2008,16(3):392-395.
[44]Yin X,Chen Z,Guo Z,et al.Tissue transglutam inase expression and activity in human ligamentum flavumcells derived from thoracic ossification of ligamentum flavum. Spine(Phila Pa 1976),2010,35(20):E1018-E1024.
[45]Asari T,Furukawa K,Tanaka S,et al.Mesenchymal stem cell isolation and characterization from human spinal ligaments.Biochem Biophys Res Commun,2012,417(4):1193-1199.
[46]Chin S,Furukawa K,Ono A,et al.Immunohistochem ical localization of mesenchymal stem cells in ossified human spinal ligaments.Biochem BiophysResCommun,2013,436 (4):698-704.
2095-9958(2015)02-0 084-06
10.3969/j.issn.2095-9958.2015.01-017
*通信作者:赵宇,E-mail:zhaoyupumch@163.com

