后路固定融合手术治疗类风湿关节炎继发寰枢关节半脱位
刘世长 汪雷 宋跃明刘立岷 周春光 周忠杰 杨曦
(四川大学华西医院骨科,成都610041)
后路固定融合手术治疗类风湿关节炎继发寰枢关节半脱位
刘世长 汪雷△宋跃明*刘立岷 周春光 周忠杰 杨曦
(四川大学华西医院骨科,成都610041)
背景:类风湿关节炎(RA)是常见的累及颈椎的炎症性疾病,主要表现是寰枢椎半脱位(AAS)、寰枢椎垂直半脱位(VS)和下颈椎半脱位(SAS)。目前累及上颈椎的RA对脊柱外科医师仍是一个挑战,且国内对RA继发AAS的报道较少。
目的:总结后路固定融合术治疗RA继发AAS的临床经验。
方法:2009年3月至2014年5月采用后路固定融合术治疗RA继发AAS患者21例,其中寰枢椎固定融合14例,C1-3悬梁臂支撑固定2例,寰椎后弓切除枕颈融合术3例,RA继发SAS行多节段固定融合2例。其中女19例,男2例;年龄41~75岁,平均(56.8±4.3)岁;病程12~30年,平均(22.7±3.8)年。其中难复性AAS 1例,可复性AAS 20例;单纯AAS 15例,AAS+VS 3例,AAS+SAS 2例,AAS+VS+SAS 1例。按影像学表现分为AAS、VS、SAS。术前、术后采用VAS评分进行疼痛评估,采用Ranawat分级及JOA评分对神经症状进行评估,测量术前、术后寰齿间隙(ADI)和脊髓有效间隙(SAC)。
结果:全部获得随访,随访时间为3~65个月,平均(26.2±10.6)个月。患者术后颈部疼痛症状及神经症状均有明显改善,术后3个月植骨融合率为71%(12/21),术后6个月植骨融合率为100%。术后无一例出现螺钉松动及断裂、肾上腺皮质危象等严重并发症。
结论:对于RA继发AAS的患者需要采取个体化且合理规范的治疗方案,从而提高手术的安全性。
关节炎,类风湿;寰枢关节;脱位;脊柱融合术;颈椎;关节不稳定性
Background:ound:Rheumatoidarthritis(RA)isacommon inflammatorydiseaseinvolvingcervicalspine.Main spinalmanifestations areatlantoaxialsubluxation(AAS),verticalsubluxation(VS)and subaxialsubluxation(SAS).SurgicalmanagementofRA involvinguppercervicalspinesremainsachallenge,and thereare few Chinesearticleson the treatmentofASSrelated toRA.
Objective:tive:To evaluate clinicaloutcomeof instrumented posterior fusion forAAS in RA patients.
Methods:hods:Twenty-one RA patientswho underwent C1-C3 or occipitocervical posterior fusion due to AAS between March 2009 and May 2014 were enrolled in this retrospective study.There were 2 men and 19 women w ith an average age of (56.8±4.3)years(range,41-75 years).The average course of disease was(22.7±3.8)years(range,12-30 years).Atlanto-axial fusion was performed in 14 cases,C1-C3 was fused in 2,posterioratlantalarch excision was done in 3,andmultiple segment fusion was performed in 2.Irreducible AAS occurred in one patient and reducible AAS in 20.The lesions included sim ple AAS(n=15),AAS+VS(n=3)and AAS+SAS(n=2),AAS+VS+SAS(n=1).Pain was evaluated by Visual Analogue Scale(VAS)scores before and after surgery.Ranawat grading scale and Japanese Orthopaedic Association(JOA)scores were used to determ inemyelopathy.Clinical and radiological datawere collected before surgery,at3 and(or)6months after surgery,and at final follow-up.
Results:ults:Theaverage duration of follow-up was(26.2±10.6)months(range,3-65months)in all the patients.All of them had a significantneurological improvementat the last follow-up.The fusion ratewas71%(12/21)at3monthsafter surgery and 100%at6monthsafter surgery.No loosening,breakageoraddisonian crisiswereobserved.
Conclusions:ions:Careful preoperative evaluation and individualized surgical planning should be adopted in patientsw ith AAS secondary to RA.
类风湿关节炎(rheumatoid arthritis,RA)是多关节受累的慢性炎症性疾病,主要累及外周手足小关节及颈椎。颈椎受累节段中又以上颈椎受累最多见,发病率可达到43.6%~86%[1-3],其发病原因主要为侵袭性滑膜炎,并导致关节囊的松弛、小关节的骨质破坏及关节不稳[1,4,5],随着病情的进展可出现寰枢椎半脱位(atlantoaxial subluxation,AAS)、垂直半脱位(vertical subluxation,VS),并进一步导致下颈椎半脱位(subaxial subluxation,SAS)。这些因素可能导致患者出现严重的症状,如枕颈部疼痛、颈部活动受限、四肢感觉和运动功能障碍,甚至出现猝死[6,7]。
后路固定融合术能显著改善RA继发AAS患者的临床症状[2,8-10],与骨折导致AAS的治疗方法有不同之处,本研究回顾性总结后路固定融合术治疗RA继发AAS患者的临床经验,现报告如下。
1 资料与方法
1.1 临床资料
2009年3月至2014年5月采用后路固定融合术治疗RA继发AAS患者21例,其中女19例,男2例;年龄41~75岁,平均(56.8±4.3)岁;病程12~30年,平均(22.7±3.8)年。本组病例包括难复性AAS 1例,可复性AAS 20例;单纯AAS 15例,AAS+VS 3例,AAS+SAS 2例,AAS+VS+SAS 1例。纳入标准:RA继发AAS的患者,并采用1987年美国风湿病学会(the american rheumatism association,ARA)的RA诊断标准;排除标准:既往有颈椎骨折、颈部感染或合并先天性疾病的患者。
1.2 影像学检查
术前常规拍摄手足X线片,以明确RA诊断。术前常规拍摄颈椎正、侧位及开口位X线片,在医师陪同下拍摄颈椎过伸、过屈动力位X线片,以查看寰枢椎的可复性;常规行颈椎三维CT检查查看骨质破坏情况、寰枢椎钉道情况和有无寰枢椎VS,以选择合理的手术方式;常规行椎动脉CTA重建查看有无椎动脉高跨、缺如等畸形,避免出现脑梗死等严重手术并发症;常规拍摄颈椎MRI,因为RA继发AAS患者可能存在寰枢椎局部软组织炎性肿块[11],而CT对其位置及对脊髓的压迫情况的显示并不清晰,避免术中复位时出现脊髓损伤的风险。
1.3 评估方法
诊断成人AAS需测量寰齿间隙(atlas-densinterval, ADI)是否≥3mm(图1A)。诊断寰枢椎VS时予以测量中立位颈椎侧位X线片Ranawat值(侧位X线片上枢椎椎体中心到寰椎前后弓中心连线的沿齿状突纵轴的距离,正常值为男性≥15mm或女性≥13mm,图1B)及Redlund-Johnell值(侧位X线片上枢椎椎体下缘中点到M cGregor线的最短距离,正常值为男性≥34mm或女性≥28mm,图1C)。SAS的诊断标准为侧位X线片上椎体相对于下位椎体的向前滑动超过3mm。术前、术后对疼痛评估采用VAS评分,对神经症状评估采用Ranawat神经损伤分级(Ⅰ级,无神经损害;Ⅱ级,主观症状+反射亢进、感觉障碍;Ⅲa级,客观查体存在肌力下降、锥体束征阳性,但仍可行走;Ⅲb级,四肢麻木无力,不能行走或进食)及JOA评分,测量术前、术后ADI和脊髓有效间隙(space available for the spinal cord,SAC)(图1A)。
1.4 统计学处理
采用SPSS 17.0软件进行统计学分析,计量资料均采用均数±标准差表示。术前及术后的参数比较采用配对t检验及秩和检验,P<0.05为有统计学差异。
2 结果
全部获得随访,随访时间为3~65个月,平均(26.2±10.6)个月。患者术后颈部疼痛症状及神经症状均有明显改善。VAS评分由术前的平均(6.3±0.9)分下降到术后的平均(2.4±0.7)分,末次随访平均(1.4±0.5)分(表1);JOA评分由术前的平均(12.4± 1.8)分增加到术后的平均(13.8±1.6)分,末次随访平均(14.8±0.8)分(表1)。术后Ranawat神经损伤分级
较术前有明显改善(P<0.05,表2)。术后3个月植骨融合率为71%(12例),术后6个月植骨融合率为100%。典型病例见图2、3。
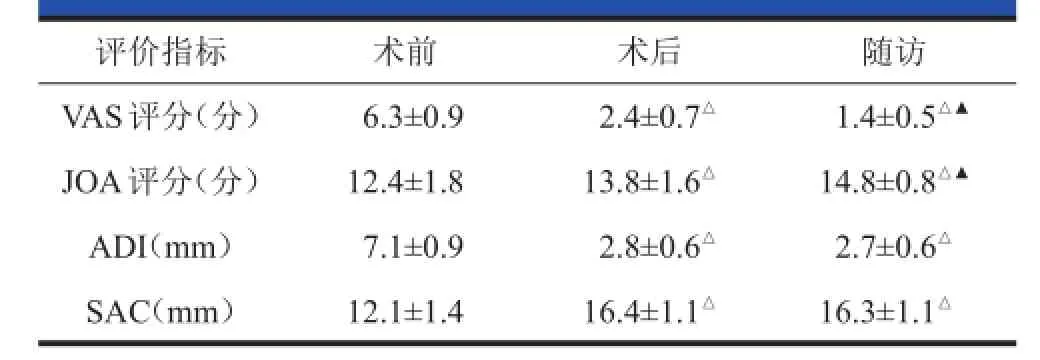
表1 术前、术后及随访的VAS VAS、JOA JOA评分及ADI ADI、SAC SAC(x x±s s)

表2 术前、术后的Ranawat nawat神经损伤分级(例,n n)
3 讨论
RA是一种慢性、全身性疾病,病因尚不完全清楚,多表现为侵袭性的滑膜炎,以累及全身外周小关节、颈椎多见,很少侵犯胸椎及腰椎,其中约30%的患者有颈椎不稳,约50%的患者没有任何症状[12]。其中最常见的受累部位为寰枢关节,主要原因是横韧带及翼状韧带受到血管翳侵犯。Yurube等[3]对最初未继发AAS的140例RA患者进行5年随访后发现,有45例(32.1%)发生了AAS。寰枢关节受累最早可表现为AAS,随着疾病的进展,可逐渐出现寰枢椎VS及SAS。
3.1 手术时机
RA继发AAS患者一般以颈痛及四肢神经症状就诊。因AAS可能引起严重的神经损伤,且有猝死风险,一般认为如存在AAS即为手术指征。Casey等[13]对比了Ranawat神经损伤分级为Ⅲa级(可以行走)和Ⅲb级(不能行走)的患者,认为对于行走困难的患者需尽早手术,以防止可能出现不可逆的神经损害。Paus等[6]通过对532例RA继发颈椎不稳(包括上颈椎及下颈椎不稳)患者的随访发现,RA继发颈椎不稳患者的死亡率远高于一般人群的死亡率,猝死的发生率在RA继发VS患者中更高,及早手术治疗可有效减少颈部局部疼痛及延长存活时间的预期值。
3.2 影像学特点

图2 患者,女,57岁,诊断为AAS+VS,颅骨牵引2周后,行后路枕颈融合术

图3 患者,女,61岁,诊断为AAS+SAS,先予以颈前路椎管减压、植骨融合,再行后路C1-2融合
RA继发AAS患者一般存在较严重的骨质破坏。Nagayoshi等[14]对58例RA继发枕颈部不稳(包括寰枢椎不稳及寰枕关节不稳)患者行三维CT检查发现,所有患者的寰枢关节均有破坏,3/4患者的寰枕关节有破坏,较严重的破坏(寰枕关节Larsen修正分级为Ⅲ级)仅占17%(表3)。Yonezawa等[15]对11例RA患者行颈椎MRI发现,RA继发AAS患者齿状突后肿块可压迫脊髓,可分为三个类型:T2像高信号(血管翳)、T2像低信号(炎性假瘤)、T2像混杂信号(混合型),并发现后路融合术后齿状突肿块逐渐缩小。Zikou等[16]发现88.0%的RA继发颈椎受累患者的齿状突周围有血管翳形成,约23.5%的患者存在齿状突的破坏。

表3 Larsen arsen修正分级(CT CT)
3.3 手术方式
RA继发AAS的治疗方法与其他原因致AAS存在不同之处:①手术风险高,骨质破坏可能较严重,寰枢椎钉道可能受累,神经损伤并发症、椎动脉损伤风险随之增高;②长期服用激素、抗风湿药治疗,术中、术后可能发生肾上腺皮质危象,术后感染率增加。因此,对于RA继发AAS的患者需要采取个体化且合理规范的治疗方案,从而提高手术的安全性。AAS后路手术技术包括后路钢丝技术(包括Gallie、Brooks技术和衍生出的钩板技术)、经关节螺钉技术(Magerl)、椎弓根螺钉技术(Harms)、椎板螺钉技术(Wright)、枕颈融合术。后路固定融合术可防止RA继发AAS患者继发VS及SAS,Yoshida等[2]研究发现相比经关节突螺钉,C1侧块C2椎弓根螺钉可提供更好的C1/2角(AA角,图4A),可减小邻近节段退变及SAS的发生率。
本研究中13例患者寰枢椎受到不同程度的破坏,部分患者骨质破坏严重,寰枢椎特别是寰椎侧块及椎弓根钉道细小。因此对于骨质破坏严重、寰枢椎钉道细小、寰椎后弓细小、椎动脉高跨或畸形的患者,术前仔细准备对手术方式的选择尤其重要。RA继发AAS患者椎动脉可能出现栓塞[17,18],所以术前常规行椎动脉CTA检查确定椎动脉是否存在畸形或异常,以避免脑梗死等严重并发症。本研究结果发现RA继发AAS患者的可复性一般较好,对于15例单纯AAS患者,采用寰椎侧块螺钉枢椎椎弓根螺钉治疗5例,寰椎椎弓根螺钉枢椎椎弓根螺钉治疗6例、寰椎侧块螺钉枢椎椎板螺钉2例及C1-3悬梁臂技术[19]实现短节段的固定治疗2例;对于RA继发寰枢椎VS患者,一般行枕颈融合术,并进行术前颅骨牵引,尽量使齿状突复位,以利于术中操作;如果术前颈椎动力位X线片示寰枢椎关节在颈椎过伸位时对合关系仍欠佳,亦行颅骨牵引1~2周。RA继发AAS的患者中
由于其滑膜受累、骨质破坏明显的独特病理特点,颅骨牵引仍不能有效复位的患者比例相对较低,本研究中仅1例需行前路松解(图5)。如果MRI发现齿状突的后上角对脊髓压迫明显,使脑干延髓角明显减小的患者,后路的单纯复位通常并不能使脊髓压迫改善,可行颅骨牵引或前路松解后再行颅骨牵引从而使齿状突复位。
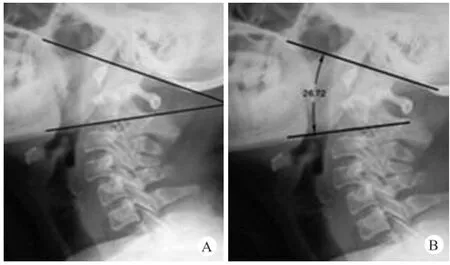
图4 C1/2角(A)和O-C2角(B)示意图
本研究发现,对下颌骨较高的患者行颈高位前入路可对寰枢椎有效暴露及操作,可不经口咽入路松解,从而避免了术前、术中、术后需要的繁琐准备,极少出现手术部位的感染。
3.4 围手术期激素及抗风湿药物的使用

图5 难复性AAS先行颅骨牵引,位置仍差者行前路松解,术中可见寰枢椎间大量瘢痕增生(A),予以松解、去除瘢痕组织(B)
RA继发AAS患者多数有长期服用激素、甲氨蝶呤(MTX)等药物的病史。本研究中多数患者长期服用激素、MTX及来氟米特等药物。Salem等[20]对42年(1952~1994)的文献分析后认为长期服用激素类药物使下丘脑-垂体-肾上腺(HPA)轴受到长期抑制,建议如下:①对于浅表手术,局麻及手术时间应<1 h,可继续服用日常剂量激素;②对于小手术如腹股沟疝,可在手术当日使用25mg氢化可的松或5mg甲泼尼龙;③对于中等手术,如非腹腔镜下胆囊切除术、下肢血管重建术、全膝关节置换手术、结肠切除术、子宫全切等,可在手术当日使用50~75mg氢化可的松或10~15mg甲泼尼龙,术后1~2 d内调整至日常剂量;④对于大手术如心脏手术、胰十二指肠切除术、全结肠直肠切除术等,可在手术日使用100~150mg氢化可的松或20~30mg甲泼尼龙,术后2~3 d内调整至日常剂量。Pieringer等[21]对RA患者围手术期的一项循证医学研究表明对于非生物性的缓解疾病的抗风湿药(disease-modifying antirheumatic drugs,DMARD)、MTX可继续使用,不能停用激素类药物,柳氮磺胺吡啶、咪唑硫嘌呤需在手术当日停用;羟化氯喹及抗肿瘤坏死因子α类制剂大多认为安全;对于生物性DMARD如阿巴他塞(abatacept)、阿达木单抗(adalimumab)、依那西普(etanetcept)等,目前无相关数据。DelOlmo等[22]认为可以继续使用MTX或来氟米特,但有高龄、糖尿病、肾衰竭、长期中量或大量服用激素、贫血等危险因素的患者需慎用。
根据预估的手术时间长短,围手术期需在应用患者日常量激素的基础上,常规加用氢化可的松75~125mg,术后2~3 d内调整至日常剂量,MTX及来氟米特可按术前量继续使用。此组患者均无切口感染、肾上腺皮质危象的发生。
3.5 术后SAS SAS的发生
在上颈椎手术(寰枢椎融合或枕颈融合)术后,可能会发生SAS。Ishii等[23]及Kato等[24]发现C1/2角(AA角,图4A)的过度矫正、术中操作不当或Magerl技术本身易发生C2-3的融合,是RA继发AAS患者行寰枢椎融合术后发生SAS的危险因素。另外,OC2角(C2下终板的连线与M cGregor线的夹角,图4B)在上颈椎后路固定中也有重要的作用。Izeki等[25]认为枕颈融合术后O-C2角决定了术后是否会出现呼吸困难,O-C2角的减小使上颌骨屈曲,从而使下颌骨连带舌根后移,引起咽部狭窄。另外,Matsunaga等[26]测量了正常人群不同年龄、性别的O-C2角,发现减小的O-C2角(负值)SAS的发生率明显高于增大的OC2角或正常的O-C2角。本研究最长达65个月的随访过程中,尚未发现术后SAS的发生。
3.6 是否需融合至枕骨
Werle等[27]通过对46例RA继发AAS行寰枢椎融合的患者进行平均9.4年(5~14年)的随访发现,术后寰枕关节受侵犯的可能性较小,因而认为即使炎症水平较高,仍推荐寰枢椎融合而不是枕颈融合。有学者认为对于未出现寰枢椎VS的患者,仍推荐寰枢椎融合而不是枕颈融合[7,28,29]。本研究在对行寰枢椎融合术后患者的随访中也发现,寰枢椎融合术后枕
颈关节的退变及RA对枕颈关节的破坏并不显著。
4 结论
综上,对于RA继发AAS的患者需要采取个体化且合理规范的治疗方案,从而提高手术的安全性,对于AAS患者应早期手术治疗。因RA继发AAS患者有骨质破坏、椎动脉可能受累等特点,术前对于难复性的AAS,可行颅骨牵引复位或前路松解,术前通过三维CT及CTA检查观察局部骨质及椎动脉情况。术中、术后备氢化可的松为防止肾上腺皮质危象的发生做准备,对围手术期安全有重要影响。术中对O-C2角的重视可减少术后吞咽困难及下颈椎退变的发生;对于无寰枢椎VS的患者,行寰枢椎融合而不行枕颈融合。
[1]Ahn JK,Hwang JW,Oh JM,etal.Risk factors for development and progression of atlantoaxial subluxation in Korean patientsw ith rheumatoid arthritis.Rheumatol Int,2011,31 (10):1363-1368.
[2]Yoshida G,Kam iya M,Yukaw a Y,et al.Rheumatoid verticaland subaxialsubluxation can be prevented by atlantoaxialposterior screw fixation.Eur Spine J,2012,21(12):2498-2505.
[3]Yurube T,SumiM,Nishida K,etal.Incidence and aggravation of cervical spine instabilities in rheumatoid arthritis:a prospectivem inimum 5-year follow-up study of patients initially w ithout cervical involvement.Spine(Phila Pa 1976), 2012,37(26):2136-2144.
[4]VeselaM,Stetkarova I,Lisy J.Prevalenceof C1/C2 involvement in Czech rheumatoid arthritis patients,correlation of pain intensity,and distanceof ventral subluxation.Rheumatol Int,2005,26(1):12-15.
[5]Neva MH,Isomäki P,Hannonen P,et al.Early and extensive erosiveness in peripheral joints predicts atlantoaxial subluxations in patientsw ith rheumatoid arthritis.Arthritis Rheum,2003,48(7):1808-1813.
[6]Paus AC,Steen H,Røislien J,et al.Highmortality rate in rheumatoid arthritiswith subluxation of the cervical spine: a cohort study of operated and nonoperated patients.Spine (Phila Pa1976),2008,33(21):2278-2283.
[7]Matsunaga S,Sakou T,Onishi T,etal.Prognosis of patients w ith upper cervical lesions caused by rheumatoid arthritis: comparison of occipitocervical fusion between c1 laminectomy and nonsurgicalmanagement.Spine(Phila Pa 1976), 2003,28(14):1581-1587.
[8]Uehara M,Takahashi J,Ogihara N,et al.Mid-term results of computer-assisted cervical reconstruction for rheumatoid cervicalspines.JOrthop Sci,2013,18(6):916-925.
[9]M iyamoto H,Sum iM,Uno K.Outcome of surgery for rheumatoid cervical spine at one institute over three decades. Spine J,2013,13(11):1477-1484.
[10]Sugimoto Y,Tanaka M,Nakanishi K,et al.Assessing the rangeof cervical rotation in patientsw ith rheumatoid arthritis after atlantoaxial screw fixation using axial CT.Spine (Phila Pa 1976),2007,32(21):2318-2321.
[11]MagarelliN,Simone F,Amelia R,etal.MR imaging of atlantoaxial joint in early rheumatoid arthritis.Radiol Med, 2010,115(7):1111-1120.
[12]Mackenzie AH,Scherbel AL.Management of rheumatoid arthritis in the surgical patient.Orthop Clin North Am, 1971,2(1):277-299.
[13]Casey AT,Crockard HA,Bland JM,et al.Surgery on the rheumatoid cervical spine for the non-ambulantm yelopathic patient-too much,too late?Lancet,1996,347(9007): 1004-1007.
[14]Nagayoshi R,IjiriK,Takenouchi T,et al.Evaluation of occipitocervical subluxation in rheumatoid arthritis patients, using coronal-view reconstructive computed tomography. Spine(Phila Pa 1976),2009,34(24):E879-E881.
[15]Yonezawa I,Okuda T,Won J,et al.Retrodentalmass in rheumatoid arthritis.J Spinal Disord Tech,2013,26(2): E65-E69.
[16]Zikou AK,Argyropoulou MI,A lamanos Y,etal.Magnetic resonance imaging findings of the cervical spine in patients w ith rheumatoid arthritis.A cross-sectional study.Clin Exp Rheumatol,2005,23(5):665-670.
[17]Oshima K,Sakaura H,IwasakiM,etal.Repeated vertebrobasilar thromboembolism in a patientw ith severe upper cervical instability because of rheumatoid arthritis.Spine J, 2011,11(2):e1-e5.
[18]Fujiwara H,Kaito T,Makino T,et al.Positional occlusion of the vertebral artery in a case of rheumatoid atlantoaxial subluxation presenting with multiple cerebral and cerebellar infarction.Mod Rheumatol,2012,22(4):605-609.
[19]Liu X,Liu H,Li T,et al.Treatmentof irreducible old atlantoaxial subluxation w ith cable-dragged reduction and cantilever beam internal fixation.Spine(Phila Pa 1976),2011, 36(15):E983-E992.
[20]Salem M,Tainsh RE Jr,Bromberg J,et al.Perioperative glucocorticoid coverage.A reassessment 42 years after emergenceof a problem.Ann Surg,1994,219(4):416-425.
[21]Pieringer H,Stuby U,Biesenbach G.Patientsw ith rheumatoid arthritis undergoing surgery:how should we dealw ith antirheumatic treatment?Sem in Arthritis Rheum,2007,36 (5):278-286.
[22]Del Olmo L,Hernández B,Galindo-Izquierdo M,et al. [Peri-operativemanagementof diseasemodifying anti-rheumatic drugs:recommendations based on a meta-analysis]. Rev Esp CirOrtop Traumatol,2012,56(5):393-412.
[23]Ishii K,Matsumoto M,TakahashiY,etal.Risk factors for development of subaxial subluxations follow ing atlantoaxi-
alarthrodesis for atlantoaxialsubluxations in rheumatoid arthritis.Spine(Phila Pa 1976),2010,35(16):1551-1555.
[24]Kato Y,Itoh T,Kanaya K,etal.Relation between atlantoaxial(C1/2)and cervicalalignment(C2-C7)angleswith Magerl and Brooks techniques for atlantoaxial subluxation in rheumatoid arthritis.JOrthop Sci,2006,11(4):347-352.
[25]IzekiM,Neo M,Ito H,etal.Reduction of atlantoaxial subluxation causes airway stenosis.Spine(Phila Pa 1976), 2013,38(9):E513-E520.
[26]Matsunaga S,OnishiT,Sakou T.Significanceof occipitoaxial angle in subaxial lesion after occipitocervical fusion. Spine(Phila Pa1976),2001,26(2):161-165.
[27]Werle S,EzzatiA,ElSaghir H,et al.Is inclusion of the occiputnecessary in fusion for C1-2 instability in rheumatoid arthritis?JNeurosurg Spine,2013,18(1):50-56.
[28]Matsunaga S,Ijiri K,Koga H.Results of a longer than 10-year follow-Up of patientswith rheumatoid arthritis treated by occipitocervical fusion.Spine(Phila Pa 1976),2000,25 (14):1749-1753.
[29]Werle S,EzzatiA,ElSaghir H,et al.Is inclusion of the occiputnecessary in fusion for C1 instability in rheumatoid arthritis?JNeurosurgery Spine,18(1):50-56.
Instrumented posterior fusion for atlantoaxial subluxation due to rheumatoid arthritis
LIU Shichang,WANG Lei△,SONGYuem ing*,LIU Lim in,ZHOU Chunguang,ZHOU Zhongjie,YANG Xi
(Departmentof Orthopedics,WestChina Hospital,Sichuan University,Chengdu 610041,China)
ords:Arthritis,Rheumatoid;Atlanto-Axial Joint;Dislocations;Spinal Fusion;CervicalVertebrae;Joint Instability
2095-9958(2015)06-0 202-07
10.3969/j.issn.2095-9958.2015.03-003
△共同第一作者
*通信作者:宋跃明,E-mail:sym_cd@163.com

