HO-1对脂多糖诱导大鼠肝细胞内质网应激的作用
王艳莎,季英磊,王涛,吴林琳,费成平,刘夷嫦,谷振勇
(南通大学医学院法医学系,江苏南通 226001)
·论著·
HO-1对脂多糖诱导大鼠肝细胞内质网应激的作用
王艳莎,季英磊,王涛,吴林琳,费成平,刘夷嫦,谷振勇
(南通大学医学院法医学系,江苏南通 226001)
目的探讨抗氧化蛋白血红素氧合酶-1(heme oxygenase-1,HO-1)对脂多糖(lipopolysaccharide,LPS)诱导大鼠肝细胞内质网应激的影响。方法大鼠正常肝细胞系BRL细胞培养,筛选有效HO-1 siRNA。用LPS、LPS+HO-1 siRNA、HO-1 siRNA和PBS溶剂分别处理大鼠肝细胞。用台盼蓝拒染实验检测细胞活力,Hoechst 33258荧光染色检测细胞凋亡,Western印迹法检测GRP78、CHOP、caspase-12以及HO-1蛋白表达。结果LPS能剂量依赖和时间依赖性诱导大鼠肝细胞HO-1蛋白表达上调,引起GRP78、CHOP和caspase-12蛋白表达增高,细胞活力降低和细胞凋亡率增高;HO-1 siRNA预处理明显抑制LPS对HO-1蛋白表达上调的诱导作用,并加剧LPS引起的内质网应激和细胞损伤。结论HO-1抑制LPS诱导大鼠肝细胞内质网应激介导的细胞损伤。
法医病理学;RNA,小分子干扰;内质网;应激;脂多糖类;血红素氧合酶-1;肝细胞;大鼠
在法医学鉴定中,大面积软组织挫压伤引起外伤性多器官功能障碍综合征(traumatic multiple organ dysfunction,T-MODS),进而导致死亡发生的案例时有发生。研究外伤引起器官实质细胞损伤发生的分子机制有助于揭示外伤与死亡之间在病理学上的因果关系和判断死亡性质。研究[1]显示,外伤应激能引起急性肝损伤,氧化应激可能是重要发生环节。持续而严重的内质网应激引起细胞死亡、诱导炎症反应[2],内质网应激介导的细胞凋亡是脂多糖(lipopolysaccharide,LPS)引起急性肝细胞损伤的重要发病途径[3]。血红素氧合酶-1(heme oxygenase-1,HO-1)是一种应激反应蛋白[4],具有抗氧化损伤、抗凋亡和抗感染等细胞保护作用[5-7],HO-1在MODS大鼠肝组织中表达上调[8]。本实验采用HO-1小干扰RNA(small interfering RNA,siRNA)技术初步探讨HO-1对LPS诱导培养的大鼠肝细胞内质网应激的影响。
1 材料与方法
1.1 试剂与仪器
大鼠正常肝细胞系BRL购自中国科学院上海细胞研究所细胞库。LPS购自美国Sigma公司;RPMI 1640培养液、胎牛血清购自美国HyClone公司;青霉素、链霉素、RIPA裂解液、蛋白酶抑制剂PMSF、BCA蛋白浓度测定试剂盒、Hoechst染色试剂盒购自上海碧云天生物公司;兔抗大鼠HO-1多克隆抗体购自美国Santa Cruz公司;actin小鼠单克隆抗体购自美国Abmart公司;辣根过氧化物酶(HRP)标记的羊抗小鼠IgG、辣根过氧化物酶(HRP)标记的羊抗兔IgG购自美国Fermentas Life Sciences公司;GRP78多克隆兔抗大鼠抗体、CHOP多克隆兔抗大鼠抗体和caspase-12多克隆兔抗大鼠抗体购自美国Santa Cruz公司;ECL化学发光显色液购自美国Bio-Rad公司;siRNA转染LipofectamineTM2000试剂盒购自美国Invitrogen公司。
3对HO-1 siRNA及对照siRNA序列由中国百奥迈科生物技术有限公司设计与合成,HO-1 siRNA-1上游引物5′-CAGAUCAGCACUAGUUCAU-3′,下游引物5′-AUGAACUAGUGCUGAUCUG-3′;HO-1 siRNA-2:上游引物5′-GGAACUUUCAGAAGGGUCA-3′,下游引物5′-UGACCCUUCUGAAAGUUCC-3′;HO-1 siRNA-3:上游引物5′-GAUACUACCUCUGCAGAGA-3′,下游引物5′-UCUCUGCAGAGGUAGUAUC-3′;阴性对照:上游引物5′-UUCUCCGAACGUGUCACGU-3′,下游引物5′-ACGUGACACGUUCGGAGAA-3′。其他试剂为国产分析纯。
3110型细胞培养箱购自美国Thermo公司;基础型稳压电泳仪、Mini-PROTEAN4型垂直电泳槽、Tras-Blot SD半干转印槽、ChemiDoc XRS型凝胶电化学发光成像系统、Image Lab图像分析系统购自美国Bio-Rad公司;Countess全自动细胞计数仪购自美国Invitrogen公司;Microfuge 22R台式冷冻离心机购自美国Beckman公司;BX51型倒置荧光显微镜购自日本OLYMPUS公司。
1.2 细胞培养及分组处理
BRL细胞置于37℃、5%CO2培养箱中用RPMI 1640完全培养液(含10%胎牛血清、青霉素100U/mL、链霉素100U/mL)培养,每2d传代一次。细胞贴壁覆盖70%~80%时进行实验。
为了检测LPS诱导HO-1蛋白表达的量效和时效关系,分别用0.1、1、10、100mg/L LPS溶液处理细胞12h及10mg/L LPS处理细胞4、8、12、24h,LPS用PBS溶解,以PBS溶剂作为对照,在量效实验中用0mg/mol表示,在时效实验中用0h表示。为了检测HO-1的作用,首先筛选有效的HO-1 siRNA序列,分为HO-1 siRNA组、HO-1 siRNA+LPS组、LPS组、PBS溶剂对照组。HO-1 siRNA+LPS组中HO-1 siRNA预处理24h,再给予10mg/L LPS继续处理细胞12h。每组3复孔。
1.3 Western印迹法检测蛋白表达
将对数生长期的BRL细胞接种于6孔板,根据实验要求处理细胞,用PBS溶液洗涤,RIPA裂解液(200 μL/孔,每100 μL含1 μL蛋白酶抑制剂PMSF)充分裂解细胞,将混合物收集至微量离心管,4℃,21920×g离心15min,上清液即为总蛋白。用BCA法进行蛋白定量。各组取30μg样品蛋白与相应体积的上样缓冲液混匀,煮沸变性,经12%Tris-甘氨酸十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,采用半干式电转移(Tras-Blot SD半干转印槽)至PVDF膜,用5%脱脂奶粉-TBST液室温封闭PVDF膜2h,分别加入HO-1抗体(1∶100)、GRP78抗体(1∶200)、CHOP抗体(1∶200)和caspase-12抗体(1∶200),4℃孵育过夜,TBST振荡洗膜后,加入1∶5 000稀释的HRP标记的羊抗兔IgG二抗,室温孵育2 h,TBST洗膜,ECL化学发光法显色。同时以actin作为内参照。Bio-Rad凝胶成像系统采集图片,Image Lab图像分析系统进行分析,以目的蛋白与内参的光密度比值作为蛋白的相对表达量。
1.4 台盼蓝拒染实验检测细胞活力
取对数生长期BRL细胞接种于6孔板,经过相应处理后,胰酶消化制备成单细胞悬液。10μL悬液与0.4%台盼蓝染液1∶1混合均匀,将10μL混合液加入计数玻片,插入全自动细胞计数仪,调焦至最清晰,记录活细胞数、死细胞数和细胞活力。细胞活力用百分比表示。
1.5 Hoechst 33258荧光染色法观察细胞凋亡
取对数生长期的BRL细胞接种于12孔板,根据实验要求处理细胞,PBS溶液洗涤细胞,用4%多聚甲醛溶液室温固定15 min,4℃、避光条件下,5 mg/L Hoechst 33258染色液作用15 min,在倒置荧光显微镜蓝光下观察、摄片。正常细胞核呈弥漫均匀的低强度荧光,凋亡细胞核呈浓染致密固缩状态或颗粒状荧光。随机选取视野在荧光显微镜下摄片。然后,随机选取相同大小的视野,根据细胞形态及荧光强度,统计凋亡细胞,计算细胞凋亡率。
1.6 HO-1 siRNA干扰
转染前一天将对数生长期细胞接种于6孔板中培养,细胞汇合度达到30%~50%时进行转染。为了筛选特异性高的HO-1 siRNA,先将稀释好的3对HO-1 siRNA、阴性对照siRNA和稀释好的转染载体LipofectamineTM2000分别在室温孵育5 min,再将转
染载体与前二者分别混合,室温孵育20 min,以便siRNA-LipofectamineTM2000复合物形成。将准备进行干扰的细胞取出,置于RPMI 1640培养液中,然后加入siRNA-LipofectamineTM2000复合物,4~6 h后,换完全培养液,继续干扰至24h。然后进行染色并检测HO-1蛋白表达量的变化。
1.7 统计学方法
2 结果
2.1 LPS诱导大鼠肝细胞HO-1表达上调
PBS溶剂处理的大鼠肝细胞存在低水平HO-1蛋白表达。与PBS溶剂处理比较,用0.1、1、10、100mg/L LPS处理12h,大鼠肝细胞HO-1表达呈剂量依赖性上调(P<0.05);10 mg/L LPS处理4、8、12、24 h,大鼠肝细胞HO-1表达呈时间依赖性上调(P<0.05,表1~2)。
2.2 LPS诱导大鼠肝细胞内质网应激和细胞损伤
本实验结果显示,与对照组比较,10mg/L LPS引起大鼠肝细胞内质网应激标志蛋白GRP78和内质网应激介导细胞凋亡标志性蛋白CHOP和caspase-12表达明显上调(表3)。
与对照组比较,10 mg/L LPS引起大鼠肝细胞细胞活力明显降低(P<0.05),且细胞凋亡率明显增高(P<0.05,图1,表4)。
表1 不同质量浓度LPS处理12h大鼠肝细胞HO-1的表达变化(n=3,)
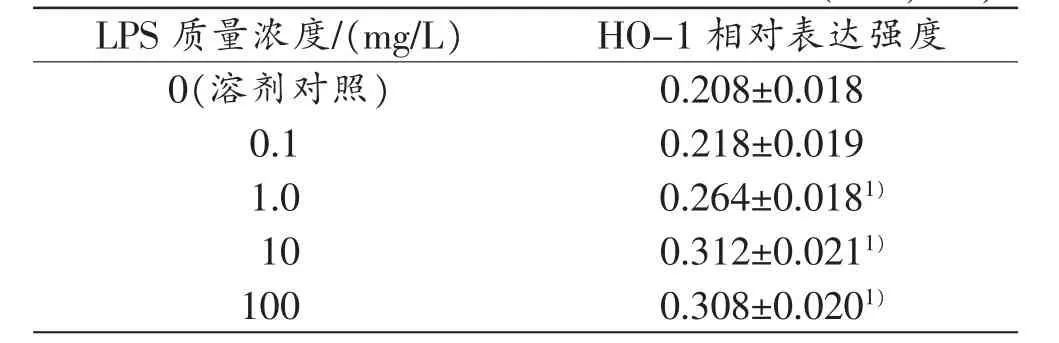
表1 不同质量浓度LPS处理12h大鼠肝细胞HO-1的表达变化(n=3,)
注:1)与对照组比较,P<0.05
LPS质量浓度/(mg/L)HO-1相对表达强度0(溶剂对照)0.208±0.018 0.10.218±0.019 1.00.264±0.0181)100.312±0.0211)1000.308±0.0201)
表2 10mg/L LPS处理不同时间大鼠肝细胞HO-1的表达变化(n=3,)
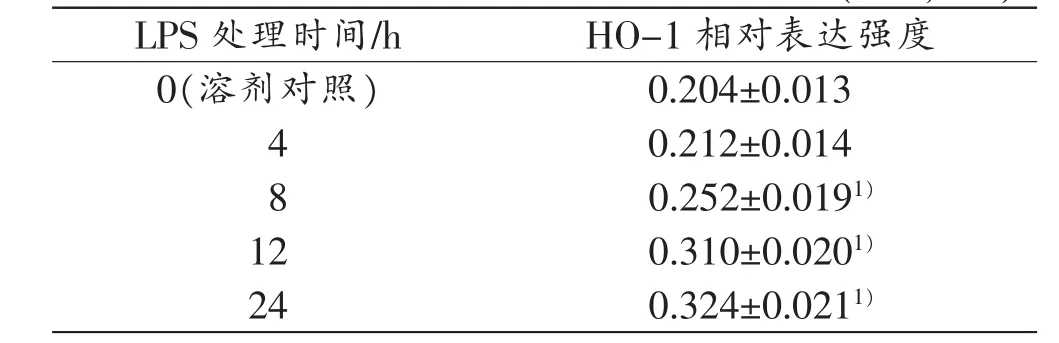
表2 10mg/L LPS处理不同时间大鼠肝细胞HO-1的表达变化(n=3,)
注:1)与对照组比较,P<0.05
LPS处理时间/hHO-1相对表达强度0(溶剂对照)0.204±0.013 4 0.212±0.014 8 0.252±0.0191)120.310±0.0201)240.324±0.0211)
表3 HO-1 siRNA对LPS诱导大鼠肝细胞HO-1、GRP78、CHOP和caspase-12蛋白表达的影响(n=3,)
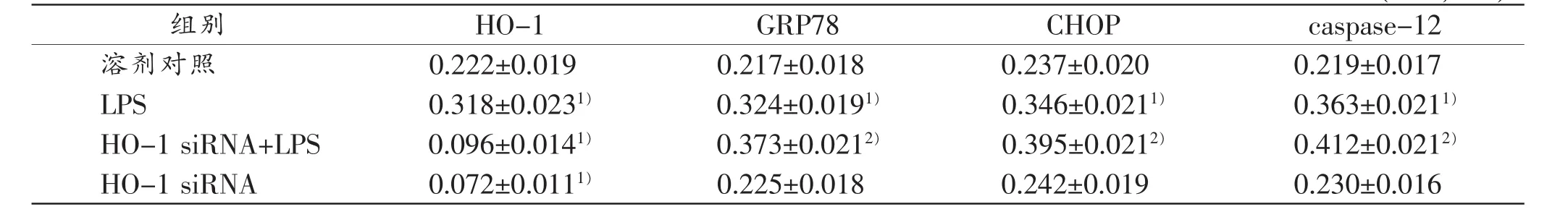
表3 HO-1 siRNA对LPS诱导大鼠肝细胞HO-1、GRP78、CHOP和caspase-12蛋白表达的影响(n=3,)
注:1)与溶剂对照组比较,P<0.05;2)与LPS组比较,P<0.05
组别HO-1GRP78CHOPcaspase-12溶剂对照0.222±0.0190.217±0.0180.237±0.0200.219±0.017 LPS0.318±0.0231)0.324±0.0191)0.346±0.0211)0.363±0.0211)HO-1 siRNA+LPS0.096±0.0141)0.373±0.0212)0.395±0.0212)0.412±0.0212)HO-1 siRNA0.072±0.0111)0.225±0.0180.242±0.0190.230±0.016

图1 HO-1 siRNA对LPS诱导大鼠肝细胞凋亡的影响免疫荧光染色×200
表4 HO-1 siRNA对LPS诱导12h后大鼠肝细胞活力及凋亡率的影响(n=3,,%)
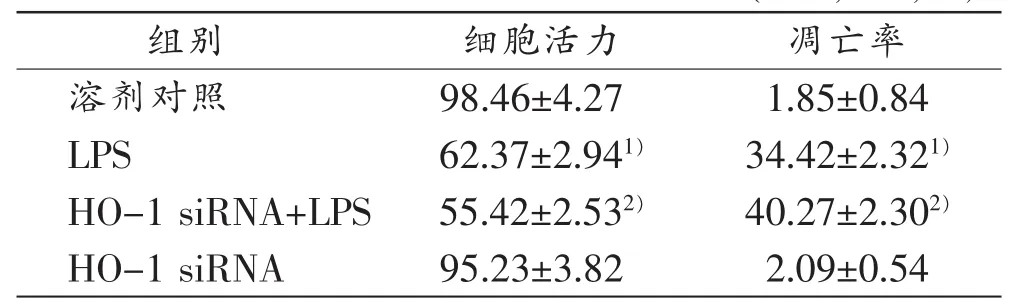
表4 HO-1 siRNA对LPS诱导12h后大鼠肝细胞活力及凋亡率的影响(n=3,,%)
注:1)与对照组比较,P<0.05;2)与LPS组比较,P<0.05
组别细胞活力凋亡率溶剂对照98.46±4.271.85±0.84 LPS62.37±2.941)34.42±2.321)HO-1 siRNA+LPS55.42±2.532)40.27±2.302)HO-1 siRNA95.23±3.822.09±0.54
2.3 HO-1 siRNA明显抑制LPS引起大鼠肝细胞HO-1表达上调
为了筛选特异性高的HO-1 siRNA,实验先用3对HO-1 siRNA分别预处理静息的大鼠肝细胞24h,然后检测HO-1蛋白表达量的变化。结果显示,HO-1 siRNA-2明显抑制HO-1蛋白表达,与转染载体比较,HO-1蛋白表达下调了75%(图2),阴性对照siRNA与转染载体比较HO-1蛋白表达变化不大。故选择
HO-1 siRNA-2进行后续实验。
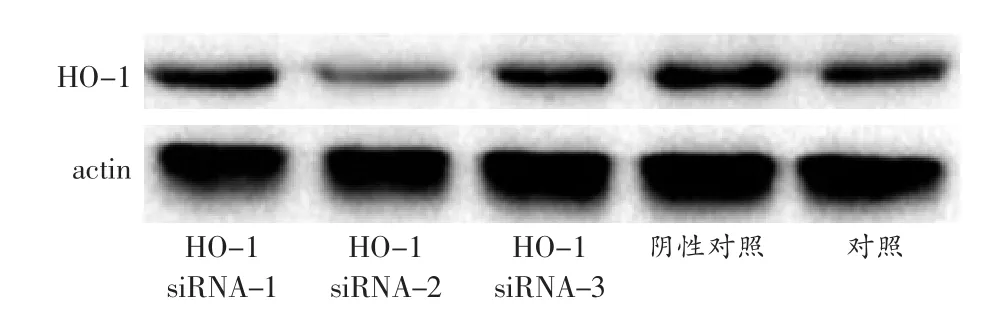
图2 3对HO-1 siRNA特异性序列筛选的电泳图
用HO-1 siRNA-2预处理细胞24 h后,加入10 mg/L LPS继续处理细胞12 h,然后检测HO-1蛋白表达量。结果显示,HO-1 siRNA明显抑制LPS引起的大鼠肝细胞HO-1表达上调(P<0.05,表3)。
2.4 HO-1 siRNA加剧LPS诱导大鼠肝细胞内质网应激和细胞损伤
HO-1 siRNA预处理24h后,LPS引起大鼠肝细胞内质网应激标志性蛋白GRP78和内质网应激介导细胞凋亡标志性蛋白CHOP和caspase-12蛋白表达均进一步明显上调,明显高于单独LPS作用的效应(P< 0.05,表3)。与LPS单独作用比较,HO-1 siRNA+LPS处理的大鼠肝细胞细胞活力进一步降低(P<0.05)、细胞凋亡率增高(P<0.05),而单独HO-1 siRNA处理对大鼠肝细胞细胞活力、细胞凋亡率无明显影响(表4)。
3 讨论
T-MODS是机械性损伤引起机体死亡发生的并发症之一。T-MODS死亡案件的特点有:外伤(特别是大面积软组织外伤)未直接伤及机体重要器官,外伤程度貌似轻微,外伤后迁延一段时间死亡才发生,期间往往接受了临床治疗,或因外伤后免疫功能降低、继发了感染等多种介入因素,这导致判断死因、死亡方式乃至案件性质出现困境。判断T-MODS致死的前提条件在于,评估外伤激活或诱导受伤机体发生异常的病理过程(如过度的炎症反应)是死亡发生的主要因素,应指出这些机体异常的病理过程往往是非特异性的。因此,探索生命重要器官损伤和实质细胞损伤乃至细胞死亡发生机制,对评估和判断机体死亡性质具有积极意义。研究[3]表明,LPS能够剂量和时间依赖性地诱导大鼠肝细胞内质网应激及内质网应激介导的肝细胞损伤。本实验发现,LPS在通过内质网应激介导细胞凋亡途径引起大鼠肝细胞损伤的同时,还能诱导大鼠肝细胞HO-1蛋白表达上调,而HO-1表达上调具有抑制内质网应激介导的大鼠肝细胞凋亡、发挥细胞保护作用。
HO-1是相对分子质量为32000的应激蛋白,在氧气和NADPH存在的条件下,HO-1降解血红素,生成等摩尔的胆绿素、游离铁和一氧化碳(CO),其中CO和胆绿素的衍生物胆红素具有抗氧化效应,而游离铁能通过Fenton反应生成氧化能力更强的羟自由基,加剧氧化损伤。新近研究[9]显示,细胞铁代谢或铁稳态异常可能是细胞死亡的关键环节。Liu等[10]报道内质网应激诱导剂能激活抗氧化元件,引起培养的血管平滑肌细胞HO-1表达上调,HO-1表达通过CO而减轻内质网应激引起的血管平滑肌细胞凋亡。Kim等[11]报道HO-1的催化产物之一CO能通过内质网应激下游PERK通路激活转录因子Nrf 2,进而诱导血管内皮细胞HO-1表达增加。Chung等[12]也报道,外源性CO能将增强培养的肝细胞肝癌细胞系HepG2细胞PERK,减轻IRE1和ATF6通路,仅仅PERK途径参与介导CO对内质网应激诱导剂引起C反应蛋白表达的抑制作用。Lin等[13]报道脂质过氧化损伤产物4-HNE能激活HepG2细胞内质网应激下游的PERK、IRE1和ATF6通路并引起HO-1表达增加。同样在HepG2细胞,葡萄糖剥夺能够引起内质网应激但HO-1表达无明显变化[14],而无氧酵解产物琥珀酸可能是缺血再灌注损伤的关键物质。在培养的人纤维肉瘤细胞系HT1080细胞,内质网应激源性活性氧参与介导HO-1蛋白表达[15]。内质网应激下游的非折叠蛋白反应信号途径介导了HO-1蛋白表达上调[10-13],并且细胞类型不同,非折叠蛋白反应的不同信号途径有别。也有报道[14]内质网应激下游信号不参与引起HO-1表达。本实验发现,LPS在启动大鼠肝细胞内质网应激介导的细胞凋亡的同时也能诱导HO-1表达上调,后者发挥细胞保护的作用。HO-1抑制内质网应激的机制可能有:HO-1本身是分布于内质网的应激蛋白,具有GRP78等分子伴侣的功能,有助于促进错误折叠或未折叠的蛋白质恢复正常的构象;HO-1具有抗氧化能力,能调节内质网的氧化还原稳态,营造适合新合成蛋白质分子折叠的氧化还原微环境;HO-1可能通过偶联线粒体生物合成、减轻内质网应激引起的细胞死亡[16],通过增强自噬而抑制性调节细胞死亡[17]。以往实验[18]发现,抗氧化剂和ROS清除剂NAC减轻了LPS引起的大鼠肝细胞内质网应激,ROS可能参与介导HO-1蛋白表达上调。最近还发现,LPS能剂量依赖性地诱导大鼠肝细胞产生气体信使分子硫化氢增多,外源性硫化氢预适应或后适应均能显著上调LPS诱导的大鼠肝细胞HO-1蛋白表达[19],硫化氢预适应能减轻而其后处理则加剧LPS引起的大鼠肝细胞内质网应激[20-21],这些实验结果提示,大鼠肝细胞HO-1表达上调很可能是内质网应激的上游事件。值得指出,HO-1属于诱导蛋白,HO-1催化产物CO能诱导血管内皮细胞和平滑肌细胞HO-1蛋白表达[10-11],
在大鼠肝细胞,肝细胞内源性CO是否是介导HO-1蛋白上调、拮抗LPS所致大鼠肝细胞内质网应激的关键分子尚有待进一步研究。
总之,本实验结果显示,抗氧化蛋白HO-1表达上调是减轻LPS引起大鼠肝细胞损伤的重要因素。这一细胞水平的实验结果提示,大鼠肝细胞对外界致伤因素的反应是不均衡的,致伤因素引起包括HO-1在内的内源性代偿机制破坏,由代偿转变为失代偿才能导致整体细胞死亡发生,这或许适用于外伤引起的T-MODS,继而引起机体死亡。
[1]韩业兴,谷振勇,丛斌,等.挤压家兔后肢导致急性肝损伤和抗氧化能力降低[J].法医学杂志,2006,22(4):248-250.
[2]Malhi H,Kaufman RJ.Endoplasmic reticulum stressin liver disease[J].J Hepatol,2011,54(4):795-809.
[3]季英磊,闫骏,王艳莎,等.内质网应激参与介导脂多糖诱导的大鼠肝细胞凋亡[J].法医学杂志,2014,30(1):13-18.
[4]Origassa CS,C覾mara NO.Cytoprotective role of heme oxygenase-1 and heme degradation derived end products in liver injury[J].World J Hepatol,2013,5(10):541-549.
[5]Ben-Ari Z,Issan Y,Katz Y,et al.Induction of heme oxygenase-1 protects mouse liver from apoptotic ischemia/reperfusion injury[J].Apoptosis,2013,18(5):547-555.
[6]Yun N,Eum HA,Lee SM.Protective role of heme oxygenase-1 against liver damage caused by hepatic ischemia and reperfusion in rats[J].Antioxid Redox Signal,2010,13(10):1503-1512.
[7]Ke B,Shen XD,Gao F,et al.Small interfering RNA targeting heme oxygenase-1(HO-1)reinforces liver apoptosis induced by ischemia-reperfusion injury in mice:HO-1 is necessary for cytoprotection[J]. Hum Gene Ther,2009,20(10):1133-1142.
[8]Suzuki T,Takahashi T,Yamasaki A,et al.Tissue-specificgeneexpressionofhemeoxygenase-1(HO-1)and non-specific delta-aminolevulinatesynthase(ALAS-N)in a rat model of septic multiple organ dysfunction syndrome[J].Biochem Pharmacol,2000,60(2):275-283.
[9]Dixon SJ,Lemberg KM,Lamprecht MR,et al.Ferroptosis:an iron-dependent form of nonapoptotic cell death[J].Cell,2012,149(5):1060-1072.
[10]Liu XM,Peyton KJ,Ensenat D,et al.Endoplasmic reticulum stress stimulates heme oxygenase-1 gene expression in vascular smooth muscle.Role in cell survival[J].J Biol Chem,2005,280(2):872-877.
[11]Kim KM,Pae HO,Zheng M,et al.Carbon monoxide induces heme oxygenase-1 via activation of protein kinase R-like endoplasmic reticulum kinase and inhibits endothelial cell apoptosis triggered by endoplasmic reticulum stress[J].Circ Res,2007,101(9):919-927.
[12]Chung J,Shin DY,Zheng M,et al.Carbon monoxide,a reaction product of heme oxygenase-1,suppresses the expression of C-reactive protein by endoplasmic reticulum stress through modulation of the unfolded protein response[J].Mol Immunol,2011,48(15-16):1793-1799.
[13]Lin MH,Yen JH,Weng CY,et al.Lipid peroxidation end product 4-hydroxy-trans-2-nonenal triggers unfolded protein response and heme oxygenase-1 expression in PC12 cells:Roles of ROS and MAPK pathways[J].Toxicology,2014,315:24-37.
[14]Chang SH,Barbosa-Tessmann I,Chen C,et al. Glucose deprivation induces heme oxygenase-1 gene expression by a pathway independent of the unfolded protein response[J].J Biol Chem,2002,277(3):1933-1940.
[15]Lee GH,Kim HK,Chae SW,et al.Bax inhibitor-1 regulates endoplasmic reticulum stress-associated reactive oxygen species and heme oxygenase-1 expression[J].J Biol Chem,2007,282(30):21618-21628.
[16]Zheng M,Kim SK,Joe Y,et al.Sensing endoplasmic reticulum stress by protein kinase RNA-like endoplasmic reticulum kinase promotes adaptive mitochondrialDNA biogenesis andcellsurvivalvia heme oxygenase-1/carbon monoxide activity[J].FASEB J,2012,26(6):2558-2568.
[17]Unuma K,Aki T,Matsuda S,et al.Inducer of heme oxygenase-1 cobalt protoporphyrin accelerates autophagy and suppresses oxidative damages during lipopolysaccharide treatment in rat liver[J].Hepatol Res,2013,43(1):91-96.
[18]季英磊,孙志红,王艳莎,等.N-乙酰半胱氨酸对脂多糖诱导大鼠肝细胞内质网应激的抑制作用[J].南通大学学报(医学版),2013,33(2):89-93.
[19]Yan J,Ji Y,Wang Y,et al.Reciprocal compensatory effects between cystathionine gamma lyase and cystathionine beta synthase in rat hepatocytes exposed to lipopolysaccharide[J].Nitric Oxide,2015,47:S50.
[20]Wang Y,Ji Y,Liu Y,et al.Exogenous hydrogen sulfide promotes upregulation of HO-1 expression in rat hepatocytes induced by LPS[J].Nitric Oxide,2014,39:S27.
[21]Wang Y,Ji Y,Liu Y,et al.Opposite effects of hydrogen sulfide pre-and post-administration on LPS-induced endoplasmic reticulum stress in rat hepatocytes[J].Nitric Oxide,2015,47:S49-S50.
Effects of HO-1 on Lipopolysaccharide-induced Endoplasmic Reticulum Stress of Rat Hepatocytes
WANG Yan-sha,JI Ying-lei,WANG Tao,WU Lin-lin,FEI Cheng-ping,LIU Yi-chang,GU Zhen-yong
(Department of Forensic Medicine,Medical College of Nantong University,Nantong 226001,China)
Objective To investigate effects of antioxidant stress protein heme oxygenase-1(HO-1)on lipopolysaccharide(LPS)-induced endoplasmic reticulum stress(ERS)of rat hepatocytes.Methods The BRL cells(rat hepatocyte cell line)were cultured.The hepatocytes were treated with LPS,LPS+HO-1 siRNA,HO-1 siRNA and PBS solution,respectively.The cell viability was measured by trypan blue exclusion test.The apoptosis cells were detected by the fluorescent dye Hoechst 33258.Expressions of GRP78,CHOP,caspase-12 and HO-1 were detected by Western blotting.Results LPS caused an increase of HO-1 protein expression of rat hepatocytes in a dose-dependent and time-dependent manner, a up-regulation of GRP78,CHOP and caspase-12,a decrease in cell viability,and an increase in apoptosis rate of hepatocytes.Pretreatment of HO-1 siRNA inhibited the up-regulation of LPS-induced HO-1, however,aggravated ERS and cellular injury.Conclusion HO-1 inhibites ERS-mediated cellular injury of rat hepatocytes induced by LPS.
forensic pathology;RNA,small interfering;endoplasmic reticulum;stress;lipopolysaccharides;heme oxygenase-1;hepatocytes;rats
DF795.1
A
10.3969/j.issn.1004-5619.2015.06.001
1004-5619(2015)06-0417-05
2014-12-22)
(本文编辑:刘宁国)
国家自然科学基金资助项目(81273341);江苏省高校优势学科建设工程资助项目(PAPD)
王艳莎(1987—),女,硕士,主要从事法医病理学研究
谷振勇,男,博士,教授,主要从事创伤性MODS、血管生物学和呼吸肌疲劳信号转导机制研究;E-mail:zygusz@126.com

