高效液相色谱法同时检测粮食中常见8 种真菌毒素的含量
黎 睿,谢 刚*,王松雪
(国家粮食局科学研究院,北京 100037)
高效液相色谱法同时检测粮食中常见8 种真菌毒素的含量
黎 睿,谢 刚*,王松雪
(国家粮食局科学研究院,北京 100037)
建立免疫亲和柱净化-高效液相色谱法同时测定粮食中黄曲霉毒素B1(aflatoxins,AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、赭曲霉毒素A(ochratoxin A,OTA)、玉米赤霉烯酮(zearalenone,ZEN)、呕吐毒素(deoxynivalenol,DON)和T-2毒素的检测方法。样品经乙腈-水提取后,用免疫亲和柱净化,Agilent Elipse Plus C18(100 mm×4 mm,3.5 μm)色谱柱分离,以甲醇-乙腈-水-乙酸为流动相,流速1 mL/min,柱温35 ℃,进样量20 μL,检测系统为可变波长检测器串联光化学衍生器串联荧光检测器。根据信噪比为3的峰响应值,确定各真菌毒素的检出限为:AFB10.446 ng/mL、AFB20. 152 ng/mL、AFG10.523 ng/mL、AFG20.334 ng/mL、ZEN 7 ng/mL、OTA 0.7 ng/mL、DON 200 ng/mL、T-2毒素100 ng/mL。样品中各真菌毒素的平均加标回收率,玉米为80.0%~104.5%,小麦为83.2%~102.8%,方法精密度为2.6%~10.2%。从样品前处理到分析整个过程耗时约2 h。本方法简便、快速、灵敏度高,适用于粮食中多种真菌毒素的快速测定。
粮食;黄曲霉毒素B1、B2、G1、G2;玉米赤霉烯酮;脱氧雪腐镰刀菌烯醇;T-2毒素;赭曲霉毒素A;高效液相色谱;免疫亲和柱
真菌毒素是真菌产生的有毒代谢产物,污染粮食的常见真菌毒素包括黄曲霉毒素B1(aflatoxins,AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、赭曲霉毒素A(ochratoxin A,OTA)、玉米赤霉烯酮(zearalenone,ZEN)、呕吐毒素(deoxynivalenol,DON)和T-2毒素等[1-2]。为了保障食品安全,100多个国家/组织颁布了食品及饲料中常见真菌毒素的限量标准,我国也规定了粮食中AFB1、DON、OTA和ZEN 4种常见真菌毒素的限量值[3]。粮食同时受几种真菌毒素污染的现象普遍存在[4],文献报道的多种真菌毒素同时检测方法主要有液相色谱-质谱联用方法[5-10]、液相色谱法[11-25]。液相色谱-质谱联用方法需要大型仪器,不适合于基层单位实验室(县市级检测机构)的需要;目前国内外发表的液相色谱法最多能同时检测DON、AFB1、AFG1、AFB2、AFG2、OTA、ZEN、T-2、HT-2共12 种真菌毒素[17],该研究其提取、净化根据不同极性的真菌毒素采用不同的方法,操作复杂、时间长、成本高;其他同时检测多种真菌毒素的液相色谱法,在检测毒素的种类、前处理技术、回收率、灵敏度等方面依然存在不足,亟需开发适合我国粮食真菌毒素污染特点的、便于在基层实验室推广的、简便、快速、高效的液相色谱同时检测方法。
根据实验室长期的监测数据和公开报道的我国粮食中多种真菌毒素同时污染情况,以及我国基层实验室检测仪器配置情况,研制了基于免疫亲和净化技术的同时检测DON、AFB1、AFG1、AFB2、AFG2、OTA、ZEN和T-2毒素的液相色谱法方法,以解决目前单一毒素检测方法存在的效率低、耗时长、成本高的问题。
1 材料与方法
1.1 材料与试剂
玉米取自河北滦平某自然村;小麦取自安徽明光某自然村;空白小麦、玉米样品 实验室自制;Myco6in1+免疫亲和层析柱 美国Vicam公司。
黄曲霉毒素标准溶液(AFB10.893 μg/mL、AFB20.304 μg/mL、AFG11.046 μg/mL、AFG20.334 μg/mL)、OTA标准溶液(2.0 μg/mL)、ZEN标准溶液(50 μg/mL)、DON标准溶液(100 μg/mL)、T-2毒素标准溶液(100 μg/mL)、乙酸(色谱纯) 美国Sigma-Aldrich公司;甲醇、乙腈(色谱纯) 美国Thermo Fisher公司。
1.2 仪器与设备
1260高效液相色谱仪(配有荧光检测器、紫外检测器和Chemstation色谱工作站) 美国安捷伦公司;光化学衍生器 美国AURA Industries公司;6位泵流操作架 北京中捡维康公司;PL403IC型电子分析天平 梅特勒-托利多上海有限公司;Pulverisette14高速旋转粉碎机 德国Fritsch公司;N-EVAP氮吹仪 美国Organomation Associates公司;多用途旋转摇床 美国Scientific Industries公司;GT10-1高速离心机 北京时代北利离心机有限公司;Milli-Q超纯水制备仪 美国 Millipore公司。
1.3 方法
1.3.1 真菌毒素混合标准溶液的配制
移取一定体积AFS、OTA、ZEN、DON、T-2毒素标准溶液,用甲醇稀释成真菌毒素混合标准储备液,使AFB1、AFB2、AFG1、AFG2、ZEN、OTA、DON、T-2毒素质量浓度分别为178.6、60.8、209.2、66.8、2 000、200、40 000、7 000 ng/mL。临用前用甲醇-水(50∶50,V/V)溶液稀释成合适质量浓度梯度的混合标准工作液。
1.3.2 样品加标
将粮食样品用高速粉碎机粉碎过0.5 mm筛。准确称取空白玉米样品5.0 g(精确到0.01 g),向玉米粉末中分别添加适量AFS、OTA、ZEN、DON、T-2毒素标准溶液,密封避光过夜,次日进行提取检测。用上述方法制备3 个加标水平的小麦、玉米加标样品,使样品中各真菌毒素的含量如表1所示,用于提取方法优化、回收率和精密度实验。
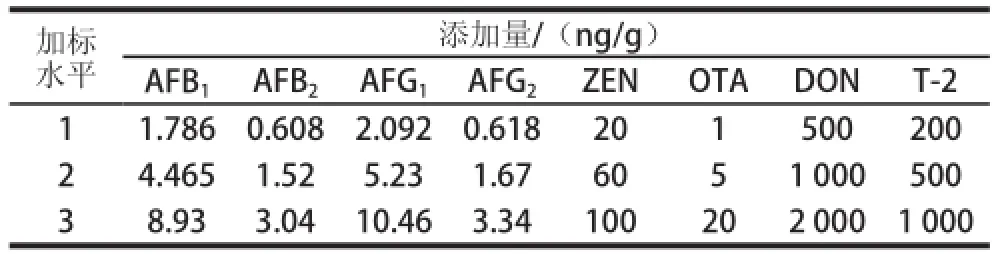
表1 加标样品中各真菌毒素添加量Table1 Concentrations of 8 mycotoxins in spiked samples
1.3.3 色谱条件
色谱柱:Agilent Eclipse Plus C18(100 mm×4 mm,3.5 μm);流动相:甲醇-乙腈(50∶50;V/V)为流动相A,0.1%乙酸溶液为流动相B,0~11 min流动相组成35% A+65% B,11~23 min流动相组成55% A+45% B,23~28 min流动相组成逐渐恢复为35% A+65% B。
检测器:使用可变波长检测器(variable wavelength detector,VWD)串联光化学衍生器串联荧光检测器(fluorescence detector,FLD)同时进行检测。VWD条件为波长218 nm,检测DON;波长202 nm,检测T-2毒素;FLD条件为光化学衍生,激发波长365 nm、发射波长450 nm,检测AFB1、AFB2、AFG1、AFG2;激发波长274 nm、发射波长460 nm,检测ZEN;激发波长333 nm,发射波长460 nm,检测OTA。
1.3.4 样品的提取与净化
取5 g准备好的加标样品或粮食样品至离心管中,加入20 mL 80%乙腈溶液。在多用途旋转摇床上振荡提取30 min,常温条件下以4 000 r/min的转速离心10 min,准确移取2 mL上清液(相当于0.5 g样品),加入33 mL磷酸缓冲液(phosphate buffer saline,PBS)稀释,摇晃混匀。
将35 mL稀释液全部通过VICAM Myco6in1免疫亲和层析柱,调节压力使溶液以2~3 mL/min的流速缓慢通过。用10 mL超纯水淋洗柱子。加入1.5 mL甲醇,调节压力使其以1~2 mL/min的流速缓慢洗脱,收集洗脱液,当大部分甲醇通过时,停止加压,静置3~5 min,再加入1.5 mL甲醇,二次洗脱,合并全部洗脱液,于50 ℃条件下氮气吹干,准确加入0.5 mL甲醇-水(50∶50,V/V)溶液定容,涡旋振荡1 min,过0.45 μm有机滤膜,供上机检测。
2 结果与分析
2.1 流动相的优化
多种真菌毒素的液相检测,常用甲醇、乙腈或甲醇乙腈混合液作为流动相的有机相,常用的水相有磷酸盐缓冲液[16],0.1%乙酸溶液[17′19-20]和0.5%甲酸溶液[21]。根据实验室仪器为二元泵的特点,以及大量真菌毒素检测积累的经验,选择甲醇-乙腈-0.1%乙酸溶液[4]作为流动相,并对流动相条件进行优化。以甲醇-乙腈(50∶50,V/V)为流动相A,0.1%乙酸溶液为流动相B,比较了几种不同流动相配比的分离效果和保留时间:在0~12 min,对比了35% A+55% B、30% A+70% B和40% A+60% B 三种流动相配比对AFB1、AFB2、AFG1、AFG2、DON的分离效果;在12~24 min,对比60% A+40% B、55% A+45% B和50% A+50% B 三种流动相配比对ZEA、OTA、T-2毒素3 种毒素的分离效果。

表2 不同流动相条件下8 种真菌毒素的分离效果和保留时间Table2 Separation efficiency and retention times of 8 mycotoxins with different mobile phhaasseess
由表2可知,最优流动相条件为0~11 min流动相组成35% A+65% B,11~23 min流动相组成55% A+45% B,23~28 min流动相组成逐渐恢复为35% A+65% B。优化条件下8种真菌毒素色谱图见图1。
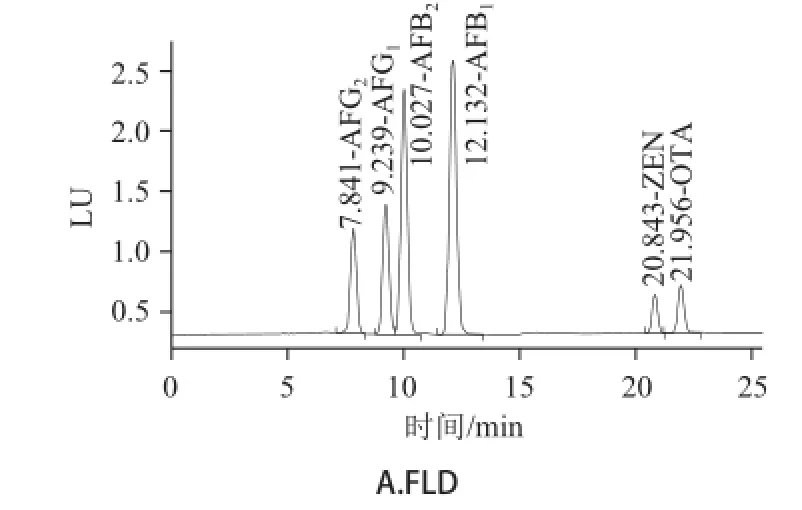
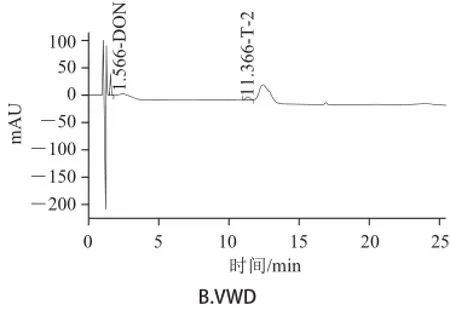
图1 色谱条件优化后8 种真菌毒素色谱图Fig.1 Chromatograms of 8 mycotoxins under the optimized mobile phase conditions
2.2 方法的线性范围与检出限
在1.3.3节色谱条件下,分别测定8 种真菌毒素的系列标准溶液,以目标峰的峰面积为纵坐标(y),各真菌毒素质量浓度(ng/mL)为横坐标(x),绘制标准曲线;逐级稀释法分析方法的检出限和定量限,根据信噪比为3的峰响应值,得出方法检出限;根据信噪比为10的峰响应值,得出方法的定量限,结果见表3。

表3 液相色谱法同时检测8 种真菌毒素的线性回归方程、检出限和定量限Table3 Linearity and sensitivity of the HPLC method for detection limit and quantification limit of mycotooxxiinnss
2.3 提取净化方法的优化

表4 提取净化方法Table4 Extraction and clean-up methodsthods
根据8 种真菌毒素的特性并参考相关研究的前处理方法[17-25],取5 g玉米加标样品,采用甲醇、乙腈、乙酸、水、PBS等试剂,设计并比较7 种不同提取净化方法。具体方法见表4,比较结果见表5。
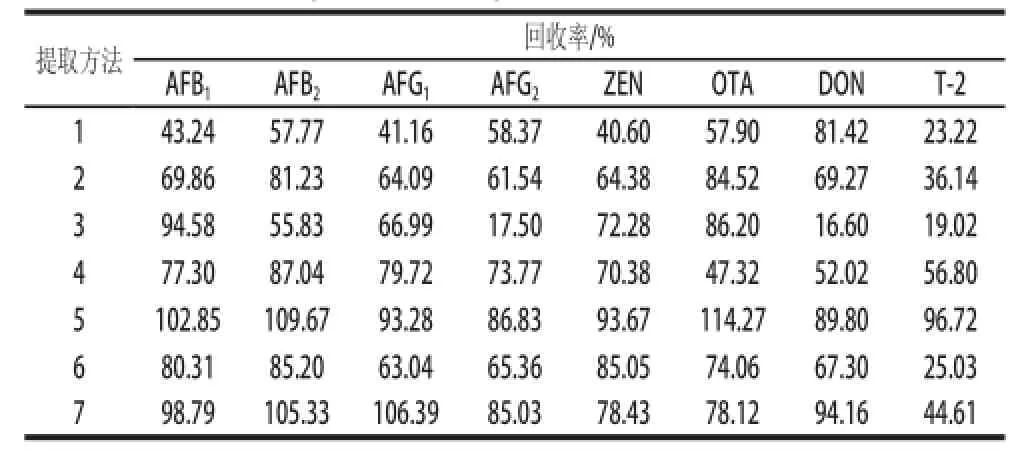
表5 不同提取净化方法玉米加标样品回收率(n==33)Table5 Recoveries of myco toxins with different extraction and cleanup methods (spiked coorrnn nn == 33))
由表4和表5可见,方法1对AFB1、AFB2、AFG1、ZEN、OTA、T-2的提取效果较差;方法2对AFG2和T-2的提取效果差;方法3、4对DON和T-2的提取效果较差;方法6对T-2毒素的回收率偏低;方法7与方法5相比提取溶剂中加了酸,结果明显降低了ZEN、OTA和T-2的回收率;提取方法5同时满足8 种真菌毒素的回收率要求。
2.4 方法精密度与回收率
将高、中、低3 个水平玉米和小麦多种真菌毒素加标样品,使用最优提取方法和仪器条件,进行重复性实验,每天测10 次,连续测5 d,结果见表6。玉米为80.0%~104.5%,小麦为83.2%~102.8%。方法精密度为2.6%~10.2%。

表6 方法的精密度与回收率Table6 Precision and recovery of the methodethod
3 结 论
本实验建立了免疫亲和柱层析净化-高效液相色谱法同时检测粮食中AFB1、AFB2、AFG1、AFG2、OTA、ZEN、DON和T-2毒素的分析方法,并利用本方法对玉米和小麦样品进行了检测。实验结果表明,本方法具有较高的灵敏度、精密度、回收率;样品前处理比传统方法简便快捷,检测时间短,从提取、净化到色谱分离、结果计算,一份样品8 种真菌毒素同时分析耗时大约2 h,检测效率高,检测成本低。
实际样品检测表明,本方法能够满足对样品快速、高通量的检测要求及粮食安全限量的要求,可作为真菌毒素检测国家标准方法的替代法用于我国基层实验室和尚未配置液相色谱-质谱联用仪的监测实验室开展粮食真菌毒素污染监测工作。
[1] BENNETT J W KLICH M Mycotoxins[J]. Clinical Microbiology Reviews′2003′16(3): 497-516.
[2] RAHMANI A JINAP S SOLEIMANY F Qualitative and quantitative analysis of mycotoxins[J]. Comprehensive Reviews in Food Science and Food Safety′2009′8(3): 202-251.
[3] GB 2761—2011 食品中真菌毒素限量[S]. 2011.
[4] 张宇昊′杨琳′马良. 真菌毒素同时检测方法研究进展[J]. 中国粮油学报′2011′26(6): 123-128.
[5] LATTANZIO V M SOLFRIZZO M POWER S et al Simultaneous determination of a☒atoxins ochratoxin A and fusarium toxins in maize by liquid chromatography tandem mass spectrometry after multitoxin immunoaf☒nity clean-up[J]. Rapid Communications in Mass Spectrometry′2007′21(20): 3253-3261.
[6] SOLEIMANY F JINAP S FARIDAH A et al A UPLC-MS/MS for simultaneous determination of aflatoxins ochratoxin A zearalenone DON fumonisins T-2 toxin and HT-2 toxin in cereals[J]. Food Control′2012′25(2): 647-653.
[7] SPANJER M C RENSEN P M SCHOLTEN J M LC-MS/MS multimethod for mycotoxins after single extraction with validation data for peanut pistachio wheat maize cornflakes raisins and figs[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure and Risk Assessment′2008′25(4): 472-489.
[8] TANG Y Y LIN H Y CHEN Y C et al Development of a quantitative multi-mycotoxin method in rice maize wheat and peanut using UPLCMS/MS[J]. Food Analytical Methods′2013′6(3): 727-736.
[9] 杨万颖′郑彦婕′李碧芳′等. 液相色谱串联质谱法同时测定小麦粉中10 种真菌毒素[J]. 广东化工′2008′35(9): 123-128.
[10] 蔡增轩′潘红峰′王丽丽′等. 应用超高压液相-质谱联用技术同时测定花生及其制品中的6 种黄曲霉毒素[J]. 中国卫生检验杂志′2009′19(5): 970-974.
[11] 王向红′刘涛′王忠斌′等. 高效液相色谱法同时测定谷物中的赭曲霉毒素和玉米赤霉烯酮[J]. 中国食品学报′2008′8(5): 148-152.
[12] 杨琳′张宇昊′马良. 高效液相色谱法同时检测粮谷中的黄曲霉毒素和赭曲霉毒素[J]. 食品科学′2011′32(24): 250-254.
[13] TRUCKSESS M WEAVER C OLES C et al Determination of aflatoxins B1′B2′G1′and G2and ochratoxin A in ginseng and ginger by multitoxin immunoaffinity column cleanup and liquid chromatographicquantitation collaborative study[J]. Journal of AOAC International′2008′91(3): 511-523.
[14] G☒BEL R LUSKY K Simultaneous determination of aflatoxins ochratoxin A and zearalenone in grains by new immunoaffinity column/liquid chromatography[J]. Journal of AOAC International′2004′87(2): 411-416.
[15] LI Jun YU Yimang TIAN Miao et al Simultaneous determination of aflatoxins zearalenone and ochratoxin A in cereal grains by immunoaffinity column and high performance liquid chromatography coupled with post-column photochemical derivatization[J]. Chinese Journal of Chromatography′2006′24(6): 581-584.
[16] OFITSEROVA M NERKAR S PICKERING M et al Multiresidue mycotoxin analysis in corn grain by column high-performance liquid chromatography with postcolumn photochemical and chemical derivatization single-laboratory validation[J]. Journal of AOAC International′2009′92(1): 15-25.
[17] SOLEIMANY F JINAP S RAHMANI A et al Simultaneous detection of 12 mycotoxins in cereals using RP-HPLC-PDA-FLD with PHRED and a post-column derivatization system[J]. Food Additives and Contaminants′2011′28(4): 494-501.
[18] VACLAVIKOVA M MACMAHON S ZHANG K et al Application of single immunoaffinity clean-up for simultaneous determination of regulated mycotoxins in cereals and nuts[J]. Talanta′2013′117: 345-351.
[19] RAHMANI A JINAP S KHATIB A et al Simultaneous determination of aflatoxins ochratoxin A and zearalenone in cereals using a validated RP-HPLC method and PHRED derivatization system[J]. Journal of Liquid Chromatography and Related Technologies′2013′36(5): 600-617.
[20] WANG Yaling CHAI Tongjie LU Guozhong et al Simultaneous detection of airborne aflatoxin ochratoxin and zearalenone in a poultry house by immunoaffinity clean-up and high-performance liquid chromatography[J]. Environmental research′2008′107(2): 139-144.
[21] IB☒☒EZ-VEA M CORCUERA L A REMIRO R et al Validation of a UHPLC-FLD method for the simultaneous quantification of aflatoxins ochratoxin A and zearalenone in barley[J]. Food Chemistry′2011′127(1): 351-358.
[22] OFITSEROVA M NERKAR S PICKERING M et al Multiresidue mycotoxin analysis in corn grain by column high-performance liquid chromatography with postcolumn photochemical and chemical derivatization single-laboratory validation[J]. Journal of AOAC International′2009′92(1): 15-26.
[23] G☒BEL R LUSKY K Simultaneous determination of aflatoxins ochratoxin a and zearalenone in grains by new immunoaffinity column/liquid chromatography[J]. Journal of AOAC International′2004′87(2): 411-416.
[24] 潘迎芬′郑育莉′方成俊′等. 免疫亲和层析净化-高效液相色谱法同时检测几种食品中黄曲霉毒素和赭曲霉毒素A[J]. 福建分析测试′2013′22(4): 12-17.
[25] RAHMANI A JINAP S SOLEIMANY F Validation of the procedure for the simultaneous determination of aflatoxins ochratoxin A and zearalenone in cereals using HPLC-FLD[J]. Food Additives and Contaminants′2010′27(12): 1683-1693.
Simultaneous Analysis of 8 Mycotoxins in Grains by High Performance Liquid Chromatography
LI Rui XIE Gang*′WANG Songxue
(Academy of State Administration of Grain Beijing 100037′China)
A rapid analytic method using high performance liquid chromatography (HPLC was established for the simultaneous determination of aflatoxins including AFB1′AFB2′AFG1and AFG2′ochratoxin A zearalenone deoxynivalenol and T-2 toxin in grains The samples were extracted with acetonitrile-water and cleared up with an immunoaffinity column (IAC). The separation of the targeted compounds was performed on an Agilent Elipse Plus C18column (100 mm×4 mm′3.5 μm using a mobile phase consisting of a mixture of acetonitrile : methanol : water : acetic acid with a flow rate of 1 mL/min at 35 ℃. The injection volume was 20 μL The detection system was variable wavelength detector (VWD)-PHRED system-fluorescence detector (FL D). The limits of detection (LODs of AFB1′AFB2′AFG1′AFG2′ZEN OTA DON and T-2 toxin were 0.446′0.152′0.523′0.334′7′0.7′200′and 100 ng/mL respectively The recoveries of samples spiked with these mycotoxins were in the ranges of 80.0% - 104.5% for corn and 83.2% - 102.8% for wheat The precision va lues associated with the method expressed as relative standard deviation (RSD values were between 2.6% and 10.2%. It took only 2 hours to complete an analysis The method was suitable for the determination of common 8 mycotoxins in raw grains with the advantages of simplicity rapidness sensitivity and good reproducibility.
aflatoxins (AFB1′AFB2′AFG1′AFG2); zearalenone deoxynivalenol T-2; ochratoxin A grain HPLC immunoaffinity columns (IAC)
TS207.3
A
1002-6630(2015)06-0206-05
10.7506/spkx1002-6630-201506039
2014-05-22
国家高技术研究发展计划(863计划)项目(2012AA101609);北京市科委项目(Z121100008512001)
黎睿(1987—),男,研究实习员,学士,研究方向为粮油质量安全检测与控制。E-mail:lr@chinagrain.org
*通信作者:谢刚(1974—),男,副研究员,硕士,研究方向为粮油质量安全检测与防控。E-mail:xg@chinagrain.org

