夹脊电针和神经松动术对兔坐骨神经损伤后轴突再生和血清神经营养因子的影响①
王艳,王茜,陈国平,范红石
夹脊电针和神经松动术对兔坐骨神经损伤后轴突再生和血清神经营养因子的影响①
王艳1,王茜2,陈国平1,范红石2
目的观察夹脊电针和神经松动术对兔坐骨神经损伤后轴突再生和血清脑源性神经营养因子(BDNF)、睫状神经营养因子(CNTF)含量的影响。方法30只成年雄性兔分为模型组(n=6)、假手术组(n=6)、神经松动术组(n=6)、夹脊电针组(n=6)、夹脊电针结合神经松动术组(n=6)。钳夹法复制坐骨神经损伤模型。模型组、假手术组不做任何干预,神经松动术组行神经松动术治疗,夹脊电针组进行夹脊电针治疗,夹电针结合神经松动术组进行夹脊电针和神经松动术治疗。治疗4周后,HE染色观察轴突生长情况,ELISA法检测血清BDNF、CNTF含量。结果神经松动术组、夹脊电针组、夹脊电针结合神经松动术组轴突生长情况均优于模型组,夹脊电针结合神经松动术组优于神经松动术组和夹脊电针组;神经松动术组、夹脊电针组、夹脊电针结合神经松动术组血清BDNF、CNTF含量均高于模型组(P<0.05),夹脊电针结合神经松动术组优于神经松动术组和夹脊电针组(P<0.05)。结论神经松动术、夹脊电针均可促进兔损伤坐骨神经的轴突再生,可能与提高血清中CNTF、BDNF水平有关;两者结合效果更佳。
周围神经损伤;坐骨神经;夹脊电针;神经松动术;脑源性神经营养因子;睫状神经营养因子;轴突再生;兔
[本文著录格式]王艳,王茜,陈国平,等.夹脊电针和神经松动术对兔坐骨神经损伤后轴突再生和血清神经营养因子的影响[J].中国康复理论与实践,2015,21(4):417-421.
CITED AS:Wang Y,Wang Q,Chen GP,et al.Effects of Jiaji electroacupuncture and neurodynamic mobilization technique on axon regeneration and content of neurotrophic factors in rabbits with sciatic nerve injury[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(4): 417-421.
周围神经损伤常常导致部分或全部的运动、感觉以及自主神经功能丧失,这是由于周围神经轴索中断,远端发生Wallerian变性[1]。周围神经神经系统(peripheral nervous system,PNS)与中枢神经系统(central nervous system,CNS)在功能上紧密联系,周围神经损伤后,损伤神经的胞体、突起和相应的中枢神经细胞都会发生改变[2]。本研究用夹脊电针和神经松动术对兔坐骨神经损伤进行干预,观察其对轴突和胞体,以及血清中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和睫状神经营养因子(ciliary neurotrophic factor,CNTF)的影响。
1 材料和方法
1.1 实验动物
日本大耳白兔,雄性,4~5月龄,体重1.5~2.0 kg,哈尔滨派斯菲科生物制药股份有限公司提供,许可证号:SCXK(黑)2011-009。适应性喂养后进入实验。动物饲养和取材均遵守实验动物管理和保护的有关规定。
1.2 方法
1.2.1 模型制备
兔禁食水12 h后,10%水合氯醛1~2 ml/kg耳缘静脉注射麻醉。角膜反射消失后,俯卧位固定于动物手术台上。左侧大腿外侧剃毛,碘伏术区皮肤消毒。于股骨前缘中段凹陷处,延凹陷并平行于股骨干做纵形切口约2 cm。钝性分离股二头肌和股直肌,游离坐骨神经,用改良后的止血钳三扣垂直于股骨中点钳夹坐骨神经5 min,钳夹处肉眼可观察到神经被夹处神经纤维断裂,神经扁平且透明。之后常规分层缝合筋膜、皮肤。假手术组游离坐骨神经后不钳夹,逐层缝合伤口。术后予青霉素4×105U注射,每天2次,共3 d。分笼饲养。
造模成功标准:行为学观察,家兔活动量减少,左后肢动作减少,出现足背拖地现象,足尖上抬无力,下垂现象明显,身体重心明显右移,前行主要靠臀部肌肉收缩。
1.2.2 分组和干预
剔除麻醉和手术意外死亡的动物,将符合标准的30只兔分为5组:模型组、假手术组、神经松动术组、夹脊电针组、夹脊电针结合神经松动术组,每组6只。
模型组、假手术组不做任何干预,只予其他组同等条件抓取。
神经松动术组术后第3天将兔取仰卧位固定于实验台上,使左下肢悬空于台外。按限制条件的要求摆好准备姿势,将髋关节固定为外展45°,股骨与胫骨夹角30°。沿着坐骨神经走向,迅速将膝关节伸展至130°,之后放松还原至预备姿势。每次操作时间1 s,放松5 s,每组10次,每天1组,每周治疗6 d,共4周,由同一人操作[3]。
夹脊电针组术后第3天将兔取俯卧位固定于实验台上,于兔L5~L7棘突旁双侧取穴,1寸针灸针直刺,深度约0.5 cm,接KWD-808I脉冲针灸治疗仪(常州英迪电子医疗器械有限公司),疏密波,电流强度以家兔背部针颤动为准,每次30 min,每天1次,每周6 d,共4周。
夹脊电针结合神经松动术组每日先进行夹脊电针治疗,后进行神经松动术治疗,方法同上。共4周。
1.3 检测指标
干预4周后,各组兔10%水合氯醛1~2 ml/kg耳缘静脉注射麻醉,沿造模时切口,重新游离坐骨神经。手术线标记受损神经远侧端,以神经钳夹伤处为中点,剪取坐骨神经约2 cm。多聚甲醛固定,梯度酒精脱水,石蜡包埋。再将兔取仰卧位固定于动物手术台上,在心搏最明显处穿刺,经心脏取血5 ml,3000 r/ min离心5 min,取血清,-20℃冰箱保存待测。
1.3.1 HE染色
石蜡切片脱蜡至水,入苏木素(H)染液5 min,70%盐酸酒精分化10 s,自来水充分冲洗,使细胞核蓝化,蒸馏水洗;入伊红(E)染液1 min,梯度酒精脱水,二甲苯透明,树脂封片。应用OLYMPUS DP72显微摄像系统400倍下观察轴突再生情况,并摄片。
1.3.2 ELISA法检测血清BDNF、CNTF含量
标准品的稀释,加样,温育,配液,洗涤,加酶,温育,洗涤,显色,终止,试剂盒(上海通蔚实业有限公司)测定。测定在加终止液后15 min内进行。绘制标准曲线,根据样品光密度值在标准曲线上查出浓度。
1.4 统计学分析
2 结果
2.1 HE染色
假手术组坐骨神经由大小不等的神经束组成,外面被神经束膜和外膜包绕,神经组织结构完整,分布均匀,轴突直径比较一致,排列规则。
模型组组织结构排列疏松,大部分纤维溃变,部分神经纤维固缩;神经再生纤维稀少、分散,再生轴突不明显,且排列紊乱,少量再生髓鞘薄,间质明显增多;神经组织粗细不一,空泡样改变明显,神经细胞核消失明显;可见炎性细胞小灶性浸润。
夹脊电针结合神经松动术组、夹脊电针组、神经松动术组神经再生纤维数目多,分布较均匀,髓鞘完整、规则,轴突生长良好,可见许多新生纤维断面;施万细胞增生活跃,空泡样改变和神经细胞核消失较少;见散在炎性细胞浸润;神经干和外膜有再生血管分布,束间结缔组织较少。且夹脊电针结合神经松动术组轴突生长情况优于其他两组。见图1。
2.2 血清CNTF、BDNF
血清CNTF、BDNF水平,各模型组与假手术组比较均有显著性差异(P<0.05);夹脊电针结合神经松动术组、夹脊电针组、神经松动术组均优于模型组(P<0.05);夹脊电针结合神经松动术组优于夹脊电针组、神经松动术组(P<0.05);夹脊电针组与神经松动术组之间无显著性差异(P>0.05)。见表1。
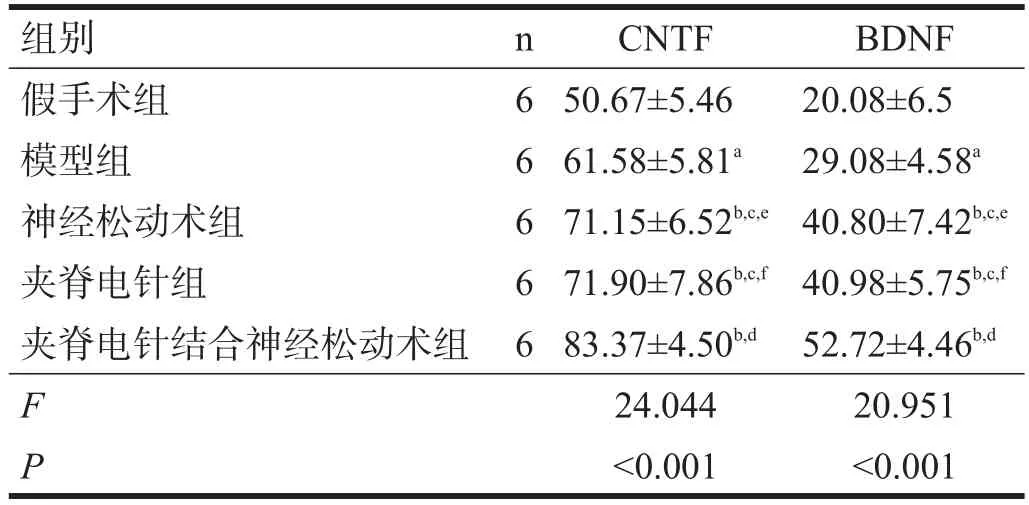
表1 各组干预后血清CNTF、BDNF水平比较(μg/L)
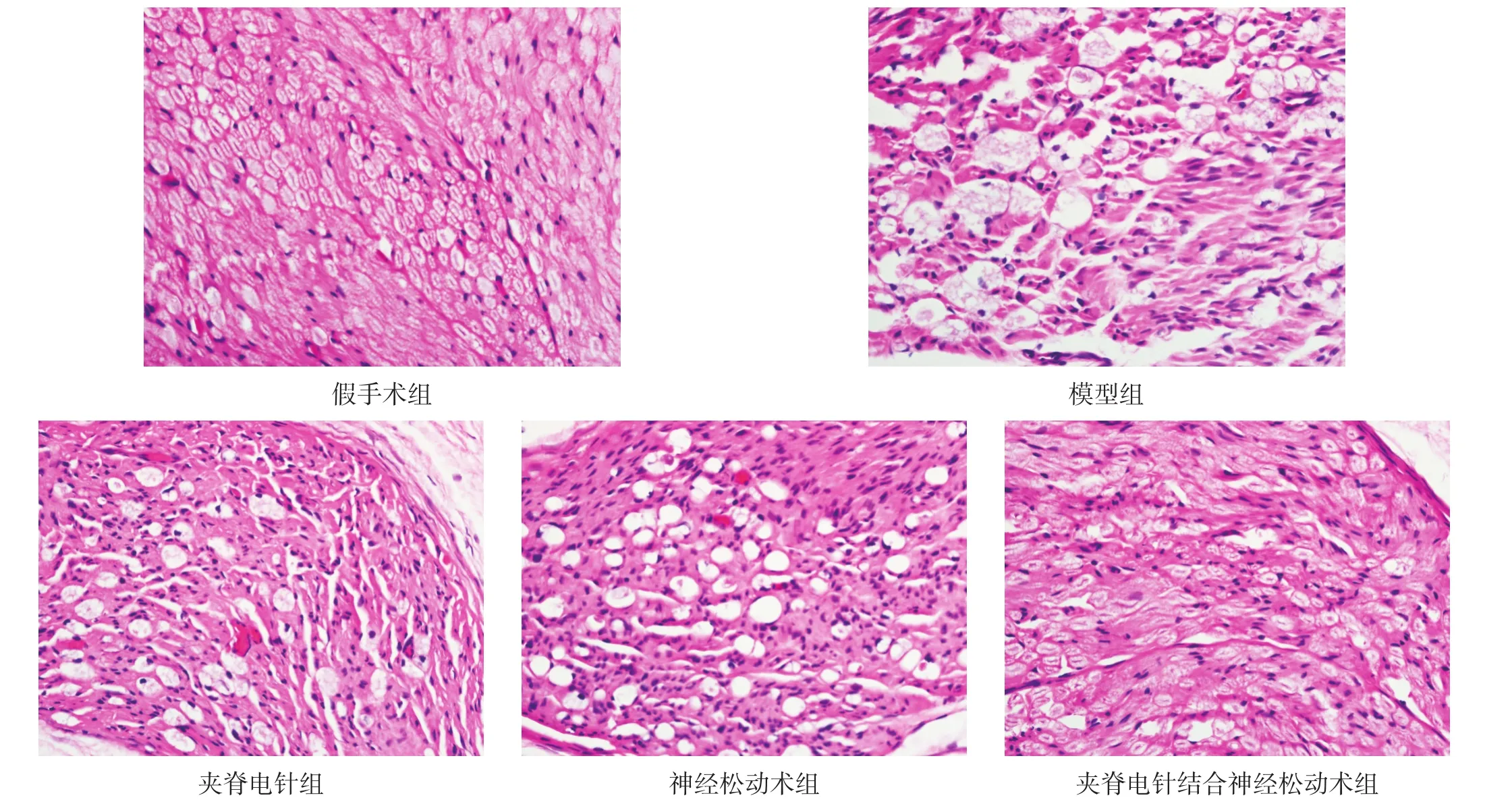
图1 干预后各组坐骨神经(HE染色,400×)
3 讨论
周围神经损伤后,损伤神经的神经胞体和突起都会发生变性。神经元失去靶细胞产生的逆行运输的神经营养物质[4],神经元内染色体常常溶解、树突回缩[1],损伤轴突远端发生Wallerian变性等。有研究显示,成年人前根离断会造成50%~80%脊髓前角细胞在几周内退变甚至死亡[5-6]。
BDNF及其受体trkB对维持神经再生至关重要[7];剥夺了内源性BDNF会破坏轴突生长和髓鞘再生[8]。外源性BDNF能够促进大鼠周围神经髓鞘的生长,而去除BDNF则髓鞘的生长受到抑制[9-10]。
CNTF也发挥对神经细胞的营养作用[11]。1976年,CNTF于鸡胚眼组织睫状神经节中发现,因其对睫状神经元有营养作用而得名,它是目前发现的唯一具有神经营养和肌肉营养双重作用的因子[12-13]。神经损伤后,轴突远端CNTF mRNA水平迅速下降,轴突再生时逐渐恢复。CNTF能够促进感觉神经元和交感神经元生长,防止体内脊髓运动神经元凋亡。在神经损伤后,局部和全身应用CNTF 4~6周,可观察到损伤远端再生轴突数量显著增加,形成的髓鞘数量也更多[14]。由于CNTF对治疗周围神经损伤有重要价值,人们用各种方法制备提取CNTF,应用于人运动神经元疾病的治疗,但疗效不满意[15]。
在生理状态下,周围神经的施万细胞中存在大量CNTF,脊髓前角运动神经元胞体和骨骼肌细胞中也有较高水平的CNTF表达。周围神经损伤后,CNTF大量释放到细胞外间隙;此时完整的施万细胞中并无CNTF,当发生Wallerian变性脱髓鞘时,CNTF表达降低;神经再生轴突再髓鞘化时,CNTF表达恢复正常。同时,失神经支配的骨骼肌细胞CNTF受体mRNA表达急剧升高[16]。
夹脊穴是临床常用的经外奇穴,治疗范围广泛且疗效确切。其中腰部穴位治疗腰腹和下肢疾病[17]。电针输出波形选用疏密波,克服单一波形产生适应的缺点;电刺激加强局部代谢,促进胞浆流运输,改善神经根周围组织营养。
周围神经损伤后,神经功能恢复的关键在于受损神经元是否存活,数量和功能,以及轴索能否成功再生,由此可见保护神经元结构和功能的重要性[18]。夹脊电针可抗内生性损伤电流,阻止Ca2+内流,稳定膜结构,增加线粒体酶活性,阻断神经元继发性病变,保护脊神经轴突的退变,促进神经轴突再生[19]。李晓宁等的研究发现,夹脊电针能提高BDNF、BDNF mRNA、神经生长因子、Bcl-2、Bcl-2 mRNA在脊髓损伤中的阳性表达,抑制脊髓损伤早期细胞凋亡[20]。本研究显示,夹脊电针对损伤的周围神经神经再生发挥着积极作用。
神经松动技术根据神经特殊的解剖结构,通过肢体运动,使神经组织在神经外周的软组织中进行滑动、加压、延展、张力变化等,从而改善神经微循环、轴向传输和脉冲频率。
神经松动术可降低神经张力,减少粘连,改善神经血液循环,恢复神经正常功能。周围神经主要由神经纤维、结缔组织以及血管组成,周围神经血管在神经外膜、神经内膜纵向走行,神经束膜斜向走形,血管之间相互吻合[21]。神经松动术拉长神经,血液从大血管流到神经外膜、神经束膜和神经内膜,最后到达神经纤维,促进血液循环,改善神经张力,恢复神经的正常位置,减少神经粘连,促进轴浆运输,利于有害物质的排出,营养物质的输送,使其恢复正常生理功能[22-27]。神经松动术临床上主要用于周围神经卡压伤引起的神经源性疼痛。用于臂丛神经损伤的治疗也疗效明显[28]。本研究显示,能够促进损伤的周围神经再生。
本研究还显示,夹脊电针对和神经松动术同时干预,效应增强,能达到事半功倍的效果。
综上所述,神经松动术、夹脊电针均可促进损伤神经的轴突再生,可能与提高血清CNTF、BDNF水平有关;联合应用效果更佳。具体机制有待于进一步研究。
[1]Navarro X,Vivó M,Valero-Cabré A.Neural plasticity after peripheral nerve injury and regeneration[J].Prog Neurobiol, 2007,82(4):163-201.
[2]Kaas JH,Collins CE.Anatomic and functional reorganization of somatosensory cortex in mature primates after peripheral nerve and spinal cord injury[J].Adv Neurol,2003,93:87-95.
[3]马明.不同拉伸参数的神经松动术对兔坐骨神经损伤后小腿三头肌湿质量和Murf-1表达的影响[D].哈尔滨:黑龙江中医药大学,2014.
[4]Raivich G,Hellweg R,Kreutzberg GW.NGF receptor-mediated reduction in axonal NGF uptake and retrigrade transport following sciatic nerve injury and during regeneration[J].Neuron,1991,7(1):151-164.
[5]Martin LJ,Kaiser A,Price AC.Motor neuron degeneration after sciatic nerve avulsion in adult rat evolves with oxidative
stress and is apoptosis[J].J Neurobiol,1999,40(2):185-201.
[6]Hoang TX,Nieto JH,Tillakaratne NJ,et al.Autonomic and motor neuron death is progressive and parallel in a lumbosacral ventral root avulsion model of cauda equina injury[J].J Comp Neurol,2003,467(4):477-486.
[7]Boyd JG,Gordon T.The neurotrophin receptors,trkB and p75, differentially regulate motor axonal regeneration[J].J Neurobiol,2001,49(4):314-325.
[8]Zhang JY,Luo XG,Xian CJ,et al.Endogenous BDNF is required for myelination and regeneration of injured sciatic nerve in rodents[J].Eur J Neurosci,2000,12(12):4171-4180.
[9]Chan JR,Cosgaya JM,Wu YJ,et al.Neurotrophins are key mediators of the myelination program in the peripheral nervous system[J].ProcNatlAcadSciUSA,2001,98(25): 14661-14668.
[10]Tolwani RJ,Cosgaya JM,Varma S,et al.BDNF overexpression produces a long-term increase in myelin formation in the peripheral nervous system[J].J Neurosci Res,2004,77(5): 662-669.
[11]Terenghi G.Peripheral nerve regeneration and neurotrophic factors[J].JAnat,1999,194(Pt 1):1-14.
[12]Ip NY,Yancopoulos GD.Ciliary neurotrophic factor and its receptor complex[J].Prog Growth Factor Res,1992,4(2): 139-155.
[13]孙金川,房清敏.神经营养因子与脊髓损伤的研究进展[J].滨州医学院学报,2013,36(2):136-138.
[14]邓雪华.雪旺细胞对周围神经损伤的修复过程[J].科学之友,2013,(6):127-128.
[15]王淑荣,孙忠人,王德生.睫状神经营养因子与神经再生[J].中风与神经疾病杂志.2003,20(1):92-93.
[16]Davis S,Aldrich TH,Ip NV,et al.Released form of CNTF receptor alpha component as a soluable mediator of CNTF responses[J].Science,1993,259(5102):1736-1739.
[17]石学敏.针灸学[M].北京:中国中医药出版社,2006:124.
[18]刘长辉.夹脊电针结合康复训练治疗上肢周围神经损伤的临床观察[D].哈尔滨:黑龙江中医药大学,2012.
[19]楚佳梅,范文双.夹脊电针治疗大鼠脊髓损伤的实验研究[J].中医药学期刊,2003,21(3):407-408.
[20]李晓宁,王凤艳,田旭升,等.夹脊电针对损伤中枢神经再生与内源性神经生长因子及细胞凋亡关系的实验研究[Z].哈尔滨:黑龙江中医药大学,2009.
[21]Nordin M.Basic Biomechanics of the Musculoskeletal System[M].USA:Lippincott Williams&Wilkins,2001:86-93.
[22]Shacklock M.Neural mobilization:a systematic review of randomized Controlletrials with an analysis of therapeutic efficacy[J].J Man Manip Ther,2008,16(1):8-22.
[23]Scrimshaw S,Maher C.Randomized controlled trial of neural mobilization after spinal of spinal surgery[J].Spine,2001,26 (24):2647-2652.
[24]Brown CL,Gilbert KK,Brismee JM,et al.The effects of neurodynamic mobilization on fluid dispersion within the tibial nerve at ankle:an unembalmed cadaveric study[J].Man Manip Ther,2011,19(1):26-43.
[25]Coppieters MW,Stappaerts KH,Wouters LL,et al.The immediate effects of a cervical lateral glide treatment technique in patients with neurogenic cervicobrachial pain[J].Orthop Sports Phys Ther,2003,33(7):369-378.
[26]Ellis R,Hing W,Dilley A,et al.Reliability of measuring sciatic and tibial nerve movement with diagnostic ultrasound during a neural mobilization technique[J].Ultrasound Med Biol, 2008,34(8):1209-1216.
[27]Echigo A,Aoki M,Ishiai S,et al.The excursion of the median nerve during nerve gliding exercise:an observation with high-resolution ultrasonography[J].Hand Ther,2008,21(3): 221-227.
[28]王艳,唐强,陈国平.神经松动术结合头穴丛刺与康复训练对臂丛神经损伤后上肢功能的影响[J].中国康复医学杂志, 2011,26(6):575-576.
Effects of Jiaji Electroacupuncture and Neurodynamic Mobilization Technique on Axon Regeneration and Content of Neurotrophic Factors in Rabbits with Sciatic Nerve Injury
WANG Yan1,WANG Qian2,CHEN Guo-ping1,FAN Hong-shi1
1.The Second Hospital of Heilongjiang University of Traditional Chinese Medicine,Harbin,Heilongjiang 150001, China;2.Heilongjiang University of Traditional Chinese Medicine,Harbin,Heilongjiang 150040,China
Objective To observe the effects of Jiaji electroacupuncture and neurodynamic mobilization technique on axon regeneration and content of brain-derived neurotrophic factor(BDNF)and ciliary neurotrophic factor(CNTF)in rabbits with sciatic nerve injury.Methods 30 male adult rabbits were assigned to sham(A,n=6),model(B,n=6),neurodynamic mobilization(C,n=6),Jiaji electroacupuncture (D,n=6),and Jiaji electroacupuncture combine with neurodynamic mobilization(E,n=6)groups.The group C was treated with neurodynamic mobilization,the group D with Jiaji electroacupuncture,and the group D with both 3 days after modeling of clamping at sciatic nerve, while the groups A and B with no treatment.The axon regeneration was observed with HE staining,and the content of BDNF and CNTF in serum was measured with ELISA 4 weeks after treatment.Results The axons regeneration was observed better in the groups C,D and E than in the group B.The content of BDNF and CNTF was more in the groups C,D and E than in the group B(P<0.05).Conclusion Both Jiaji electroacupuncture and neurodynamic mobilization can improve axon regeneration with synergistic action,which may associate with the increase of BDNF and CNTF in serum.
peripheral never injury;sciatic nerve;Jiaji electroacupuncture;neurodynamic mobilization technique;brain-derived neurotrophic factor;ciliary neurotrophic factor;axon regeneration;rabbits
10.3969/j.issn.1006-9771.2015.04.011
R745.4
A
1006-9771(2015)04-0417-05
2014-08-19
2014-11-03)
1.黑龙江中医药大学创新人才基金项目(No.051290);2.黑龙江省博士后基金项目(No.LBH-Z13202)。
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001;2.黑龙江中医药大学,黑龙江哈尔滨市150040。作者简介:王艳(1967-),女,辽宁庄河县人,博士,博士后,主任医师,教授,主要研究方向:周围神经损伤康复。

