人工真皮和自体刃厚皮复合移植联合负压封闭引流技术治疗电击伤深度创面的临床研究
于新国 朱维平 吕大兵
(1.苏州大学公共卫生学院,江苏 苏州 215006;2.上海电力医院,上海 200050)
人工真皮和自体刃厚皮复合移植联合负压封闭引流技术治疗电击伤深度创面的临床研究
于新国1,2朱维平2吕大兵1
(1.苏州大学公共卫生学院,江苏 苏州 215006;2.上海电力医院,上海 200050)
目的:观察人工真皮和自体刃厚皮复合移植联合负压封闭引流技术治疗电击伤深度创面的疗效。方法:2011年1月—2013年1月30例电击伤住院患者,随机分为治疗组和对照组。每组均15例20个创面。两组创面面积为0.5%~4.0%,Ⅲ~Ⅳ度,创面部位相当。两组创面扩创后,手术分两次进行。第1次为人工真皮植入,第2次是在人工真皮血管化后在人工真皮上移植自体刃厚皮,治疗组两次手术均联合负压封闭引流技术治疗。两组术后均给予抗炎、换药、抗瘢痕、功能锻炼等综合治疗,随访1年。比较两组患者术后创面愈合时间、创面愈合质量及创面感染发生情况。 结果:治疗组第1次手术后5~7 d即达到创面人工真皮血管化,行第2次手术,术后7~10 d创面封闭;随访1年,皮肤弹性、耐磨性及关节活动度好,瘢痕不明显。对照组第1次手术后10~14 d创面人工真皮达到血管化,行第2次手术,术后10~16 d创面封闭;随访感染创面愈合后皮肤色泽暗红,活动度稍差,对压力有阻力,功能部位明显,皮肤易破溃,瘢痕明显,无感染创面愈合后与治疗组愈合质量无明显差异。治疗组第1次手术后3个创面发生感染,第2次手术后无感染创面出现。对照组第1次手术后6个创面发生感染,第2次手术后4个创面发生感染。结论:人工真皮、自体刃厚皮复合移植方法联合负压封闭引流技术治疗电击伤深度创面,可以提高复合移植后皮片的存活,缩短愈合时间,同时改善愈合质量。
电击伤;深度创面;真皮基质;皮片移植;负压
电击伤造成的组织损伤与其他烧伤不同,除皮肤缺损外,常伴有深部组织不同程度的损伤。临床上除肌腱、神经、骨外露等严重损毁部位使用皮瓣覆盖修复外,其余多以带有较多真皮组织的皮片(包括中厚皮、全厚皮)修复,但往往引起供皮区域瘢痕明显增生。近年来开展的人工真皮植入+刃厚皮复合移植的技术多用于深度创面的修复,在改善局部功能的同时可减少对供皮区的损伤。但由于电击伤创面局部血供不良,基底存在继发性坏死的可能,影响了人工真皮植入后血管化的速度,又增加了创面修复过程中局部感染的风险,大大降低了复合移植皮片的存活率。负压封闭引流技术对创面治疗有明确的效果[1-2]。本研究将负压封闭引流技术应用于复合移植方案中,探讨联合应用后对电烧伤深度创面修复质量的影响。
1 资料与方法
1.1 临床资料 2011年1月—2013年1月在我院住院的电击伤患者30例,共40处创面。其中男15例,女15例。灼伤面积0.5%~4.0% TBSA,平均(2.5±0.4)%TBSA;创面深度Ⅲ~Ⅳ度,除外神经、肌腱及骨外露创面。患者随机分成两组。治疗组15例20个创面,男8例,女7例;年龄20~46岁,平均(38.0±3.5)岁;创面位于手部5处,腕部5处,小腿6处,足部4处。对照组15例20个创面,男7例,女8例;年龄21~44岁,平均(36.0±3.2)岁;创面位于手部6处,腕部5处,小腿4处,足部5处。两组一般资料比较差异无显著性(P>0.05),具有可比性。
1.2 治疗方法 两组创面行彻底扩创后,手术分两次进行。术后换药时均留取创面分泌物,作细菌培养+药敏试验。
1.2.1 治疗组 采用人工真皮植入+自体刃厚皮复合移植联合负压封闭引流技术治疗。第1次手术行人工真皮(商品名为皮耐克,日本郡是株式会社生产)植入+负压封闭引流。人工真皮与创缘皮钉固定,外置负压封闭引流装置(山东威高新生医疗器械有限公司),术后持续负压吸引,负压维持在—10~—6 kPa。5~7 d后皮耐克胶原蛋白海绵层色泽呈现粉红色,富有光泽,提示已“血管化”。行第2次手术,在皮耐克胶原蛋白海绵层表面予大张自体刃厚皮移植+负压封闭引流,术后5 d拆除负压封闭引流装置,常规隔日换药,至创面封闭。
1.2.2 对照组 采用人工真皮植入+自体刃厚皮复合移植方法治疗。第1次手术行人工真皮(皮耐克)植入,10~14 d后皮耐克胶原蛋白海绵层色泽呈现粉红色,富有光泽。行第2次手术,在皮耐克胶原蛋白海绵层表面予以大张自体刃厚皮移植。术后常规隔日换药,10~16 d创面封闭。
两组术后均给予抗炎、每日或隔日换药、口服或外用抗瘢痕药物及弹力衣加压治疗等抗瘢痕、功能锻炼等综合治疗。
1.3 观察指标 住院治疗期间观察真皮基质血管化时间、复合移植后皮片存活情况及创面愈合时间。两组均随访1年,观察患者创面皮肤外观、耐磨性及关节活动性等情况;用温哥华瘢痕量表(Vancouver scar scale, VSS)[2]评定瘢痕情况。
1.4 统计学处理 采用SPSS17.0统计软件,计量资料以x±s表示,两组间比较采用 t检验。计数资料行Fisher确切概率法检验, P<0.05为差异有统计学意义。
2 结 果
2.1 疗效 治疗组真皮基质血管化时间、植皮后创面愈合时间、瘢痕评分均明显低于对照组(P<0.05),见表1。
2.1.1 治疗组 真皮基质植入后5~7 d,真皮基质色泽粉红,即“血管化”,符合植皮条件;其中3个创面感染,细菌培养分别为铜绿假单胞菌(足部1个)、金黄色葡萄球菌(手部2个);创缘少部分真皮基质溶解,少量脓性分泌物,换药及使用敏感抗生素后感染控制。植皮后皮片存活良好,创面无感染,7~10 d创面封闭。术后持续抗瘢痕治疗,功能锻炼,随访1年,创面皮肤平整,光滑,弹性好,柔软,关节活动度及耐磨性亦较好。
2.1.2 对照组 真皮基质植入后10~14 d“血管化”,其中6个创面感染,细菌培养分别为铜绿假单胞菌(足部1个)、鲍曼不动杆菌(手、腕部各1个)、金黄色葡萄球菌(手部2个)、大肠杆菌(小腿1个);部分真皮基质溶解,创缘红,有脓性分泌物。植皮后4个创面感染,皮片存活不佳,皮下积液或部分皮片溶解,细菌培养分别为铜绿假单胞菌(足部1个)、鲍曼不动杆菌(手部1个)、金黄色葡萄球菌(手部1个)、大肠杆菌(小腿1个),使用敏感抗生素控制感染,换药14~18 d愈合。无感染创面植皮术后9~12 d愈合,平均10~16 d愈合。术后持续抗瘢痕治疗,功能锻炼,随访1年,感染创面愈合后皮肤色泽暗红,活动度稍差,对压力有阻力,功能部位明显,皮肤易破溃。无感染创面愈合后皮肤与治疗组无显著差异。
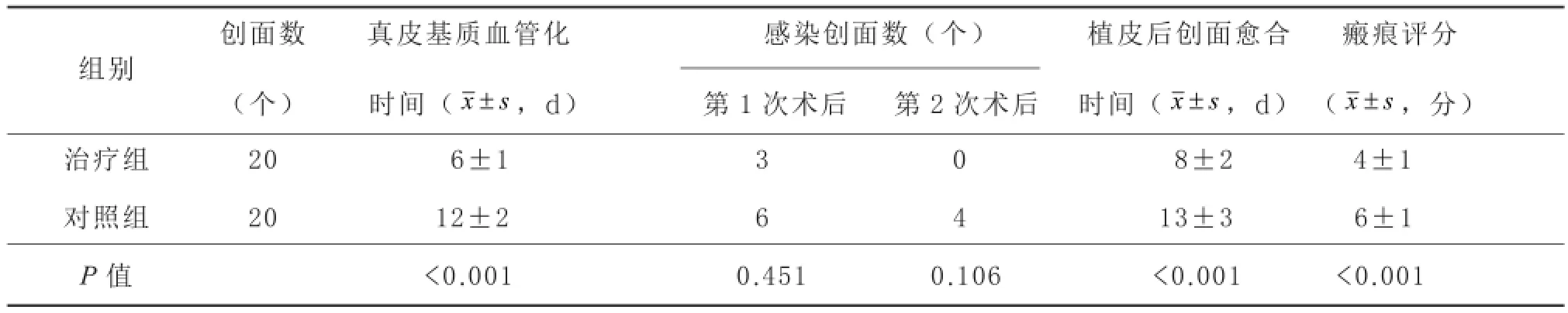
表1 两组创面愈合情况比较
2.2 典型病例 患者男,48岁,左上肢、右下肢10 kV电击伤后6周入院。查体:左前臂中段截肢术后,创面愈合好。右下肢约4%TBSA创面,已于外院切痂,创面深及肌层,中下段胫骨外露,尚有大量坏死组织残留,创面少量脓性分泌物,异味明显,创缘红肿。入院后彻底扩创,切除坏死胫骨前肌,咬除外露胫骨坏死骨皮质,行人工真皮和自体刃厚皮复合移植联合负压封闭引流技术治疗,第1次术后5 d真皮基质血管化,即行第2次手术,术后4 d拆除负压引流装置,皮片贴附好,无皮下积液,基本转色,隔日换药,术后9 d创面愈合。两次手术后创面培养均无细菌生长 (图1~3,见封三)。
3 讨 论
20世纪80年代,Yannas、Burke等提出了使用人工真皮植入+自体刃厚皮片复合移植的方法来解决深度缺损创面。目前,复合移植的方法已经成熟地运用于临床,明显减少了瘢痕增生程度,有利于局部功能恢复。近几年来我院烧伤科使用复合移植的方法修复深度电烧伤创面,发现复合移植成活率并不高。其原因可能为:①真皮基质抗感染能力差,而电击伤创面的特性增加了真皮基质植入后局部感染的概率。②真皮基质血管化速度慢。一般而言,真皮基质植入2~3周后形成血管化,而在血管化的过程中,创面处理不当时易造成感染。③真皮基质与创面基底黏附不良,创面周围释放组织酶导致真皮基质降解,降低了移植存活率[1]。
负压封闭引流技术是近20年来兴起的一种创面处理技术。 与采用盐水纱布敷料治疗慢性伤口的疗效比较,负压封闭引流具有增加局部创面血流量、促进成纤维细胞生长、降低创面细菌数量等优势[2]。临床观察证实,负压封闭引流技术可缩短创面血管化时间[3-4]、减少局部感染,有利于皮片与创面基底黏附、加快创面愈合[5-6]。为此,我们采用人工真皮、自体刃厚皮复合移植联合负压封闭引流技术修复电击伤深度创面,缩短了创面感染时间。治疗组真皮基质血管化时间缩短至5~7 d,真皮基质、皮片与创面基底黏附充分;持续的负压吸引使创面引流充分,减少了创面感染发生率。创面愈合后表面平整、光滑,柔软,弹性好,活动度及耐磨性亦较好,瘢痕较少;供皮区未形成明显瘢痕。
人工真皮植入与复合移植联合负压封闭引流技术具有以下优势:通过持续的负压吸引可以及时引流渗液及坏死组织,有利于创面移植物贴附,减少因引流不畅继发感染的概率;同时促进了创面局部血管化,加速创面愈合。 笔者在临床工作中体会到:①人工真皮系外源性植入材料,抗感染能力差。电烧伤创面组织呈进行性坏死,创面加深,不容易彻底清创,因此充分引流可以改善局部血运,避免间生态组织继发坏死,从而提高手术成功率。②保持负压吸引通畅,避免负压吸引管道阻塞或贴膜漏气。如引流液较多,及时更换引流装置。③术中要充分止血。电击伤伴有创周血管不同程度损伤,持续负压状态下易破裂出血,术后引流负压压力要由小到大,循序渐进,吸引过程中需严密观察创面有无活动性出血。④烧伤感染的病原菌结构不断变化[7-8],要注意病房人员流动及仪器消毒,及时多次创面培养,选用敏感抗生素控制感染。
总之,人工真皮、自体刃厚皮复合移植联合负压封闭引流技术治疗电击伤深度创面的方法在临床应用具有可行性,可以提高复合移植后皮片的存活率,缩短愈合时间,同时改善创面愈合质量。
[1]张文浩,周莉萍,张志华,李岩,孔祥红,刘郭,张宏图,储海函,李习荣. 扩创植皮联合负压封闭引流治疗烧伤患者后期感染难愈创面[J]. 中华烧伤杂志,2014,30(4):365-367.
[2]许伟石,刘琰,乐嘉芬.烧伤创面修复[M].武汉:湖北科学技术出版社,2013,10:69、143.
[3]Jeschke MG,Rose C, Angele P,Fuchtmeier B,Nerlich MN,Bolder U. Development of new reconstructive techniques:use of Integra in combination with fibrin glue and negative-pressure therapy for reconstruction of acute and chronic wounds[J]. Plast Reconstr Surg, 2004,113(2):525-530.
[4]Tufaro AP, Buck-DW, Fischer AC. The use of artificial dermis in the reconstruction of oncologic surgical defects[J]. Plas Reconstr Surg, 2007,120(3):638 -646.
[5]伍国胜,陈郑礼,朱世辉,夏照帆. 深Ⅱ度烧伤创面植皮术后应用负压封闭引流技术的效果[J]. 中华烧伤杂志,2015,31(2):102-104.
[6]柴家科,申传安. 重视负压伤口治疗技术在烧伤外科中的应用[J]. 中华烧伤杂志,2015,31(2):81-83.
[7]于勇,盛志勇,柴家科,蒋伟,朱静. 1995—2011年解放军总医院第一附属医院烧伤科感染病原菌结构和耐药水平的变化[J].感染、炎症、修复,2012,13(2):93-96.
[8]张海军,夏照帆. 2000—2005年长海医院危重烧伤患者感染病原菌及药敏分析[J]. 感染、炎症、修复,2009,10(2):111-112.
Clinical study on application of artificial dermis, split thickness skin autograft followed by vacuum sealing drainage technique in treating deep wound as a result of electric injury
Yu Xinguo*, Zhu Weiping, Lü Dabing.
*School of Public Health, Soochow University, Suzhou 215006, Jiangsu,China
Zhu Weiping(E-mail:13916051680@139.com)
Objective: To observe the effect of application of artificial dermis and autologous split thickness skin graft followed by vacuum sealing drainage (VSD) in the treatment of deep wounds as a result of electrical injury. Methods: From January 2011 to January 2013, 30 patients with electrical injury were admitted, and they were randomly divided into two groups, the treatment group and the control group, with 20 wounds in 15 patients in each group. The areas of wounds were 0.5%-4.0%TBSA (deep II degree to full thickness injury), and the wounds’ sites were similar. After debridement, all the patients underwent two operations. In the first operation, artificial dermis was implanted, and in the second, autologous split thickness skin was grafted on the artificial dermis after vascular regeneration could be seen in the dermis. Patients in the treatment group only received VSD treatment at the end of each operation. Patients in both groups were treated with the treatment including anti-inflammation measures, dressing change, anti-scarring, and functional exercise etc., and they were followed up for 1 year. The healing time, healing quality and incidence of infection of wounds were compared between the two groups. Results: In the treatment group, angiogenesis of the artificial dermis was observed 5-7 days after the first operation, and the wound healed 7-10 days after skin graft. Blood vessel formation was observed 10-14 days after the treatment of the control group and wounds healed 10-16 days after wounding. One-year follow-up showed that skin elasticity, abrasion resistance and joint activity were satisfactory in the treatment group, and scar was not obvious. But in the control group, the healed infected wounds showed comparatively darker color, less resilient, prone to ulceration, with more remarkable scar. There was no significant difference in the healing quality of non-infected wounds between the two groups. Infection occurred in 3 wounds of the treatment group after the first operation, and no wounds were infected after the second operation. In control group, 6 wounds were infected after the first operation, and 4 wounds with infection after second operation. Conclusions: Artificial dermis and autologous split thickness skin graft combined with VSD technique in treating deep wounds of electrical injury can improve the survival of skin grafts, shorten the healing time of the wounds and improvethe healing quality in the treatment of deep wounds as a result of electric injury.
Electrical injury Deep wound Dermal matrix Skin graft Vacuum sealing drainage
10. 3969/j. issn. 1672-8521. 2015. 03 . 009
2015-08-15)
朱维平,主任医师 (E-mail:13916051680@139.com)
——栽培注意事项

