运动预处理对脑缺血再灌注大鼠血清炎症因子水平的影响①
朱路文,叶涛,吴孝军,姜云飞,唐强
运动预处理对脑缺血再灌注大鼠血清炎症因子水平的影响①
朱路文1,叶涛2,吴孝军2,姜云飞2,唐强1
目的探讨运动预处理对脑缺血再灌注大鼠血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)及肿瘤坏死因子α (TNF-α)含量的影响。方法雄性Sprague-Dawley大鼠24只分为运动预处理组(n=8)、模型组(n=8)、假手术组(n=8)。线栓法制备大鼠大脑中动脉阻塞(MCAO)缺血再灌注模型。再灌注后2 h、24 h分别行神经功能缺损评分。随后取材,HE染色观察大鼠缺血侧脑组织病理形态变化,酶联免疫吸附法检测血清TNF-α、IL-1β及IL-6的含量。结果脑缺血再灌注后24 h,运动预处理组神经功能评分较模型组改善(P<0.05),血清TNF-α、IL-1β及IL-6含量明显降低(P<0.01);脑缺血区皮质病理损伤减轻,间质水肿程度减轻,细胞排列较整齐,缺血区变性和坏死的神经元数量明显减少。结论运动预处理可以降低急性脑缺血再灌注大鼠炎症反应,降低神经功能缺损。
脑缺血再灌注;运动预处理;肿瘤坏死因子α;白细胞介素-1β;白细胞介素-6;炎症反应
[本文著录格式]朱路文,叶涛,吴孝军,等.运动预处理对脑缺血再灌注大鼠血清炎症因子水平的影响[J].中国康复理论与实践,2015,21(1):22-25.
CITED AS:Zhu LW,Ye T,Wu XJ,et al.Effects of exercise preconditioning on inflammatory response in serum in rat after cerebral ischemia-reperfusion[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(1):22-25.
脑缺血再灌注损伤(ischemia-reperfusion injury,I/ R)是指缺血的脑组织在一定时间因侧支代偿复流或溶栓重新得到血液灌注后,其结构损伤和功能障碍不仅得不到恢复反而加重的现象。近年研究发现,炎症反应是脑缺血再灌注损伤的相关病理机制之一[1-2]。血清中白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎症细胞因子的变化,与缺血后脑组织的炎症反应相关联[3]。运动预处理已证实具有脑保护作用[4-5]。本实验采用大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)再灌注模型,研究运动预处理对局灶性脑缺血再灌注后病理变化及促炎
性细胞因子IL-1β、IL-6及TNF-α的影响。
1 材料与方法
1.1 实验动物
SPF级雄性Sprague-Dawley大鼠24只,体质量(250±30)g,10~12周龄,购于黑龙江中医药大学药物安全性评价中心,动物合格证号:SCXK(黑) 2008001。饲养条件:温度(25±1)℃,湿度(65±5)%,噪音小于60 dB,12 h明暗交替(7:00~19:00照明),自由食水。
1.2 主要试剂和设备
TNF-α、IL-1β、IL-6采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测试剂盒:武汉博士德公司。MK3酶标仪:MULTISKAN公司。KDC-160HR高速冷冻离心机:中科中佳科学仪器有限公司。RM2235型切片机、HI1210型摊片机、HI1220型烤片机:LEICA。JD-PT动物实验跑台:上海继德教学实验器材厂。
1.3 动物分组及干预
将24只大鼠进行编号、称重后,采用随机数字表法将其分为运动预处理组、模型组、假手术组,每组8只。运动预处理组采用电动跑台连续训练3周后,制作MCAO模型,120 min后拔线恢复灌注。模型组自由活动3周后,制作MCAO模型,120 min后拔线恢复灌注。假手术组自由活动3周后,接受类似MCAO各项手术操作,但不插入线栓。
1.3.1 运动预处理
造模前连续训练3周,每周6天。实验前电动跑台适应性训练3 d,训练方案:速度8~10 m/min,坡度0°,每天20 min。剔除不愿跑台的大鼠。正式训练方案[6-7]:速度15 m/min,坡度0°,每天30 min。
1.3.2 模型制备
参照Longa改良线栓法制备MCAO脑缺血再灌注模型[8]。术前12 h禁食不禁水。10%水合氯醛0.35 ml/100 g腹腔注射麻醉,仰卧位固定于手术台上,术中动物保持自主呼吸,注意吸痰以保持呼吸道通畅,恒温加热板维持大鼠体温(37.0±0.5)℃。颈部备皮,医用碘伏常规消毒,颈正中偏右切口,钝性分离皮下筋膜及右侧腺泡;将腺泡向右侧外翻,充分暴露手术区域,钝性剥离右侧胸锁乳突肌与胸骨舌骨肌之间的肌间隙,剥离出右侧颈总动脉、颈外动脉及颈内动脉。医用缝合线结扎近心端颈总动脉及颈外动脉。在颈总动脉主干上扎活结,用动脉夹夹闭右侧颈总动脉分叉处,在距活结约1.5 mm处剪一小口,轻插入线栓(直径0.26 mm、长5 cm进口鱼线,头端过蜡处理),尾端翘起,慢慢送入,同时判断线栓是否进入翼腭突动脉(PPA)以避免造模失败。从右侧颈总动脉分叉处估算,线栓插入的深度约18~20 mm,使线栓经右侧颈总动脉分叉处进入颈内动脉,越过大脑中动脉开口处,到达大脑前动脉起始部。扎紧备线,将腺泡复位,预留栓线于皮肤外,缝合并消毒。脑缺血120 min(完成线栓操作后计时)后,拔出栓线至右侧颈总动脉主干分叉处。
1.4 神经行为学评分
再灌注后2 h、24 h参照Longa等的5分制法进行神经功能评分[8]。0分:无神经功能缺失体征。1分:不能完全伸展患侧前爪。2分:向患侧转圈。3分:行走时向患侧倾倒。4分:不能自发行走且意识障碍。首次评分1~3分的大鼠视为造模成功。0分、4分或死亡剔除,予以补充。评分由一名不知道实验分组的实验人员独立完成。
1.5 取材与指标检测
再灌注24 h完成神经功能评分后,水合氯醛0.40 ml/100 g腹腔注射麻醉,真空采血管心尖采血4 ml,室温静置30 min后,4℃3000 r/min离心15 min,分离、分装血清,置于-20℃冰箱中待检。对各组血清IL-1β、IL-6和TNF-α含量进行检测,检测步骤严格按照试剂盒说明书进行。
采血结束后,夹闭腹主动脉,行心内灌注。先缓慢灌注生理盐水(室温)约100 ml,见大鼠前肢及两肺变白后,改用4%多聚甲醛(4℃)灌注,待大鼠前肢剧烈抽动结束,再缓慢滴注15 min左右,至大鼠上半身呈现僵硬状态。冰板上迅速断头取脑,置于4%多聚甲醛溶液中,4℃冰箱过夜(<24 h)。将脑组织取出,在视交叉后1 mm处冠状位向后取2等份厚3 mm的脑组织,置于10%中性福尔马林缓冲液中再固定18 h。常规石蜡包埋,制成厚3~5µm的组织切片,行HE染色,光镜下(200×)观察病理形态学变化。
1.6 统计学分析
采用SPSS 22.0统计分析软件进行数据处理。计量资料均采用(±s)表示,组间比较采用单因素方差(one-way ANOVA)分析,两两之间比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1 神经功能评分
假手术组未出现神经功能缺损表现。再灌注后2 h,与假手术组比较,模型组和运动预处理组已有明显神经功能缺损表现(P<0.01),评分为2分的居多,二者间无显著性差异(P>0.05)。再灌注后24 h,运动预处理组较模型组神经功能缺损程度减轻(P<0.05)。见表1。

表1 各组脑缺血再灌注后神经功能评分比较
2.2 HE染色
假手术组大鼠脑皮质区未见神经元损伤及炎性细胞浸润,神经元细胞形态正常,细胞膜、核膜较清晰,核仁明显,胞核呈类圆形,细胞数目众多且排列整齐。模型组大鼠右侧脑组织缺血皮质出现水肿,细胞间隙变宽,结构较疏松,空泡样改变明显,神经细胞固缩呈三角形,胞浆嗜伊红,细胞核固缩深染,核仁消失;染色质呈新月形或核碎裂现象,有炎性细胞和神经胶质细胞聚集现象,越远离缺血皮质区细胞形态越接近正常。运动预处理组大鼠脑缺血区皮质病理损伤减轻,间质水肿程度减轻,细胞排列较整齐,缺血区变性和坏死的神经元数量明显减少。见图1。
2.3 血清TNF-α、IL-1β、IL-6
模型组、运动预处理组大鼠血清中TNF-α、IL-1β均较假手术组增高(P<0.05),IL-6降低(P<0.05);与模型组比较,运动预处理组大鼠血清TNF-α、IL-1β和IL-6均明显降低(P<0.01)。见表2。
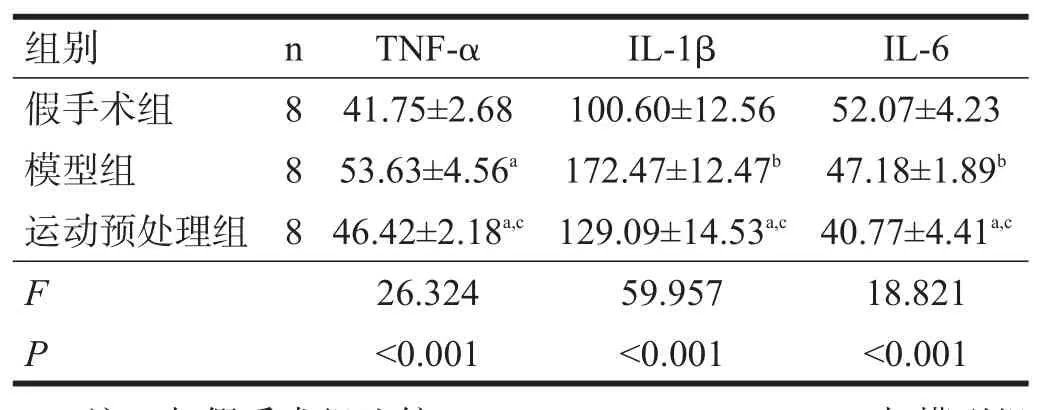
表2 各组血清TNF-α、IL-1β、IL-6比较(pg/ml)
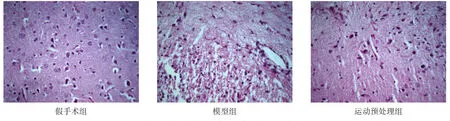
图1 各组脑缺血再灌注后缺血侧神经病理(HE染色,200×)
3 讨论
运动预处理,即缺血前给予多次重复的运动训练,可以诱导脑缺血耐受,增强神经保护并抵抗脑缺血引起的各种继发性脑损伤[9-10]。与其他预处理方式比较,运动预处理简便易行,易于被患者接受,具有很强的临床可操作性。
目前认为,运动预处理涉及多靶点、多水平、多通道的综合作用。运动预处理后,缺血区皮层TNF-α受体表达降低,提示TNF-α参与重复运动预处理诱发的脑缺血耐受[11]。Guo等认为,运动预处理还能通过改善血脑屏障功能,提高脑卒中后基底膜的完整性,降低脑损伤,其神经保护作用与金属基质蛋白和金属蛋白酶组织抑制因子表达失衡有关[12]。Tahamtan等认为,运动预处理可以挽救更多缺血侧大脑背侧海马区神经元细胞,改善神经行为功能[13]。此外,有学者认为,运动预处理可能是通过下调代谢型谷氨酸受体1,抑制脑缺血后谷氨酸释放,降低脑缺血/再灌注损伤[14]。进一步研究发现,运动预处理可以减轻缺血后脑损伤,可能跟谷氨酸转运体-1两条信号通路有关[15]。运动预处理的脑保护机制有待进一步阐明。
脑缺血再灌注后级联炎症反应是重要的病理机制之一,也是近年来的研究热点。Patel等发现,IL-37可以对抗急性再灌注损伤,缩小脑梗死体积,改善大脑损伤程度,发挥神经保护作用;可能与IL-37可以降低急性、亚急性再灌注期间外周血中TNF-α、IL-1β、IL-6等促炎性细胞因子的含量有关[1]。积雪草
皂苷可以降低海马区小胶质细胞超活化和p38/分裂原激活的蛋白激酶(mitogen activated protein kinases, MAPK)磷酸化水平,从而降低TNF-α、IL-1β、IL-6等促炎性细胞因子的表达,发挥抗炎作用,改善短暂性脑缺血再灌注后记忆障碍[2]。脑缺血再灌注损伤后,受损脑组织细胞产生、分泌大量TNF-α、IL-1β、IL-6等促炎性细胞因子,激活趋化因子,启动炎症级联反应,并且脑皮质区比其他区炎症反应可能更持久、剧烈[16-17]。趋化因子可诱导血管内皮细胞表面黏附分子表达,加强黏附分子与白细胞表面受体反应,促进白细胞与血管内皮细胞黏附。同时趋化因子又是单核细胞、中性粒细胞、淋巴细胞的活化信号,被激活的炎性细胞经过上述过程,在短时间内穿出血管壁,浸润脑实质,引起炎症损伤。脑缺血再灌注损伤可上调基质金属蛋白酶表达,破坏血脑屏障,血脑屏障通透性增加[18-19],使中枢脑组织的炎症反应信号经由血液传递到外周,活化外周免疫系统中的炎性细胞。因此,外周血相关信号分子的变化可以反映脑组织局部的炎症损伤程度及机体对局部损伤修复相关调节网络的变化。
本研究结果显示,脑缺血再灌注后24 h,运动预处理组血清TNF-α、IL-1β、IL-6含量均明显降低,神经功能改善;缺血区皮质病理损伤明显减轻。提示运动预处理可以通过降低脑缺血再灌注过程中炎症反应相关因子浓度,抑制炎症级联反应的加剧,从而减轻脑缺血再灌注损伤,发挥神经保护作用。与假手术组比较,模型组大鼠血清中IL-6降低,可能是脑缺血再灌注损伤应激后,大量分泌的糖皮质激素和儿茶酚胺类等应激激素抑制免疫系统活化的结果[20]。
[1]Patel FJ,Volkmann DT,Taylor GW,et al.IL-37 reduces inflammatory response after cerebral ischemia and reperfusion injury through down-regulation of pro-inflammatory cytokines[J]. Cytokine,2014,69(2):234-239.
[2]李扬,罗勇,秦文熠,等.IKK-NBD多肽通过调节c-rel对抗局灶脑缺血再灌注大鼠大脑皮质炎症反应[J].第三军医大学学报,2013,35(16):1721-1725.
[3]Chen S,Yin ZJ,Jiang C,et al.Asiaticoside attenuates memory impairment induced by transient cerebral ischemia-reperfusion in mice through anti-inflammatory mechanism[J].Pharmacol Biochem Behav,2014,122:7-15.
[4]Dornbos D,Zwagerman N,Guo M,et al.Preischemic exercise
reduces brain damage by ameliorating metabolic disorder in ischemia/reperfusion injury[J].J Neurosci Res,2013,91(6): 818-827.
[5]Zhang Q,Zhang L,Yang X,et al.The effects of exercise preconditioning on cerebral blood flow change and endothelin-1 expression after cerebral ischemia in rats[J].J Stroke Cerebrovasc Dis,2014,23(6):1696-1702.
[6]Ding Y,Li J,Luan X,et al.Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin[J].Neuroscience,2004,124(3):583-591.
[7]Ding YH,Li J,Yao WX,et al.Exercise preconditioning upregulates cerebral integrins and enhances cerebrovascular integrity in ischemic rats[J].Acta Neuropathol,2006,112(1):74-84.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[9]Zhang F,Wu Y,Jia J.Exercise preconditioning and brain ischemic tolerance[J].Neuroscience,2011,177:170-176.
[10]Stetler RA,Leak RK,Gan Y,et al.Preconditioning provides neuroprotection in models of CNS disease:Paradigms and clinical significance[J].Prog Neurobiol,2014,114:58-83.
[11]Ding YH,Mrizek M,Lai Q,et al.Exercise preconditioning reduces brain damage and inhibits TNF-α receptor expression after hypoxia/reoxygenation:an in vivo and in vitro study[J]. Curr Neurovasc Res,2006,3(4):263-271.
[12]Guo M,Cox B,Mahale S,et al.Pre-ischemic exercise reduces matrixmetalloproteinase-9expressionandameliorates blood-brain barrier dysfunction in stroke[J].Neuroscience, 2008,151(2):340-351.
[13]Tahamtan M,Allahtavakoli M,Abbasnejad M,et al.Exercise preconditioning improves behavioral functions following transient cerebral ischemia induced by 4-vessel occlusion(4-VO) in rats[J].Arch Iran Med,2013,16(12):697-704.
[14]Yang X,He Z,Zhang Q,et al.Pre-ischemic treadmill training for prevention of ischemic brain injury via regulation of glutamate and its transporter GLT-1[J].Int J Mol Sci,2012,13(8): 9447-9459.
[15]Wang X,Zhang M,Yang SD,et al.Pre-ischemic treadmill training alleviates brain damage via GLT-1 mediated signal pathway after ischemic stroke in rats[J].Neuroscience,2014, 274:393-402.
[16]Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1/2):53-68.
[17]曾靖,黎晓,黄志华.脑缺血再灌注损伤与炎症反应关系的研究进展[J].时珍国医国药,2011,22(3):698-700.
[18]Pera J,Zawadzka M,Kaminska B,et al.Influence of chemical and ischemic preconditioning on cytokine expression after focal brain ischemia[J].J Neurosci Res,2004,78(1):132-140.
[19]庞晓斌,谢欣梅,王保全,等.脉络宁对脑缺血再灌注大鼠血脑屏障通透性的影响研究[J].中成药,2014,36(7):1347-1350.
[20]张亚敏,陈素辉,孙华,等.针刺对脑缺血再灌注损伤大鼠外周血清IL-1β,IL-6表达的影响[J].针灸临床杂志,2013,29(1): 60-63.
Effects of Exercise Preconditioning on Inflammatory Response in Serum in Rat after Cerebral Ischemia-reperfusion
ZHU Lu-wen, YE Tao,WU Xiao-jun,JIANG Yun-fei,TANG Qiang.The Second Affiliated Hospital of Heilongjiang University of Chinese Medicine,Harbin,Heilongjiang 150001,China
Objective To investigate the effect of exercise preconditioning on serum level of tumor necrosis factor α(TNF-α),interleukin(IL)-1β and IL-6 in rats after cerebral ischemia-reperfusion(I/R).Methods 24 male Sprague-Dawley rats were randomly divided into exercise preconditioning group(n=8),model group(n=8)and sham group(n=8).The middle cerebral arteries were occluded for 120 min and re-perfused.All the rats were evaluated with neurological deficit score 2 hours,24 hours after I/R.The serum levels of TNF-α,IL-1β and IL-6 was detected with enzyme-linked immunosorbent,and the pathology was observed with HE staining 24 hours after I/R.Results The neurological deficit score decreased in the exercise preconditioning group compared with that in the model group,as well as the serum TNF-α,IL-1β and IL-6(P<0.05)24 hours after I/R.The pathological damage and interstitial edema alleviated in cerebral ischemia cortical, and the degeneration and necrosis of the neurons in the ischemic area significantly reduced in the exercise preconditioning group.Conclusion Exercise preconditioning may inhibit inflammatory response in I/R rats to protect neurological function from impairment.
cerebral ischemia-reperfusion;exercise preconditioning;tumor necrosis factor α;interleukin-1β;interleukin-6;inflammatory response
10.3969/j.issn.1006-9771.2015.01.006
R743.3
A
1006-9771(2015)01-0022-04
2014-11-19
2014-12-23)
1.哈尔滨市科技创新人才专项基金(青年后备人)(No.2014RFQGJ150);2.黑龙江中医药大学领军人才计划项目(No.2012RCL02);3.黑龙江省高校科技创新团队计划项目(No.2013TD007)。
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001;2.黑龙江中医药大学,黑龙江哈尔滨市150040。作者简介:朱路文(1983-),男,山东邹城市人,博士研究生,主治医师,主要研究方向:脑卒中中医康复的基础研究。通讯作者:唐强(1963-),男,四川大竹县人,博士,教授,主要研究方向:神经系统疾病中医康复基础与临床。E-mail:tangqiang1963@163.com。

