电针对脑缺血再灌注大鼠学习记忆能力及RhoA蛋白表达的影响①
吴羽楠,张蕴,林如辉,陈立典,陶静
电针对脑缺血再灌注大鼠学习记忆能力及RhoA蛋白表达的影响①
吴羽楠1,张蕴2,林如辉3,陈立典4,陶静1
目的探讨电针神庭、百会穴对脑缺血再灌注模型大鼠学习记忆能力的影响及其可能机制。方法45只雄性Sprague-Dawley大鼠随机分为假手术组(n=15)、模型组(n=15)和电针组(n=15)。模型组和电针组均采用左侧大脑中动脉缺血(MCAO)再灌注模型。电针组电针神庭、百会穴共7 d。采用Morris水迷宫测试观察大鼠学习记忆能力;尼氏染色观察大鼠海马神经元形态结构变化;Western blotting法检测大鼠左侧海马RhoA蛋白的表达。结果与模型组相比,电针组学习记忆能力改善(P<0.05),海马神经元损伤减少(P<0.05),海马组织中RhoA蛋白表达降低(P<0.05)。结论电针能够改善脑缺血再灌注大鼠学习记忆能力,其机制可能与抑制RhoA蛋白表达有关。
脑缺血;电针;学习记忆;RhoA;大鼠
[本文著录格式]吴羽楠,张蕴,林如辉,等.电针对脑缺血再灌注大鼠学习记忆能力及RhoA蛋白表达的影响[J].中国康复理论与实践,2015,21(1):17-21.
CITED AS:Wu YN,Zhang Y,Lin RH,et al.Effects of electroacupuncture on learning and memory ability and RhoA expression in rats after cerebral ischemic-reperfusion[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(1):17-21.
脑卒中是目前常见的导致死亡和残疾的原因之一[1]。据调查,脑卒中后1个月内,认知功能障碍发生率约30%[2],患者在康复治疗中主动配合能力严重受限,从而影响总体功能康复。针刺神庭、百会穴是治疗认知功能障碍行之有效的方法,但其机制尚不明确[3-5]。RhoA是Rho蛋白家族的主要成员,可与三磷酸鸟苷(guanosine triphosphate,GTP)结合参与细胞间信号转导。RhoA蛋白活化可抑制轴突出芽、生长,缩短树突长度[6-7]。研究表明,大鼠脑缺血后,缺血海马CA1区RhoA表达升高,而抑制RhoA表达可明显改善缺血大鼠学习记忆功能[8]。本研究观察电针神庭、百会穴对脑缺血再灌注大鼠学习记忆能力、海马神经元形态结构及RhoA蛋白表达的影响。
1 材料与方法
1.1 实验动物与分组
清洁级雄性健康Sprague-Dawley大鼠45只,体质
量(250±30)g,由上海斯莱克实验动物有限责任公司提供,合格证号:SCXK(泸)2012—0002。于福建中医药大学实验动物中心适应性喂养。采用随机数字表法将所有大鼠编号,分为假手术组(n=15)、模型组(n= 15)、电针组(n=15)。实验过程均严格按照国际动物保护和使用指南的规定进行。
1.2 主要试剂和仪器
尼氏染色液:上海碧云天生物技术有限公司。RhoA一抗:ABCAM公司。β-actin一抗、辣根过氧化物酶二抗:CELL SIGNALING TECHNOLOGY公司。Morris水迷宫:中国医学科学院药物研究所。Image-lab图像分析系统:BIO-RAD LABORATORIES公司。
1.3 模型制备
术前12 h大鼠禁食。参照改良Longa方法[9]制备左侧大脑中动脉闭塞模型。大鼠称重后10%水合氯醛0.3 ml/100 g腹腔注射麻醉。颈前正中开口,充分暴露并钝性分离颈总动脉、颈外动脉、颈内动脉。结扎颈总动脉近心端及分叉处颈外动脉,微动脉夹夹闭颈内动脉。在颈总动脉结扎处附近剪一小口,将备好的栓线插入颈内动脉,插入长度18.0~22.0 mm。撤去颈内动脉血管夹,缓慢推动栓线至大脑前动脉近端。固定栓线,缝合伤口。2 h后回抽栓线至颈总动脉分叉处,形成缺血再灌注模型。假手术组只分离动脉,不结扎、插线。手术结束后,动物放置于室温(24℃)环境下苏醒,正常喂养。
动物苏醒后按Longa评分判断模型是否成功:0分,无神经功能缺损体征;1分,不能完全伸展对侧前爪;2分,向偏瘫侧转圈;3分,行走时向偏瘫侧倾倒;4分,不能自发行走,意识丧失。评分1~3分者纳入实验。
1.4 干预方法
假手术组置于普通笼中饲养,予同等条件抓取。模型组造模后回笼饲养,予同等条件抓取。电针组参考《实验针灸学》取大鼠神庭和百会穴,使用华佗牌30号0.5寸毫针,接G6805电针仪,电压峰值6 V,以针体轻轻抖动为度,疏密波,频率1~20 Hz。每次30 min,每天1次,共7 d。于手术后第2天开始治疗,直至动物被处死。
1.5 Morris水迷宫测试
于术后3 d进行。水迷宫水池圆桶形,直径120 cm,深50 cm,水深30 cm,水温(26±2)℃。池壁4个等距离点分水池为4个象限,池壁外标4个入水点,任选一象限在其中央放置平台。平台直径6 cm,高28 cm,没于水面下2 cm,水池周围参照物保持不变。共训练4 d。
1.5.1 定位航行实验(place navigation)
将大鼠按顺时针方向依次由第1象限、第2象限、第3象限、第4象限入水点顺序面向池壁放入水中。如果大鼠在90 s内爬上平台,并停留3 s以上,则认为大鼠找到平台,记录逃避潜伏期(escape latency)。如果90 s内大鼠未找到平台,则拖拽其尾部,将其引导到平台,停留10 s,潜伏期计为90 s。
1.5.2 空间探索实验(spatial probe)
术后第7天,撤去平台,取任意入水点将大鼠放入水中,观察并记录90 s内大鼠穿过原平台区域的次数。
1.6 取材及检测
1.6.1 尼氏染色
麻醉下开胸,生理盐水200 ml经左心室快速冲洗,4%多聚甲醛(pH=7.4)400 ml灌流固定。取脑置4%多聚甲醛内,4℃固定24~48 h。定位脑缺血区,常规脱水,石蜡包埋,冠状切片,片厚5 μm。二甲苯脱蜡、梯度酒精脱水,尼氏染色液染色,中性树脂封片。光镜下观察左侧大脑海马组织CA1区和CA3区尼氏小体变化。于高倍镜下(×400)随机选取2个视野,计数残存的神经元细胞数目,取平均值。
1.6.2 Western blotting
取左侧海马组织置液氮罐中速冻,-80℃冰箱保存。取海马组织100 mg,加裂解缓冲液1 ml和苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)10 μl,充分研磨后离心,取上清。BCA蛋白浓度测定法测定蛋白浓度。样品蛋白变性后,取样品蛋白50 μg,12%SDS-PAGE电泳,转移到PVDF膜,封闭液封闭2 h,分别用RhoA、β-actin一抗(1∶1000)孵育,4℃过夜,用辣根过氧化物标记的二抗(1∶5000)室温孵育1 h。将PVDF膜放图像扫描仪上,避光配置显色液并覆盖PVDF膜,Image-lab图像分析系统分析。
1.7 统计学分析
采用SPSS 18.0统计软件进行统计分析。所有数据均满足方差齐性(P>0.05),以(±s)表示,采用单因素方差分析,两两比较采用LSD法。显著性水平α= 0.05。
2 结果
2.1 Morris水迷宫测试
随着训练时间增加,各组大鼠逃避潜伏期呈逐渐缩短趋势。从术后3 d起,与假手术组相比,模型组逃避潜伏期明显延长(P<0.01);与模型组相比,电针组逃避潜伏期时间缩短(P<0.05)。术后7 d,模型组大鼠跨越平台次数比假手术显著减少(P<0.001),电针组比模型组增加(P<0.05)。见表1。
2.2 尼氏染色
假手术组海马CA1、CA3区锥体细胞形态结构完整,排列紧密,核膜核仁清晰,大量活性神经元存在。模型组海马CA1、CA3区神经元细胞大量丢失,残存神经元固缩破裂,排列疏松,核仁消失,出现空泡样变。电针组海马CA1、CA3区神经元细胞结构较完整性(图1)。
与假手术组相比,模型组海马CA1、CA3区神经元减少,电针组神经元数比模型组增多(P<0.05)。见表2。
2.3 Western blotting
与假手术相比,模型组海马RhoA蛋白表达增加(P<0.05),电针组RhoA蛋白表达比模型组减少(P<0.05)。见图2、表3。
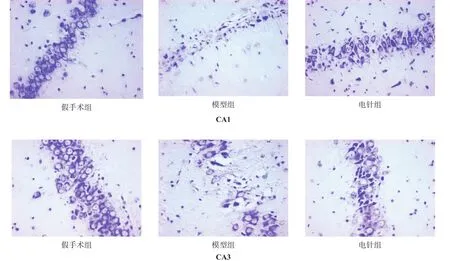
图1 各组大鼠海马CA1、CA3区神经元(尼氏染色,400×)

表2 各组大鼠海马CA1、CA3区存活神经元数比较(/HD)

表3 各组大鼠海马RhoA表达比较(/β-actin)
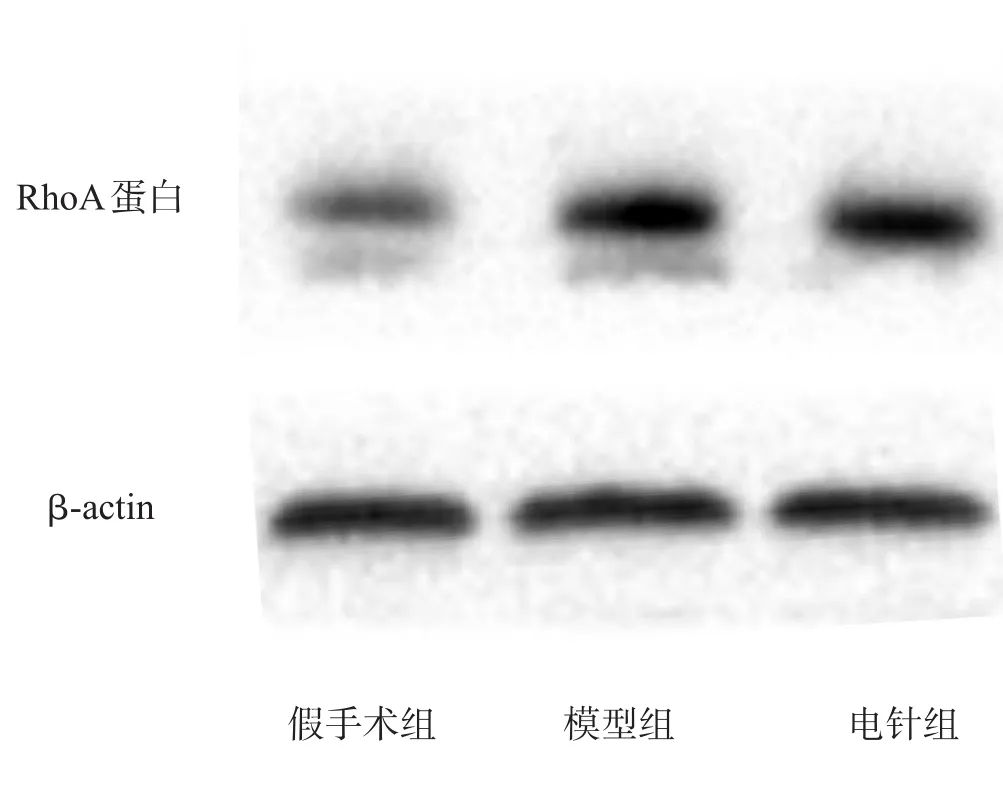
图2 各组大鼠海马组织RhoA蛋白表达
3 讨论
督脉属于奇经八脉之一,上至风府,入属于脑,总督一身之阳脉,是“阳脉之海”,历代医家素有“病变在脑,首取督脉”之说。神庭穴为督脉、足太阳、阳明之会;百会穴为督脉、足太阳之会。神庭、百会穴主要用于治疗心神病症。
海马区域是重要的学习与记忆的存储结构[10-11]。脑缺血后会脑萎缩、皮质变薄,神经元细胞发生病理性变化,当这些病理改变发生在海马等与学习记忆有关的脑区时,便会出现学习记忆障碍[12]。
Morris水迷宫是用于啮齿类动物学习记忆功能评估的重要工具,由英国生理学家Morris设计,目前已成为一种研究空间学习和记忆机制的标准工具。本研究采用Morris水迷宫初步证实电针神庭、百会可以明显提高脑缺血再灌注损伤大鼠的学习和记忆能力。同时观察到,电针可以减轻脑缺血再灌注对大鼠海马组织中神经元细胞结构的破坏。
Rho家族蛋白是肌动蛋白细胞骨架的重要调节子,可以将胞外的肌动蛋白调节信号传导至胞内,在神经元的发生发展过程中有重要作用,包括轴突的生长和延伸,树突棘的形成和维持[13]。RhoA是Rho家族Rho亚族中的成员。RhoA激活可以抑制轴突出芽和生长,其细胞内信号传递可能机制为髓鞘抑制因子Nogo-A、髓磷脂相关糖蛋白(myelin-associated glycoprotein,MAG)和少突胶质细胞/髓磷脂糖蛋白(oligodendrocyte/myelin glycoprotein,OMGP)的激活,作用于Nogo-66受体(NgR),激活RhoA,通过其下游Rho激酶调节肌动蛋白的活动,继而引起轴突生长锥的崩溃[14-16]。同时,活性RhoA可以缩短树突的长度,其可能机制为RhoA可以激活下游Rho激酶,Rho激酶直接引起肌球蛋白轻链(myosinlight chain,MLC)磷酸化,形成磷酸化MLC(myosinlight chain phosphatase, MLCP),并最终导致肌球蛋白回缩[17-18]。
突触的可塑性是突触发育及神经通路重塑的先决条件,也是学习和记忆的形态学基础[19]。大鼠脑缺血再灌注后,缺血区周围脑组织RhoA表达升高,抑制RhoA可明显改善缺血大鼠学习记忆功能。推测RhoA在脑缺血后学习记忆功能的恢复中起着重要作用。本研究中,电针组RhoA蛋白表达减少与大鼠学习记忆能力的变化一致,提示电针促进脑缺血再灌注大鼠认知功能的恢复可能通过调节RhoA的表达实现。
综上所述,电针神庭、百会能够改善脑缺血大鼠学习记忆能力,其作用机理可能与电针治疗能够抑制脑缺血再灌注大鼠海马RhoA蛋白的表达以及其对脑缺血再灌注大鼠海马的神经保护作用有关。
[1]Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2013 update:a report from the American HeartAssociation[J].Circulation,2013,127(1):e6-e245.
[2]Hurford R,Charidimou A,Fox Z,et al.Domain-specific trends in cognitive impairment after acute ischaemic stroke[J].J Neurol,2013,260(1):237-241.
[3]Feng X,Yang S,Liu J,et al.Electroacupuncture ameliorates
cognitive impairment through inhibition of NF-kappaB-mediated neuronal cell apoptosis in cerebral ischemia-reperfusion in-
jured rats[J].Mol Med Rep,2013,7(5):1516-1522.
[4]冯晓东,刘娇,陈立典.电针对局灶性脑缺血大鼠学习记忆能力的影响及其机制[J].中国康复理论与实践,2013,19(3): 227-230.
[5]刘娇,冯晓东.电针百会、神庭穴配合康复训练治疗脑卒中后认知障碍临床研究[J].中医学报,2013,28(4):608-610.
[6]Auer M,Hausott B,Klimaschewski L.Rho GTPases as regulators of morphological neuroplasticity[J].Ann Anat,2011,193 (4):259-266.
[7]Georges PC,Hadzimichalis NM,Sweet ES,et al.The yin-yang of dendrite morphology:unity of actin and microtubules[J]. Mol Neurobiol,2008,38(3):270-284.
[8]Espinosa-Garcia C,Aguilar-Hernandez A,Cervantes M,et al. Effects of progesterone on neurite growth inhibitors in the hippocampus following global cerebral ischemia[J].Brain Res, 2014,1545:23-34.
[9]Longa EZ,Weistein PR,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989,20(1):84-91.
[10]Deng W,Aimone JB,Gage FH.New neurons and new memories:how does adult hippocampal neurogenesis affect learning and memory?[J].Nat Rev Neurosci,2010,11(5):339-350.
[11]Manns JR,Eichenbaum H.A cognitive map for object memory in the hippocampus[J].Learn Mem,2009,16(10):616-624.
[12]Zakharova EI,Storozheva ZI,Dudchenko AM,et al.Chronic cerebral ischaemia forms new cholinergic mechanisms of learning and memory[J].Int JAlzheimers Dis,2010,2010:954589.
[13]Govek EE,Newey SE,van Aelst L.The role of the Rho GTPases in neuronal development[J].Genes Dev,2005,19(1): 1-49.
[14]Nagai J,Goshima Y,Ohshima T.CRMP4 mediates MAG-induced inhibition of axonal outgrowth and protection against Vincristine-induced axonal degeneration[J].Neurosci Lett, 2012,519(1):56-61.
[15]Huo Y,Yin XL,Ji SX,et al.Inhibition of retinal ganglion cell axonal outgrowth through the Amino-Nogo-A signaling pathway[J].Neurochem Res,2013,38(7):1365-1374.
[16]Deng Q,Cai W,Li S,et al.Small Nogo-66-binding peptide promotes neurite outgrowth through RhoA inhibition after spinal cord injury[J].Brain Res Bull,2013,99:140-144.
[17]Gu H,Yu SP,Gutekunst CA,et al.Inhibition of the Rho signaling pathway improves neurite outgrowth and neuronal differentiation of mouse neural stem cells[J].Int J Physiol Pathophysiol Pharmacol,2013,5(1):11-20.
[18]Wang YH,Wang DW,Wu N,et al.Alpha-Crystallin promotes rat axonal regeneration through regulation of RhoA/rock/cofilin/MLC signaling pathways[J].J Mol Neurosci,2012,46 (1):138-144.
[19]Kasai H,Fukuda M,Watanabe S,et al.Structural dynamics of dendritic spines in memory and cognition[J].Trends Neurosci, 2010,33(3):121-129.
Effects of Electroacupuncture on Learning and Memory Ability and RhoA expression in Rats after Cerebral Ischemic-reperfusion
WU Yu-nan,ZHANG Yun,LIN Ru-hui,CHEN Li-dian,TAO Jing.College of Rehabilitation Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350108,China
Objective To explore the effects of electroacupuncture at Shenting(DU24)and Baihui(DU20)on learning and memory ability in the cerebral ischemia-reperfusion rats and its possible mechanism.Methods 45 male Sprague-Dawley rats were randomly divided into sham group(n=15),ischemia group(n=15)and electroacupuncture group(n=15).The latter 2 groups were modeled as focal cerebral ischemia-reperfusion injury,and the electroacupuncture group received electroacupuncture at Shenting(DU24)and Baihui(DU20)for 7 days. They were tested with Morris Water Maze,observed with Nissl's staining.The protein expression of RhoA was detected with Western blotting.Results The learning and memory ability improved in the electroacupuncture group(P<0.05),the injury of the neurons reduced(P<0.05)and the expression of RhoA in hippocampus decreased compared with the ischemia group(P<0.05).Conclusion Electroacupuncture could ameliorate the learning and memory ability in ischemia-reperfusion rats,which may relate with the inhibition of the expression of RhoAin hippocampus.
electrocerebral ischemia;acupuncture;learning and memory;RhoA;rats
10.3969/j.issn.1006-9771.2015.01.005
R743.3
A
1006-9771(2015)01-0017-05
2014-09-18
2014-11-06)
福建省康复技术协同创新中心资助项目(No.X2012004-协同)。
1.福建中医药大学康复医学院,福建福州市350108;2.黑龙江中医药大学,黑龙江哈尔滨市150040;3.福建中医药大学中西医结合研究院,福建福州市350108;4.福建中医药大学,福建福州市350108。作者简介:吴羽楠(1989-),女,汉族,福建福州市人,硕士研究生,主要研究方向:脑血管病的中西医结合康复治疗。通讯作者:陶静(1977-),女,汉族,江苏淮安市人,博士,副教授,硕士研究生导师,主要研究方向:脑血管病的中西医结合康复治疗。E-mail:taojing01@163.com。

