具有DPPH自由基抑制活性的蚕蛹蛋白酶解液脱色工艺优化
农珍妮,赵钟兴*,韦藤幼,覃欢欢,杨 武
(1.广西大学化学化工学院,广西高校资源化工应用新技术重点实验室,广西理工科学实验中心,广西 南宁 530004;2.广西民族大学相思湖学院,广西 南宁 530008)
具有DPPH自由基抑制活性的蚕蛹蛋白酶解液脱色工艺优化
农珍妮1,2,赵钟兴1,*,韦藤幼1,覃欢欢1,杨 武1
(1.广西大学化学化工学院,广西高校资源化工应用新技术重点实验室,广西理工科学实验中心,广西 南宁 530004;2.广西民族大学相思湖学院,广西 南宁 530008)
利用木瓜蛋白酶水解的蚕蛹蛋白酶解液作为研究原料,根据响应面试验设计方法,以脱色率和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除保持率作为响应面指标,得最佳脱色工艺条件为:活性白土、碱性钙基膨润土和膨润土按照质量比1∶1∶1混合为脱色剂、脱色剂用量1.9%、酶解液质量浓度9.61 mg/mL、pH 7.2、水浴温度60 ℃、振荡转速150 r/min、脱色时间1.0 h。在此条件下实验,得出DPPH自由基清除保持率84.5%、脱色率94.5%,与预测值相比误差值均小于5%,说明采用响应面试验设计方法对蚕蛹蛋白酶解液脱色体系进行优化具有较好的可靠性。最后再对脱色前后酶解液中各氨基酸含量进行比较,发现经脱色处理后酶解液中对DPPH自由基抑制有显著作用的疏水性氨基酸和芳香族氨基酸含量减少。
蚕蛹蛋白;DPPH自由基清除率;脱色;响应面分析
蚕蛹为蚕蛾科昆虫家蚕蛾的蛹,是养蚕业主要的副产物。蚕蛹蛋白占干蚕蛹质量的45%~50%[1],含有18种人体所需的氨基酸,其中8种人体必需氨基酸含量占氨基酸总量48%以上[2-3]。从目前研究结果来看蚕蛹蛋白酶解后产物具有较好的抗氧化活性[4-6],可以作为抗氧化活性肽来源应用到食品和医药行业,但是蚕蛹蛋白酶解液呈黄绿色,如果直接应用到食品添加剂或药物中在色泽上不易被消费者接受,因此需要对酶解液进行脱色处理。目前常用的脱色方法有活性炭法[7-8]、离子交换树脂法[9-10]、有机溶剂法[11-12]等,但这些方法存在蛋白损失率高、工艺复杂或造成二次污染等问题。膨润土(简称皂土)是一种具有较好物理吸附效果的天然水硅酸铝矿物石。膨润土经酸处理后在层间的金属离子被氢离子置换形成酸性中心,而具有对碱性物质的吸附能力和离子交换性能,该类型膨润土被称为活性白土(简称白土)。将膨润土经酸活化、碱负载可得到碱性钙基膨润土(简称碱土)[13-16],该类型膨润土由于在膨润土层间的羟基结构使其形成碱性中心对酸性物质吸附能力较强。本研究采用膨润土、活性白土和碱性钙基膨润土的混合材料作为脱色剂,对具有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基抑制活性的蚕蛹蛋白酶解液进行脱色研究,采用单因素试验和响应面优化脱色工艺条件[17-19],并通过液相色谱法分析脱色前后酶解液中各氨基酸含量的变化,为蚕蛹蛋白酶解液的脱色深加工提供理论依据。
1 材料与方法
1.1 材料与试剂
蚕蛹蛋白粉(蛋白含量85.1%)、碱性钙基膨润土实验室自制;缫丝后的蚕蛹 宜州市丰华缫丝厂;木瓜蛋白酶 南宁庞博生物有限公司;DPPH 美国Sigma公司;活性白土 河南亨润环保科技有限公司;皂土 上海试剂四厂;粉末活性炭 广东省台山市化工厂。其他试剂都为分析纯。
1.2 仪器与设备
1200高效液相色谱仪 美国Agilent公司;510型pH计 新加坡Eutech公司;4K15冷冻离心机 美国Sigma公司;冷冻干燥器系统 美国Labconco公司;UV-2501紫外-可见分光光度计 日本Shimadzu公司。
1.3 方法
1.3.1 脱色效果评价[20]

式中:A1为脱色前吸光度;A2为脱色后吸光度。
1.3.2 DPPH自由基抑制效果测定
DPPH自由基是一种稳定的有机自由基,其乙醇溶液呈紫色并在517nm波长处有强吸收峰,而当有抗氧化剂与DPPH自由基的单电子配对时,会使DPPH自由基乙醇溶液颜色变浅,其褪色程度与接受的电子数量呈线性关系,可用于检测自由基清除程度[5]。

式中:Ai为样品对DPPH自由基作用后的吸光度;Aj为测定中样品自身的吸光度;Ac为DPPH自由基自身的吸光度。

式中:Ri为蚕蛹蛋白酶解原液中DPPH自由基清除率/%;Rj为脱色后蚕蛹蛋白酶解液中DPPH自由基清除率/%。
1.3.3 蚕蛹蛋白酶解液的制备
选用木瓜蛋白酶为水解酶,以实验室已优化的工艺条件制备酶解液,该条件下DPPH自由基清除率为84.0%。
1.3.4 脱色工艺条件优化
将一定量脱色剂与20 mL蚕蛹蛋白酶解液混合后放入恒温水浴振荡器中,在一定温度和转速条件下振荡脱色后离心去除剩余脱色剂(5 000 r/min、20 min),上清液采用吸光度法检测脱色率和DPPH自由基清除保持率。
根据单因素试验结果,选取影响显著因素脱色剂用量(X1)、酶解液初始pH值(X2)和酶解液质量浓度(X3)为考察对象,以脱色率(Y1)和DPPH自由基清除保持率(Y2)为响应值,采用软件Design-Expert 8.0.6进行分析,影响因素水平及编码见表1。

表 1 中心组合试验因素水平及编码设计Table 1 Factors and coded levels used in CCD design
1.3.5 脱色前后蚕蛹蛋白酶解液中各氨基酸含量的比较
将脱色前后蚕蛹蛋白酶解液分别微滤浓缩后冷冻干燥,精确称取适量按照已建立的柱前衍生化-高效液相色谱法[21-22]测定各氨基酸含量,比较脱色前后各氨基酸含量的变化。
2 结果与分析
2.1 蚕蛹蛋白酶解液脱色检测波长的确定
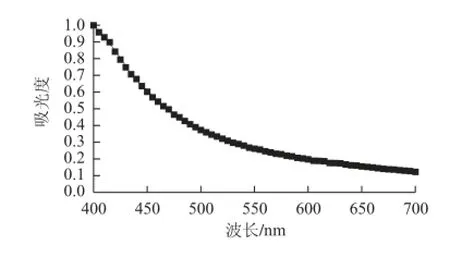
图 1 蚕蛹蛋白酶解液吸光度与波长关系曲线Fig.1 The maximum absorption peak of PSP hydrolyzate
在波长400~700 nm可见光范围内,对5 mg/mL蚕蛹蛋白酶解液扫峰测定吸光度,如图1所示。从图1可以看出,随波长增加,吸光度不断下降,在可见光区不存在明显吸收峰,其可能原因是有色物质较多吸收峰较复杂,从实验现象来看蚕蛹蛋白酶解液呈浅黄绿色,从溶液互补色角度考虑选择550 nm为检测波长,计算脱色率[23]。
2.2 蚕蛹蛋白脱色条件工艺优化
2.2.1 脱色剂种类对脱色效果的影响
选用活性炭、皂土、白土、碱土按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量1.0%、质量浓度9.65 mg/mL的酶解液初始pH 7.0、振荡转速100 r/min、水浴温度40 ℃、脱色时间1.0 h。
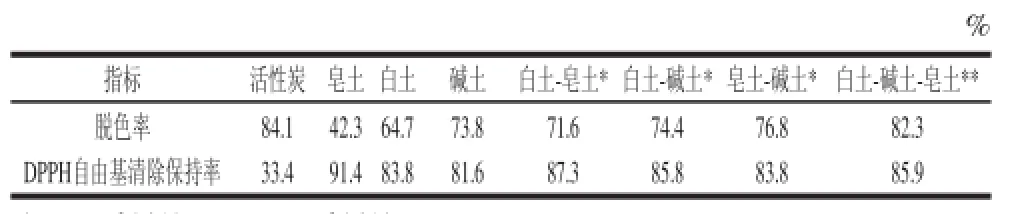
表 2 脱色剂种类的选择Table 2 Selection of decolorant
活性炭和皂土主要是以物理吸附为主;白土在层间具有酸性中心,由于扩散作用能使蛋白酶解液中部分具有碱性的有色物质被吸附而产生脱色效果,因而兼具物理吸附和化学吸附作用;碱土层间的氢氧根除了具有阴离子交换功能外,还能与水分子形成氢键,可选择性吸附反应体系中部分有色物质,因而也兼具物理吸附和化学吸附作用。从表2可以看出,活性炭脱色效果最好,但是其作为物理吸附在去除有色物质的同时也将蛋白质、多肽一同吸附导致DPPH自由基清除保持率太低而被排出;皂土也是以物理吸附为主,虽然DPPH自由基清除保持率很高但是脱色效果差;白土和碱土同时具有物理吸附和化学吸附两种功效,将其混合使用由于白土的酸性中心和碱土的碱性中心都在膨润土的层间,相互之间很难发生酸碱中和反应,此时DPPH自由基清除保持率和脱色率都较高。考虑到实验工作量的原因,只对碱性白土、活性白土和皂土3种脱色剂进行简单复配,选择2种脱色剂质量比1∶1混合和3种脱色剂质量比1∶1∶1混合共4个实验点进行实验,通过表2的数据分析确定选择白土、碱土和皂土按照1∶1∶1混合制备脱色剂[24-25]。
2.2.2 脱色剂用量对脱色效果的影响
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:质量浓度9.65 mg/mL的酶解液初始pH 7.0、振荡转速100 r/min、水浴温度40 ℃、脱色时间1.0 h。
从图2可以看出,脱色率随脱色剂用量的增加不断上升,与此同时脱色剂用量增加也会导致DPPH自由基清除保持率不断下降,当脱色剂用量为2.0%时,脱色率已取得较好效果而DPPH自由基清除保持率也没有较明显的下降。
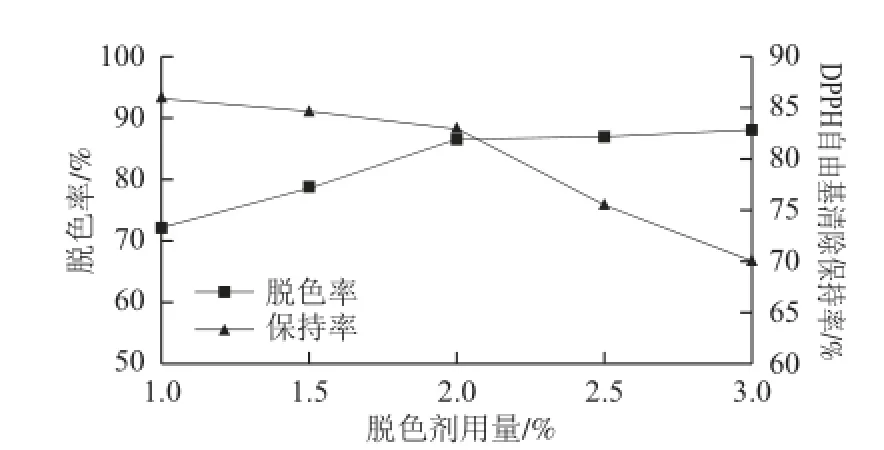
图 2 脱色剂用量对脱色效果的影响Fig.2 Effect of decolorant concentration on the decolorization effi ciency
2.2.3 酶解液初始pH值对脱色效果的影响
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量2.0%、质量浓度9.65 mg/mL的酶解液、振荡转速100 r/min、水浴温度40℃、脱色时间1.0 h。

图 3 酶解液初始pH值对脱色效果的影响Fig.3 Effect of hydrolyzate pH on the decoloring effi ciency
从图3可以看出,不同酶解液初始pH值有不同的脱色率和DPPH自由基清除保持率,这是因为溶液的pH值往往会影响吸附剂或被吸附质解离情况,进而影响吸附量。在pH值大于7.0和pH值小于7.0时的脱色率和DPPH自由基清除保持率都较低,白土-皂土-碱土混合既有物理吸附和化学吸附两种功效,在pH值为7.0时脱色率和DPPH自由基清除保持率为最高。
2.2.4 脱色时间对脱色效果的影响
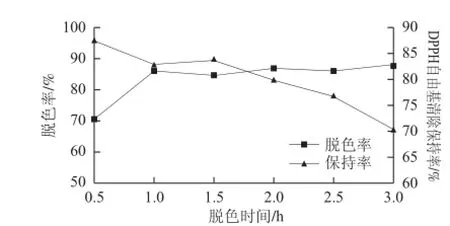
图 4 脱色时间对脱色效果的影响Fig.4 Effect of decolorization time on the decolorization effi ciency
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量2.0%、质量浓度9.65 mg/mL的酶解液初始pH 7.0、振荡转速100 r/min、水浴温度40 ℃。
从图4可以看出,脱色时间超过1.0 h后脱色率不再明显上升,而DPPH自由基清除保持率则下降明显,可能的主要原因是吸附剂具有选择性吸附作用,随脱色时间延长酶解液中被吸附物质逐渐由色素类物质向蛋白、多肽等小分子活性物质转变,导致DPPH自由基清除保持率不断下降,综合考虑选择脱色时间1.0 h为最佳值。
2.2.5 水浴温度对脱色效果的影响
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量2.0%、质量浓度9.65 mg/mL的酶解液初始pH 7.0、振荡转速100 r/min、脱色时间1.0 h。

图 5 水浴温度对脱色效果的影响Fig.5 Effect of decolorization temperature on the decolorization effi ciency
由图5可以看出,随着温度的升高脱色率呈现先快速上升后缓慢增加的过程,因为在低温时吸附过程往往在短时间内达不到平衡,随温度升高吸附速率加快并出现吸附量增加的情况,且皂土的吸附属于物理吸附,当吸附达到平衡时,升高温度反而会使吸附量增量降低。随着温度的升高DPPH自由基清除保持率变化并不大,但当温度升高到70 ℃时DPPH自由基活性抑制肽存在温度失活情况,最终选择60 ℃作为最佳水浴温度。
2.2.6 振荡转速对脱色效果的影响
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量2.0%、质量浓度9.65 mg/mL的酶解液初始pH 7.0、水浴温度60 ℃、脱色时间1.0 h。
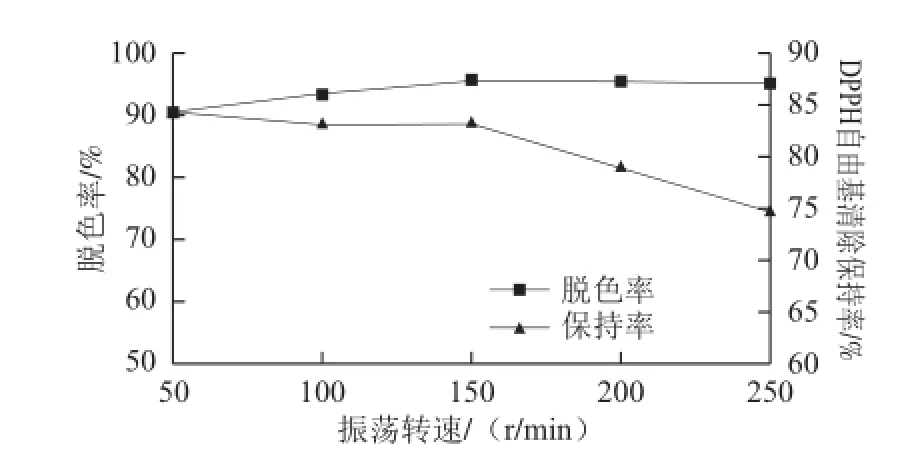
图 6 振荡转速对脱色效果的影响Fig.6 Effect of rotation speed on the decolorization effi ciency
从图6可以看出,随转速增加脱色率不断增加,到150 r/min已达到最大值,而DPPH自由基清除保持率随转速的增加不断下降,其下降原因与脱色时间相同。
2.2.7 酶解液质量浓度对脱色效果的影响
选用白土、碱土和皂土混合物为脱色剂,按照1.3.4节实验步骤脱色,脱色条件为:脱色剂用量2.0%、酶解液初始pH 7.0、水浴温度60 ℃、振荡转速150 r/min、脱色时间1.0 h。
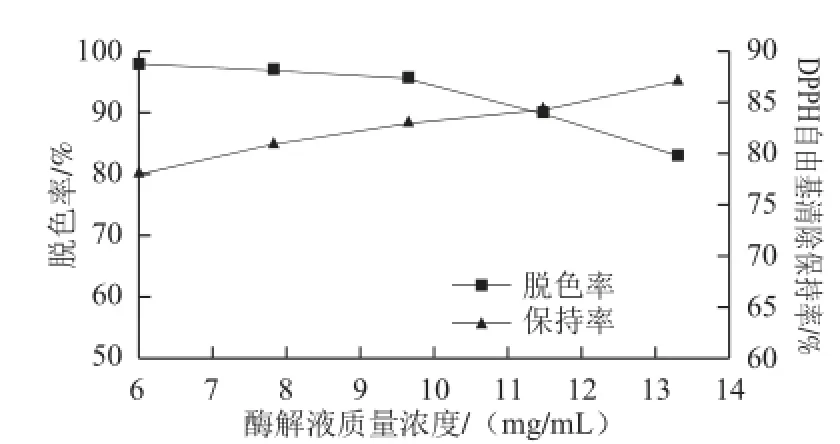
图 7 酶解液质量浓度对脱色效果的影响Fig.7 Effect of hydrolysate concentration on the decolorization effi ciency
由图7可以看出,因吸附剂的单位负载量有限,随酶解液质量浓度升高脱色率不断下降,而酶解液单位质量浓度所含抗氧化肽越多DPPH自由基清除保持率也越高,综合考虑选择酶解液质量浓度为9.65mg/mL作为最佳质量浓度。
2.3 响应面法优化工艺的确定
2.3.1 回归方程的建立及方差分析
对变量Y1、Y2和自变量X1、X2、X3,应用最小二乘法假设拟合二次多元回归方程(模型)为:

式中:A0为常数项;A1、A2、A3为一次项;A12、A13、A23为交互项;A11、A22、A33为平方项的回归方程系数,为求二次方程各项系数,利用统计软件Design-Expert 8.0.6来进行试验设计。
按照表1的设计方案得到结果如表3所示。对表3中数据进行方差分析、参数估计及显著性检验,具体结果见表4、5,并通过回归分析得二次多元回归方程(模型)为:
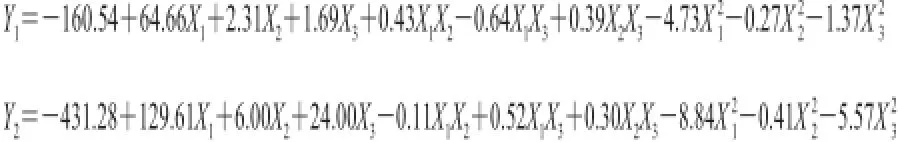
由表4可以看出,脱色率(Y1)的回归方程极显著,失拟项F检验不显著(P=0.082 2>0.05),说明回归方程的拟合程度较好且模型调整确定系数R为0.974 0,即能解释97.40%响应值的变化,说明该模型基本适合蚕蛹蛋白酶解体系中脱色率的分析和预测,且X1、X2、X3、、影响极显著(P<0.01)。由表5可以看出,DPPH自由基清除保持率(Y2)的回归方程极显著,失拟项F检验不显著(P=0.062>0.05),说明回归方程的拟合程度较好且模型调整确定系数为0.881 9,即能解释88.19%响应值的变化,说明该模型基本适合蚕蛹蛋白酶解体系中DPPH自由基清除保持率的分析和预测,且X3、影响极显著(P<0.01)。这表明响应值Y1、Y2的变化具有一定复杂性,各试验因素对响应值不是简单线性关系。

表 3 中心组合试验设计方案和结果Table 3 CCD experimental scheme with predicted and experimental results
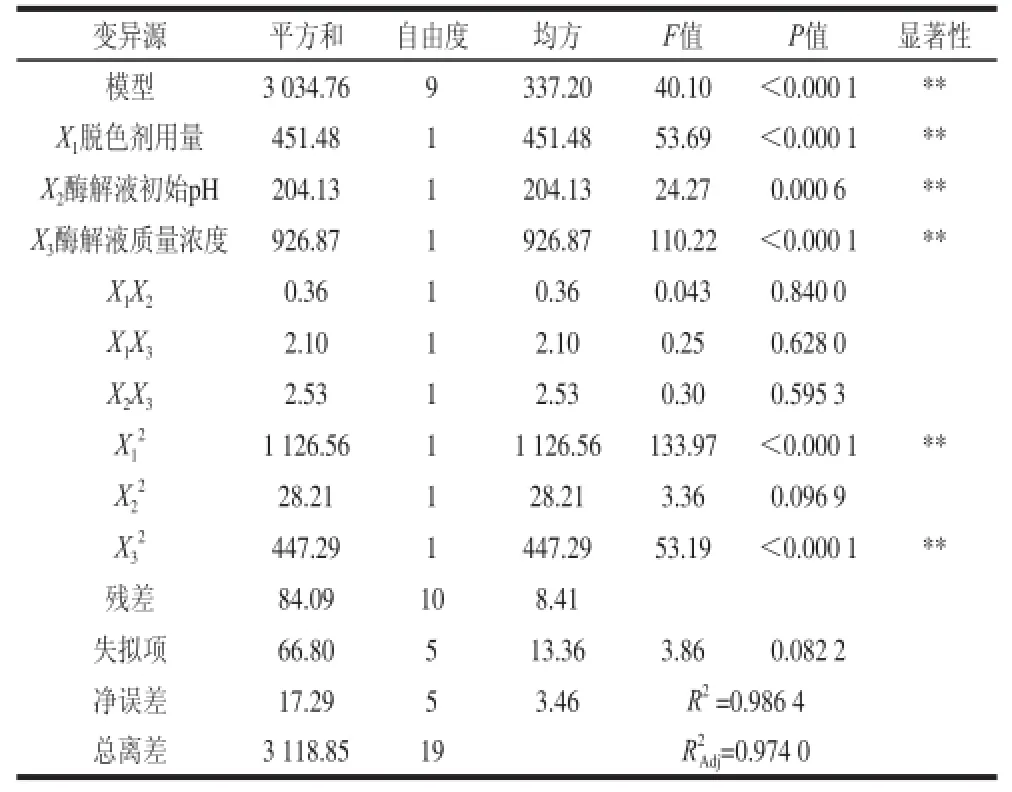
表 4 脱色率为响应值的回归方程方差分析表Table 4 Analysis of variance of regression model for decolorization rate

表 5 DPPH自由基清除保持率为响应值的回归方程方差分析表Table 5 Analysis of variance of regression model for retention rate of DPPH radical scavenging activity
2.3.2 响应面分析结果


图 8 各因素交互作用的响应面图Fig.8 Response surface plots for the effects of three factors and their interactions on the decolorization effi ciency and the retention rate of DPPH radical scavenging activity
由图8可知,随酶解液初始pH值增加,脱色率和DPPH自由基清除保持率呈现先增加后减小的趋势,最佳pH值在7.0左右,同时随脱色剂用量的增加和酶解液质量浓度的降低脱色率不断增加而DPPH自由基清除保持率不断下降。
2.3.3 最佳酶解工艺的确定和验证
因为实验的最终目标是获得同时具有较高DPPH自由基清除保持率和脱色率的脱色酶解液,通过Design-Expert分析获得最佳脱色条件为脱色剂用量1.9%、质量浓度9.61 mg/mL的酶解液初始pH 7.2、水浴温度60 ℃、振荡转速150 r/min、脱色时间1.0 h,系统预测DPPH自由基清除保持率为83.7%、脱色率为93.9%。采用该工艺条件进行实验验证,平行3次取平均值,得到DP PH自由基清除保持率为84.5%、脱色率为94.5%,与模型预测值基本相符,说明回归方程可以应用于实践。
2.4 脱色前后蚕蛹蛋白酶解液中各类氨基酸含量的比较
按照1.3.5节对脱色前后蚕蛹蛋白酶解液中各氨基酸成分进行分析,结果如表6所示,其中脱色前酶解液用SN1表示,脱色后酶解液用SN2表示。

表 6 脱色前后蚕蛹蛋白酶解液氨基酸组成Table 6 Amino acid composition of decolorized and non-decolorized hydrolyzate
从表6可以看出,SN1中疏水性氨基酸含量为49.2%,高于SN2的37.6%。其中脯氨酸(Pro)含量SN1为7.8%,高于SN2的7.4%;芳香族氨基酸(Trp、Phe、Tyr)含量SN1为19.2%,高于SN2的15.8%,不同氨基酸组分的改变,主要是因为脱色剂中碱性钙基膨润土在层间的羟基结构对酸性物质吸附能力较强产生选择性吸附引起[26]。该结果与相关研究[27-30]具有疏水性氨基酸残基或羧基端存在Pro、芳香族氨基酸残基的多肽有较高抗氧化抑制活性的结论相符,该结论与实验结果中DPPH自由基清除率SN1大于SN2的结论相一致。
3 结 论
以经木瓜蛋白酶水解具有较高DPPH自由基清除率的蚕蛹蛋白酶解液为原料,确定选用活性白土、碱性钙基膨润土和膨润土按照质量比1∶1∶1混合作为脱色剂进行脱色工艺研究,以脱色率和DPPH自由基清除保持率作为指标通过单因素和响应面试验设计得酶解工艺条件为:脱色剂用量1.9%、酶解液质量浓度9.61 mg/mL的酶解液初始pH 7.2、水浴温度60 ℃、振荡转速150 r/min、脱色时间1.0 h。在此条件下,DPPH自由基清除保持率为84.5%(DPPH自由基清除率为71.0%)、脱色率为94.5%,并通过实验验证其误差值小于5%,说明采用响应面试验设计方法对蚕蛹蛋白酶解体系进行优化具有较好的可靠性。最后再对脱色前后酶解液中各氨基酸含量进行比较,发现经脱色处理后酶解液中对DPPH自由基抑制有显著影响的疏水性氨基酸和芳香族氨基酸含量减少,该结论与实验结果相符。
[1] 胡居吾, 范青生. 蚕蛹蛋白精制工艺研究概况[J]. 中国食品添加剂, 2004(5): 25-28.
[2] 胡建平, 刘可桃. 蚕蛹蛋白的提取工艺及综合利用研究进展[J]. 安徽农学通报, 2011, 17(11): 185-186.
[3] 李国荣, 张华峰, 李建科, 等. 蚕蛋白质资源的研究现状及其在食品工业中的应用[J]. 食品工业 科技, 2012, 33(5): 396-401.
[4] 闵建华, 李建科, 陈婷. 蚕蛹多肽的制备工艺及其体外抗氧化活性[J].食品科学, 2009, 30(14): 123-126.
[5] 赵钟兴, 廖丹葵, 孙建华, 等. 蚕蛹蛋白酶解产物体外抗氧化和降血压活性筛选及响应面工艺优化[J]. 食品科学, 2011, 32(23): 186-191.
[6] 吴晓霞, 李建科, 张研宇. 蚕蛹油超声波辅助萃取及其抗氧化稳定性[J]. 中国农业科学, 2010, 43(8): 1677-1687.
[7] 章绍兵, 甘晓露, 龚琴. 花生蛋白酶解液的活性炭脱色工艺研究[J].河南工业大学学报: 自然科学版, 2011, 32(2): 10-14.
[8] 张立峰, 刘庆富, 宁海风. 活性炭对大豆低聚糖脱色效果研究[J]. 粮食与油脂, 2013, 26(1): 51-53.
[9] 马永香, 华欲飞, 孔祥珍, 等. 离子交换树脂对大豆糖蜜上清液脱盐脱色工艺的研究[J]. 中国油脂, 2013, 38(1): 70-75.
[10] LIU Jun, LUO Jiangguang, SUN Yi, et al. A simple method for the simultaneous decoloration and deproteinization of crude levan extract from Paenibacillus polymyxa EJS-3 by macroporous resin[J]. Bioresource Technology, 2010, 101(15): 6077-6083.
[11] 赵华, 王虹, 任晶, 等. 响应面法提取玉米醇溶蛋白的工艺优化[J].食品研究与开发, 2012, 33(5): 38-44.
[12] 郑仕远, 谢志刚, 曹优明, 等. 蚕蛹的溶剂法一步脱脂、脱色、除臭工艺研究[J]. 食品科技, 2003, 24(8): 49-50.
[13] 韦藤幼, 童张法, 吴璇. 碱性钙基膨润土及其制备方法: 中国, ZL200510101332.X[P]. 2009-07-08.
[14] 赵娟, 韦藤幼, 潘远凤, 等. 碱性白土的制备及其脂肪酸脱除机理研究[J]. 广西大学学报, 2011, 36(3): 379-384.
[15] ZHANG Hanbing, TONG Zhangfa, WEI Tengyou, et al. Removal characteristics of Zn(Ⅱ) from aqueous solution by alkaline Cabentonite[J]. Desalination, 2011, 276: 103-108.
[16] 张寒冰, 胡雪玲, 韦藤幼, 等. 碱性钙基膨润土的制备及其应用研究进展[J]. 化工进展, 2012, 31(7): 1395-1401.
[17] 涂宗财, 王艳敏, 迟海霞, 等. 响应面法优化豆豉蛋白酶解工艺[J].食品与发酵工业, 2009, 35(6): 116-120.
[18] 张海祥, 魏兆军, 周乐春, 等. 响应曲面法优化动物蛋白酶水解脱脂蚕蛹蛋白的工艺[J]. 食品科学, 2009, 30(24): 188-192.
[19] 刘石生, 林志锋, 周国英, 等. 响应面法优化罗非鱼肉内源酶酶解工艺[J]. 现代食品科技, 2010, 26(1): 85-88.
[20] 章绍兵, 甘晓露, 龚琴. 琴花生蛋白酶解液的活性炭脱色工艺研究[J].河南工业大学学报: 自然科学版, 2011, 32(2): 10-14.
[21] 吕汶骏, 赵钟兴, 廖丹葵, 等. 蚕蛹蛋白及其水解产物中氨基酸组成分析[J]. 食品科学, 2012, 33(12): 228-232.
[22] 秦伟佳, 赵钟兴, 吕汶骏, 等. 蚕蛹蛋白精制及其氨基酸成分分析[J].食品工业科技, 2013, 34(13): 197-201.
[23] 郑为完, 徐慧诠, 周小娟, 等. 可溶性米渣水解蛋白粉的脱色工艺[J].南昌大学学报: 工科版, 2009, 31(1): 14-17.
[24] 赵欢欢, 刘玉兰, 张小涛, 等. 吸附法脱除芝麻油中苯并芘及脱色效果研究[J]. 粮油食品科技, 2014, 21(4): 23-27.
[25] 沈芸, 翁新楚, 宋红生, 等. 凹凸棒土对蚕蛹油的脱色[J]. 上海大学学报: 自然科学版, 2011, 17(5): 687-690.
[26] 霍英霞. 豆油碱性白土脱酸工艺及动力学研究[D]. 南宁: 广西大学, 2013.
[27] REN Jiaoyan, ZHAO Mouming, SHI J, et al. Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionizationmass spectrometry[J]. Food Chemistry, 2008, 108(2): 727-736.
[28] KIM S K, KIM Y T, BYUM H G, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4): 1984-1989.
[29] LI Yaowang, LI Bo, HE Jiguo, et al. Structure-activity relationship study of antioxidative peptides by QSAR modeling: the amino acid next to C-terminus affects the activity[J]. Journal of Peptide Science, 2011, 17(6): 454-462.
[30] JIANG Haiping, TONG Tianzhe, SUN Jianghua, et al. Purifi cation and characterization of antioxidative peptides from round scad (Decapterus maruadsi) muscle protein hydrolysate[J]. Food Chemistry, 2014, 154(5): 158-163.
Decolorization of Silkworm Pupae Protein Hydrolyzate with DPPH Radical Scavenging Activity
NONG Zhenni1,2, ZHAO Zhongxing1,*, WEI Tengyou1, QIN Huanhuan1, YANG Wu1
(1. Guangxi Institute of Science Experimental Center, Guangxi Colleges and Universities Key Laboratory of New Chemical Application Technology in Resources, School of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China; 2. College of Xiangsihu, Guangxi University for Nationalities, Nanning 530008, China)
Papain hydrolyzate of silkworm pupae protein with DPPH radical scavenging activity was decolorized by the combined use of activated clay, alkaline Ca-bentonite and bentonite. Based on decolorization effi ciency and retention rate of radical scavenging activity, the decolorization conditions were optimized by using single-factor design and central composite design (CCD) coupled with response surface methodology (RSM). When the hydrolyzate with a concentration of 9.61 mg/mL and an initial pH of 7.2 was added with activated clay:alkaline Ca-bentonite:bentonite (1:1:1) in a proportion of 1.9% and incubated for 1.0 h in a thermostatically controlled water at 60 ℃ with shaking at a speed of 150 r/min, it retained 84.5% of its original DPPH radical scavenging activity and the decolorization rate was 94.5%, both close to the predicted values with a relative error less than 5%, suggesting the reliability of the developed response surface model. Comparing the amino acid composition of the decolorized hydrolyzate with that of the untreated one, it was found that the contents of hydrophobic and aromatic amino acids which are signifi cantly effective in inhibiting DPPH free radical were reduced after the decolorization treatment.
silkworm pupae protein; DPPH radical scavenging rate; decolorization; response surface methodology
TS201.2
A
1002-6630(2015)02-0012-07
10.7506/spkx1002-6630-201502003
2014-06-30
国家自然科学基金青年科学基金项目(31401629);广西自然科学基金项目(2013GXNSFBA019031);河池市科学研究与技术开发计划项目(河科攻1489-1-6)
农珍妮(1980—),女,讲师,硕士研究生,研究方向为生物化工。E-mail:164293010@qq.com
*通信作者:赵钟兴(1979—),男,副教授,博士,研究方向为生物化工。E-mail:zzxx@gxu.edu.cn

