经皮椎体成形术联合射频消融术治疗脊柱转移瘤
张亚辉,刘 鸣
(1.鄢陵县中医院骨科,河南 许昌461200;2.郑州大学第一附属医院骨科,河南 郑州450052)
转移性肿瘤是危害人类健康的肿瘤并发症之一,除好发于肺、肝等脏器之外,还容易转移至脊柱,脊柱转移瘤的3 个主要原发疾病为乳腺癌(31%)、肺癌(22%)和前列腺癌(8%)[1]。针对脊柱转移瘤的治疗,当前尚无理想的治疗方案,用姑息方法治疗来缓解患者的病痛成了当前治疗脊柱转移瘤的常用方法[2]。近年来出现并广泛使用的经皮椎体成形术(percutaneous vertebroplasty,PVP)可以纠正椎体塌陷和畸形,增加肿瘤侵犯椎体的强度,从而使患者疼痛得到缓解,改善患者的生活质量。射频消融术(radiofrequency ablation,RFA)是将电极置入肿瘤中,使其温度达到足够使肿瘤细胞发生不可逆转坏死的一种微创热疗技术,该技术有利于肿瘤栓子播散的预防。有研究[3]认为协同效应使得两者联合使用后临床效果更加理想。作者自2010年1月至2014年12月收集采用数字减影血管造影(digital subtraction angiography,DSA)引导下PVP 联合RFA 治疗脊柱转移瘤患者61 例,现回顾性分析这61 例患者的术后疼痛缓解情况及其生存状况,现将总结分析结果报道如下。
1 资料与方法
1.1 临床资料 入组郑州大学第一附属医院和鄢陵县中医院骨科收治的经临床病理学确诊的脊柱转移瘤患者61 例,其中男29 例,女32 例;年龄42 ~76 岁(65.2 ±11.5)岁。原发肿瘤:肺癌27 例,前列腺癌18例,乳腺癌16 例。34 例患者既往接受了姑息性手术治疗,27 例患者既往接受了原发病灶根治性切除术。参考文献[4-6],术前VAS 评分为(6.90 ±0.65)分。脊柱转移瘤预后Tomita 评分为(5.30 ±0.42)分。61 例患者中受累椎体为67 个,其中胸椎38 例、腰椎23 例。患者主要症状为椎体节段受侵所致的疼痛,主要临床表现为行动困难。所有患者术前均进行了正规的放疗和(或)化疗治疗,且本次治疗之前常规进行影像学检查和心电图、实验室检查等,包括明确椎体的病变部位、骨质破坏的严重程度,同时评估骨水泥注入病灶后的可能分布状况。
1.2 方法
1.2.1 术前准备 手术前患者签订手术知情同意书,然后利用影像学检查对患者心脏及肺部功能进行评估,所有患者在术前均行病变部位的CT 及MRI 检查,术前依照患者的病变部位详细制定进针部位,必要时可模拟进针路线。患者术前30 min 给予镇静药物。
1.2.2 手术过程 患者取俯卧位,将与射频发生仪相接的电极片贴在患者下肢皮肤上,手术部位常规消毒,先进行DSA 定位,然后用质量分数2%利多卡因对手术部位进行局部麻醉,在透视下用骨穿刺针进行穿刺,固定穿刺针的外套管,沿外套管经椎弓根插入骨水泥针,插入深度到达椎体的前1/3 处,然后进行退针,再将RFA-I 型多极射频电极沿通道进入相应椎体内,在DSA 引导下打开电极,时刻保持穿刺针在安全范围,防止进入脊髓并对脊髓产生损伤,接着连接打开发生器。我们采用起始功率设置为20 W,使其缓慢升高到150 W,温度一直维持在60 ~90 ℃,作用时间6 ~12 min。维持的温度和作用时间可以依据患者椎体病变的情况来决定,患者病变椎体后缘的骨皮质破坏严重者作用温度可以采用80 ℃,时刻询问患者的疼痛症状,如果疼痛加重或出现别的不适,应立刻终止,以免神经及脊髓受到损伤。RFA-I 型多极射频治疗中,不断确认射频针的位置,以免位置变动损伤神经,当治疗?时间结束后,可以结束射频治疗,将电极针退回工作套管,然后退出。接着通过套管,将骨穿刺针插入,插入深度到达椎体的前1/3 处,拔出针芯,用注射器将调配好的骨水泥在聚甲基丙烯酸甲酯酸甲酯糨糊状时缓慢注入病变椎体。要在DSA 全程透视下进行注射,当骨水泥到达椎体后缘或充填满意后停止注射,术后3 d内应用抗生素预防感染。
1.2.3 观察指标及疗效评定 采用门诊和电话随访方式进行随访。主要随访内容:治疗起效时间以及疼痛改善程度。患者的疼痛程度评估采用VAS 评分法,共分为0 ~Ⅲ级,0 分为0 级,患者无痛;1 ~4 分为I级,患者轻度疼痛,但在可忍受范围内,不影响患者的正常生活,且不需用止痛药;5 ~6 分为Ⅱ级,患者中度疼痛,伴有短时剧痛,正常睡眠受干扰,需要用止痛药;7 ~10 分为Ⅲ级,患者疼痛剧烈,正常睡眠严重受干扰,必须用镇静药才能缓解。
患者的止痛效果的评定:1)显效:治疗后疼痛完全缓解或减轻Ⅱ级以上;2)有效:疼痛明显减轻或减轻I~Ⅱ级;3)无效:疼痛未见缓解或疼痛减轻小于I级,甚至加重,并以显效+有效计算有效率。
影像学检查评估指标[7]包括肿瘤体积变化、T2 信号强度变化以及对比增强模式的变化。
1.3 统计学处理 采用SPSS 16.0 进行数据分析,计量资料用±s 表示,比较采用重复测量数据的方差分析,检验水准α=0.05。
2 结果
61 例患者均顺利完成手术治疗,并获得6 ~12 个月的随访,其中55 例患者在术后当天疼痛均有不同程度缓解,且随访期内无感染病例发生,也未见死亡病例。术后各时间点的VAS 评分和VRS 评价结果与术前比较差异均有统计学意义(P 均<0.05)。7 例患者在末次随访时的MRI 提示肿瘤仍然有进展但未接受进一步治疗。治疗前后MRI 的变化显示:61 例患者椎体高度未见明显变化,其中34 例肿瘤体积无明显变化;20 例肿瘤体积明显减小;7 例有所增大,在T2 信号的变化提示强度变强,该变化提示在治疗后肿瘤仍有进展。治疗后疼痛缓解情况见表1。
3 讨论
目前,PVP 联合RFA 逐渐应用于椎体转移瘤的治疗,该方法是在DSA 引导下先行RFA,杀灭肿瘤细胞,降低椎体内压力,阻断肿瘤的血液供应,然后进行PVP,这种方式有利于骨水泥的注入以及降低PVP 术中骨折的风险。PVP 联合RFA 的优势是:该方案在控制肿瘤,增强脊柱稳定性的同时,减轻了疼痛,改善了患者的生活质量。RFA 在骨科最早应用于骨样骨瘤、骨转移瘤、软骨细胞瘤的治疗,并取得了较好的疗效[8-9]。一项多中心前瞻性研究[10]发现,DSA 引导下的RFA 用于骨转移瘤的治疗,能够有效杀灭肿瘤细胞和减轻患者疼痛,且安全性较高。目前,DSA 引导下的RFA 已经广泛应用于淋巴瘤、脊柱椎体转移瘤、骨质疏松及血管瘤等所致椎体压缩性骨折的治疗[11]。PVP 常用于椎体溶骨性病理性骨折的治疗,但具有一定的并发症发生率,特别是术中骨水泥的渗漏可导致神经根疼痛。为避免骨水泥的渗漏,有研究认为应当联合RFA[12]。
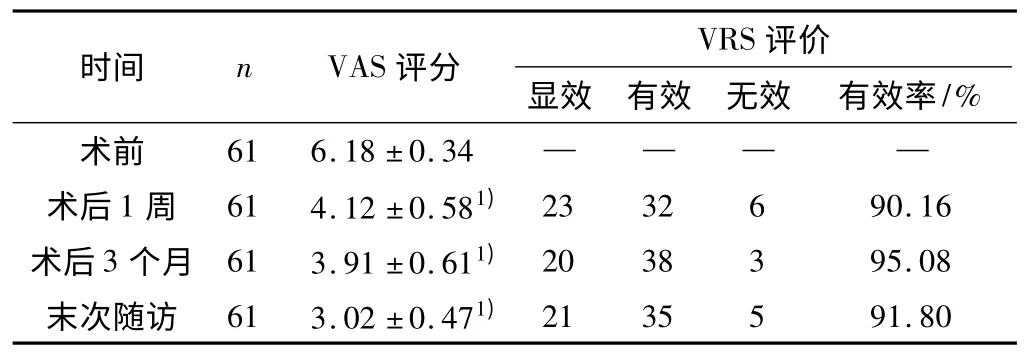
表1 所有患者手术前后VAS 评分及VRS 评价比较
本文结果显示,61 例患者均顺利完成手术治疗,并获得6 ~12 个月的随访,其中55 例患者在术后当天疼痛均有不同程度缓解。术后各时间点的VAS 评分和VRS 评价结果与术前比较差异均有统计学意义。7例患者在末次随访时的MRI 提示肿瘤仍然有进展,但并未进行后续治疗。
总之,DSA 引导下PVP 联合RFA 治疗脊柱转移瘤可获得良好的近期疗效,使患者生活质量得到明显提高,是治疗脊柱转移瘤安全、有效和可行的方法。
[1]Godersky JC,Smoker WR,Knutzon R. Use of magnetic resonance imaging in the evaluation of metastatic spinal disease[J]. Neurosurgery,1987,21(5):676-680.
[2]Jacofsky DJ,Papagelopoulos PJ,Sim FH. Advances and challenges in the surgical treatment of metastatic bone disease[J]. Clin Orthop Relat Res,2003,(415 Suppl):S14-S18.
[3]Masala S,Roselli M,Massari F,et al.Radiofrequency Heat Ablation and Vertebroplasty in the treatment of neoplastic vertebral body fractures[J].Anticancer Res,2004,24(5B):3129-3133.
[4]韩秀鑫,王国文,张超,等.121 例脊柱转移瘤手术治疗的疗效分析[J].中华骨科杂志,2014,34(11):1127-1133.
[5]Tomita K,Kawahara N,Kobayashi T,et al.Surgicals trategy for spinal metastases[J].Spine,2001,26(3):298-306.
[6]陈映霞,秦叔逵,王琳,等. 依班膦酸钠治疗骨转移癌疼痛的随机对照临床研究[J].临床肿瘤学杂志,2002,7(1):50-52.
[7]Hwang YJ,Sohn MJ,Lee BH,et al.Radiosurgery for metastatic spinal tumors:follow-up MR findings[J]. AJNR Am J Neuroradiol,2012,33(2):382-387.
[8]Rimondi E,Mavrogenis AF,Rossi G,et al.Radiofrequency ablation for non-spinal osteoid osteomas in 557 patients[J]. Eur Radiol,2012,22(1):181-188.
[9]贡桔,陆志俊,王忠敏,等.CT 引导下射频治疗转移性骨肿瘤的临床应用[J].介入放射学杂志,2009,18(5):344-347.
[10]Rhim H,Dodd GD 3rd. Radiofrequency thermal ablation of liver tumors[J].J Clin Ultrasound,1999,27(5):221-229.
[11]田庆华,吴春根,顾一峰,等.射频消融术联合经皮骨成形术治疗椎外转移性骨肿瘤的临床应用[J]. 临床放射学杂志,2012,31(12):1777-1781.
[12]Nakatsuka A,Yamakado K,Maeda M,et al. Radiofrequency ablation combined with bone cement injection for the treatment of bone malignancies[J].J Vasc Interv Radiol,2004,15(7):707-712.

