曲妥珠单抗联合放疗同步应用于乳腺癌的术后辅助治疗
周红林,姜祖光,岳文彬,李伟芳,陈 曦
(濮阳市油田总医院肿瘤科,河南 濮阳457000)
曲妥珠单抗是一种特异性针对人表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER-2)胞外区的人源化单克隆抗体[1]。曲妥珠单抗靶向治疗可显著提高HER-2 阳性乳腺癌患者的总生存及无瘤生存[2]。放疗是乳腺癌综合治疗的重要手段,术后放疗使乳腺癌的15 a 死亡率降低5%[3],但心脏事件死亡风险随之增加,许多乳腺癌术后患者需要靶向治疗及放疗,而靶向治疗与放疗的最佳应用时序却没有共识。为缩短患者的辅助治疗时间和增加疗效,我们设计了曲妥珠单抗联合放疗治疗乳腺癌的临床对照研究。
1 资料与方法
1.1 一般资料 入组2010年8月至2013年6月在濮阳市油田总医院进行治疗的76 例女性乳腺癌患者,其中试验组40 例,年龄(47.4 ±8.5)岁;对照组36 例,年龄(48.8 ±9.2)岁。见表1。
1.2 研究方法 试验组40 例采用曲妥珠单抗同步放疗治疗,对照组采用放疗和曲妥珠单抗序贯治疗。化疗方案的选择依据NCCN 乳腺癌诊疗指南,曲妥珠单抗(商品名:赫赛汀)治疗采用3 周方案,首次剂量为8 mg·kg-1,此后6 mg·kg-1治疗1 a。试验组患者的曲妥珠单抗与放疗为同时开始;对照组患者的曲妥珠单抗首次治疗在放疗结束后开始。常规放疗患侧胸壁、锁骨上、腋顶野,采用6 MV X 线进行照射,总剂量50 Gy/25 次/5 周。
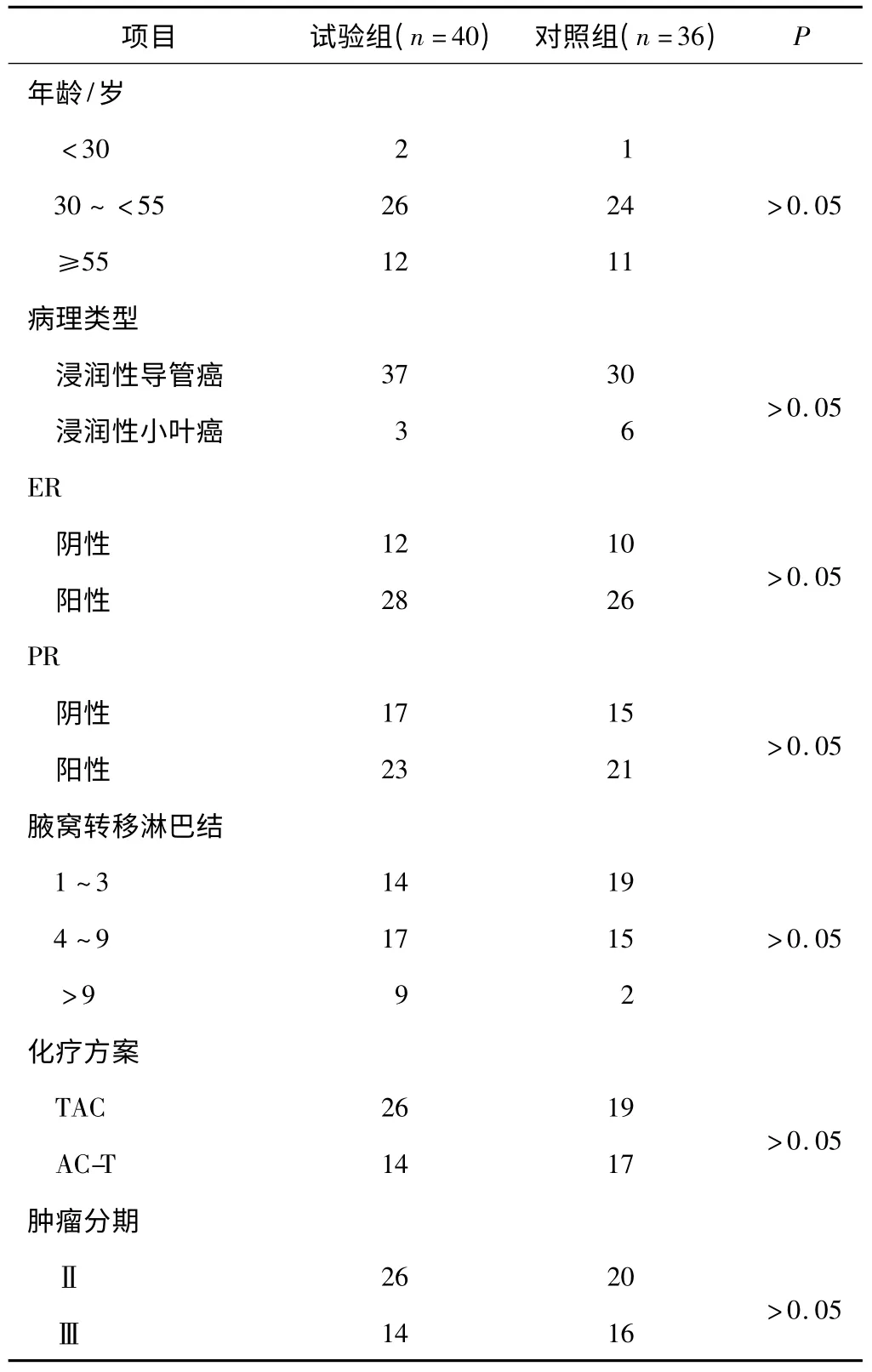
表1 2 组患者的一般资料比较
研究的主要终点为心脏安全性,次要终点为无病生存时间和总生存时间。患者在入组前及曲妥珠单抗使用后1、3、6、9、12 个月,分别进行超声心动图监测心脏左室射血分数(left ventricular ejection fraction,LVEF)。无病生存时间定义为出现局部或者区域复发、远处转移、对侧乳腺癌或死亡的时间。总生存时间定义为出现任何原因引起的死亡及乳腺癌特异性死亡的时间。根据NCI-CTC 标准,将不良事件分为0 ~Ⅳ度。
1.3 统计学处理 采用SPSS 15.0 进行统计学分析,计量资料用±s 表示,比较采用t 检验,计数资料的比较采用χ2检验或Fisher 精确概率法,采用Kaplan-Meier 法进行生存分析,检验水准α=0.05。
2 结果
2.1 安全性 2 组患者的心脏安全性良好,共出现心脏不良事件7 例(9.2%),其中试验组5 例(12.5%),对照组2 例(5.56%),差异无统计学意义(P >0.05)。根据NCI-CTC 标准,7 例心脏不良事件均为I度,即表现为无症状的LVEF 较基线下降≥10% ~<20%,且LVEF 数值不低于正常下限(50%)。所有LVEF 下降都表现为可逆性,没有出现有症状的心功能衰竭或心源性死亡事件,没有患者因为心脏不良事件出现暂时或永久停用曲妥珠单抗。试验组和对照组患者在入组前和治疗后1、3、6、9、12 个月的LVEF 变化比较差异均无统计学意义(P 均>0.05)。见表2。
2.2 疗效 76 例患者中,9 例(11.8%)出现复发转移,其 中 试 验 组4 例(10. 00%),对 照 组5 例(13.89%),比较差异无统计学意义(P >0.05)。试验组的复发转移患者分别为胸壁复发2 例,锁骨上淋巴结转移1 例,肺转移l 例;对照组的复发转移患者分别为肝转移2 例,锁骨上淋巴结转移2 例,肺转移1 例。随访过程中,试验组和对照组均未出现死亡病例。2组患者的无病生存时间比较差异无统计学意义(P >0.05)。见图1。
3 讨论
在曲妥珠单抗辅助治疗的试验中,接受含曲妥珠单抗治疗方案的患者中Ⅲ、Ⅳ度充血性心力衰竭或心脏相关死亡的发生率从总体上看在0.0% ~4.1%,发生心功能不全的风险可能与年龄和LVEF 基线水平相关,即便如此,仍有4.3% ~17.3%的患者因此中断治疗[4]。在临床工作中,为避免出现更为严重的不良事件,或是对曲妥珠单抗联合放疗风险的不确定,大多数医生选择在进行完整的放疗之后进行靶向治疗,而放疗时间长达5 周,如果两者可以同步使用,将至少缩短5 周以上的辅助治疗时间。基础研究[5]表明曲妥珠单抗对HER-2 阳性乳腺癌细胞具有放射增敏作用,并得到临床试验研究[6]初步证实。因此,如果曲妥珠单抗同步放疗的不良事件可以接受,这将很大程度上优化乳腺癌术后辅助治疗的方案。
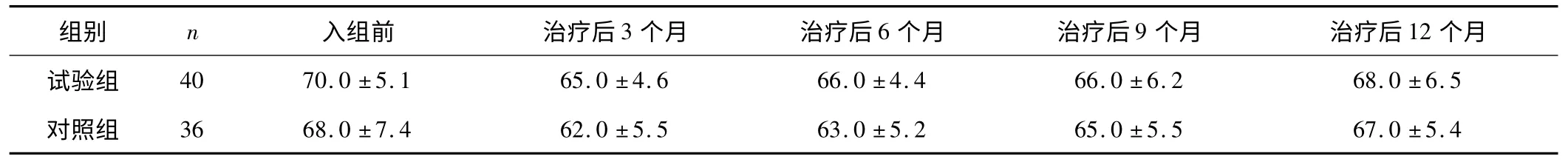
表2 2 组乳腺癌患者在入组前和治疗后的LVEF 变化 %
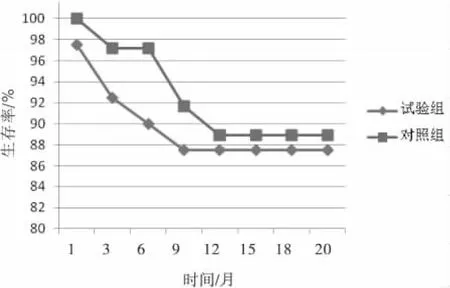
图1 2 组无病生存曲线图
在乳腺癌术后曲妥珠单抗辅助治疗的心脏不良事件研究方面,沈松杰等[7]做过更为大胆的对照研究,他们将曲妥珠单抗联合蒽环类药物同步应用于乳腺癌的辅助治疗,结果显示并不增加患者心脏不良事件的风险。疗效评价方面,76 例患者中,9 例(11.8%)出现复发转移,其中试验组4 例(10.00%),对照组5 例(13.89%),比较差异无统计学意义(P >0.05)。2 组患者的无病生存时间比较差异无统计学意义(P >0.05)。提示,在乳腺癌辅助治疗中,曲妥珠单抗与放疗同步治疗并不增加患者心脏不良事件的风险。
然而从对一些试验中的患者进行心功能随访的结果来看,对曲妥珠单抗治疗相关的长期心脏不良事件的担忧与日俱增[8]。由于放射相关性心脏病从起始到出现临床症状需要3 ~20 a 的时间[9],本研究的随访时间仅1 a,因此对心脏安全性问题还远远没到下结论的时候;另外,现代精确放疗技术的应用使心脏剂量,尤其是局部高剂量降低,因而放射相关性心脏病的潜伏期可能更长。
[1]Burstein HJ.The distinctive nature of HER2-positive breast cancers[J].N Engl J Med,2005,353(16):1652-1654.
[2]Dahabreh IJ,Linardou H,Siannis F,et al.Trastuzumab in the adjuvant treatment of early-stage breast cancer:a systematic review and meta-analysis of randomized controlled trials[J].Oncologist,2008,13(6):620-630.
[3]Clarke M,Collins R,Darby S,et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials[J].Lancet,2005,366(9503):2087-2106.
[4]Di Cosimo S.Heart to heart with trastuzumab:a review on cardiac toxicity[J].Target Oncol,2011,6(4):189-195.
[5]Liang K,Lu Y,Jin W,et al. Sensitization of breast cancer cells to radiation by trastuzumab[J]. Mol Cancer Ther,2003,2(11):1113-1120.
[6]Horton JK,Halle J,Ferraro M,et al. Radiosensitization of chemotherapy-refractory,locally advanced or locally recurrent breast cancer with trastuzumab:a phase II trial[J].Int J Radiat Oncol Biol Phys,2010,76(4):998-1004.
[7]沈松杰,徐颖,孙强,等. 曲妥珠单抗联合蒽环类药物同步应用于乳腺癌的辅助治疗[J]. 中华肿瘤杂志,2014,36(2):132-135.
[8]Vaz-Luis I,Keating NL,Lin NU,et al.Duration and toxicity of adjuvant trastuzumab in older patients with early-stage breast cancer:a population-based study[J]. J Clin Oncol,2014,32 (9):927-934.
[9]Adams MJ,Hardenbergh PH,Constine LS,et al.Radiation-associated cardiovascular disease[J]. Crit Rev Oncol Hematol,2003,45(1):55-75.

