过敏毒素C3a在肾小球足细胞中的分泌性表达试验
郑敬民,尹 广,赵文紧
作为先天性免疫的一个重要组成部分,补体系统在机体免疫防御中起着极为重要的作用[1-3]。但补体系统的不适当激活也会导致组织的损伤,成为引发人类疾病发生和发展的重要因素[4-7]。在肾脏,补体活化与包括糖尿病肾病在内的多种病变相关[8-11],但有关补体系统参与糖尿病肾病等肾组织损伤的机制仍未明了。长期以来,人们对补体系统功能了解更多的是基于膜攻击复合物对病菌和病变细胞裂解的效应,在各种途径的补体活化过程中,还产生了一系列被称作过敏毒素的补体成分小片段(包括 C3a、C4a和 C5a,分别由 C3、C4 和 C5裂解产生),它们也可能参与糖尿病肾病等肾组织损伤过程。有研究显示[12-13],包括肾小管上皮细胞、肾小球足细胞和壁层上皮细胞在内的肾组织上皮细胞均有表达过敏毒素C3a的受体C3aR,且在糖尿病肾病等特定病理条件下肾组织上皮细胞中C3aR的表达水平亦明显增加,提示过敏毒素C3a可通过其受体参与糖尿病肾病等肾脏疾病的肾组织损伤过程,然而各种过敏毒素在肾组织损伤中的确切病理作用和意义仍不是很清楚。为了探讨过敏毒素C3a在肾小球足细胞中的可能作用和病理意义,本文设计和建立了过敏毒素C3a分泌性表达慢病毒体系,并将其导入人肾小球足细胞系中,建立了分泌性高表达过敏毒素C3a的人肾小球足细胞株,为深入探讨C3a对肾小球足细胞的作用及机制提供了很好的细胞模型。
1 材料与方法
1.1 细胞和试剂来源 人足细胞系(human podocytes,HPC)从美国 ATCC购得;胰岛素-转铁蛋白-硒试剂、胎牛血清和1640培养基从Gibco公司购得;杀稻瘟菌素、凝聚胺(Polybrene)和TRIZOL为 invitrogen公司产品;“PrimeScript RT Master Mix”逆转录试剂盒和“SYBR Premix Ex Taq II”荧光定量PCR试剂盒为Tarkara产品;293 T细胞、慢病毒空载体和包装质粒均由Invitrogen公司提供;人C3a ELISA试剂盒购自BD公司。
1.2 稳定转染分泌性高表达过敏毒素C3a细胞株的构建方法
1.2.1 HPC的培养 HPC采用1640培养基培养,其中含1%ITS和10%胎牛血清,HPC细胞的培养温度为33℃(于含CO25%的孵箱中)。
1.2.2 基因转染和稳定转染细胞筛选 将HPC细胞以2×105/mL接种到24孔细胞培养板中(每孔接种0.5 mL);33℃培养24 h后,按感染复数(multiplicity of infection,MOI)等于10的比例吸取适量过敏毒素C3a表达重组慢病毒,以培养液稀释病毒液(最后稀释致 100 μL/孔的量),同时加入 8 μg/mL(终浓度)的Polybrene,吹打混匀后将其加入至吸去培养液的24孔板细胞上;继续培养6 h后,吸去含病毒的培养液,换上新鲜的培养液继续培养;48 h后于荧光显微镜下观察细胞是否发出绿色荧光(成功转染的细胞可发出绿色荧光,据此判断细胞转染是否成功);消化细胞,将转染细胞转移到6孔板中,加入杀稻瘟菌素(终浓度为10 g/mL)进行药物筛选,每3 d换一次培养液,2周后,即得到稳定转染慢病毒的足细胞。
1.2.3 建立单克隆细胞株 通过连续梯度稀释培养构建单克隆细胞株。即先利用细胞计数板对欲建立单细胞克隆的细胞悬液进行计数,再利用培养液对细胞悬液进行梯度稀释,稀释至每毫升培养液约含5个细胞时,将稀释液以每孔50 μL、100 μL的量接种到96孔板中。置33℃孵箱培养14 d后,相差显微镜下观察找出单克隆细胞团,经扩大培养,获得单克隆细胞株。
1.3 C3a分泌水平分析 以2×105个细胞/孔分别将稳定转染过敏毒素C3a的单克隆细胞株和未转染的对照足细胞株接种于24孔板(每种细胞各3孔),待细胞贴壁(约6 h)后,将培养液换成无血清的培养液,继续培养2 d后,吸取细胞培养上清,10 000×g离心5 min后,取上清利用人C3a ELISA试剂盒分析培养上清中C3a水平。
1.4 C3a mRNA表达水平的分析 采用实时定量PCR的方法进行,具体如下:利用TRIZOL试剂提取细胞RNA;利用“PrimeScript RT Master Mix”试剂盒合成cDNA;采用“SYBR Premix Ex Taq II”试剂盒于ABI公司的7900型实时定量PCR仪进行PCR扩增和检测。检测过程以18S RNA作为内参。PCR过程为:95℃下预变性1 min,然后进行DNA变温扩增过程(95℃ 15 s,60℃ 30s,如此40个循环)。所用引物由金唯智公司合成,其序列为:人18S RNA sense:5’-ttt ctc gat tcc gtg ggt gg-3’;人18S RNA antisense:5’-agc atg cca gag tct cgt tc-3’;人 C3a sense:5’-aag tcg gca agt acc cca ag-3’;人 C3a antisense:5’-agt tgc agc agt cca gga ag-3’。
1.5 统计学处理 采用SPSS 19.0软件进行。定量数据表示为均数±标准差(±s),组间两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 过敏毒素C3a分泌型慢病毒表达体系的构建结果 通过先构建过敏毒素C3a分泌型表达慢病毒载体、再在293 T细胞中包装成重组慢病毒,最后得到滴度约为5×108/mL的过敏毒素C3a分泌型表达重组慢病毒溶液。图1所示的是本文设计的过敏毒素C3a分泌型表达慢病毒载体结构示意图[重组C3a基因由5’端的IL-6基因的信号肽序列和下游C3a编码序列组成,整个基因的表达由CMV启动子控制;此外,载体上有一绿色荧光蛋白基因(EGFP)和杀稻瘟菌素分解酶基因(Blasticidin)];图2所示的是其部分测序结果,显示所构建载体的序列完全正确。
2.2 过敏毒素C3a分泌性表达转基因细胞细胞株的构建结果 以过敏毒素C3a分泌性表达重组慢病毒转染HPC细胞48 h后,荧光显微镜下可见几乎所有细胞均可发出很强的绿色荧光,说明病毒转染效率很高,转染很成功。经过14 d的培养液中加杀稻瘟菌素筛选,获得了稳定转染过敏毒素C3a分泌性表达重组慢病毒的细胞群,其中的每个细胞均可发出明亮的绿色荧光(图3,其中d是c同一视野下的相差显微镜照片)。再通过连续梯度稀释法筛选,构建成了稳定转染过敏毒素C3a的重组细胞克隆(图3中e,可见所有细胞发出了均匀的绿色荧光),经扩大培养得到了稳定转染过敏素素C3a重组慢病毒的细胞株HPC-C3a。
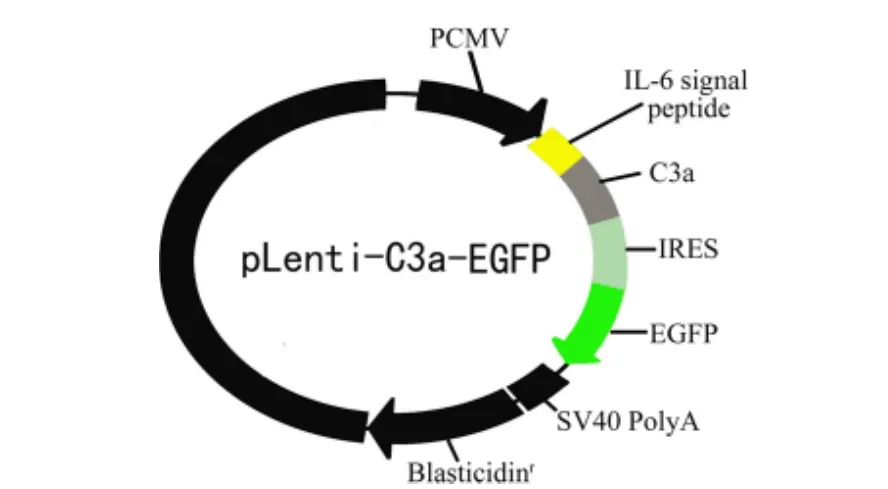
图1 过敏毒素C3a分泌性表达慢病毒载体结构示意图

图2 过敏毒素C3a分泌性表达慢病毒载体的部分测序结果(示过敏毒素C3a基因3’端插入点周围的测序结果)

图3 稳定转染过敏毒素C3a的细胞株(HPC-C3a细胞株)的构建结果
2.3 HPC-C3a细胞株中C3a表达和分泌水平分析结果 PCR分析显示:与作为对照的正常(非转染)HPC细胞相比,HPC-C3a细胞株中C3a mRNA表达水平显著升高[正常对照C3a mRNA相对水平为(1.0 ±0.6),HPC-C3a细胞株 C3a mRNA 相对水平为(771.0±172.0)]。对细胞培养上清中过敏毒素C3a水平的检测显示:与作为对照的未转染HPC细胞相比,HPC-C3a细胞培养液上清中的C3a水平增加了 600 多倍[(201.0 ±21.0)ng/mL vs(0.3 ±0.1)ng/mL]。
3 讨论
近年来,有关补体系统的不当激活在人类疾病中的作用引起了越来越多研究者的关注,成为了人类疾病机制研究的一个新热点[1-4]。虽然人们早就认识到包括糖尿病肾病、膜性肾病和狼疮性肾炎在内的多种肾脏疾病患者肾组织中均存在补体过度活化现象,但对于补体系统在肾组织损伤中的确切作用和参与肾组织损伤的确切分子机制的认识却仍然很有限。
理论上,补体的过度活化可以多种方法参与肾脏疾病的发生发展过程。其中膜攻击复合物长期以来一直为人们所关注。但在补体的链式激活过程中,同时产生了包括过敏毒素C3a在内的一系列小片段分子,它们被释放到周围微环境中,参与了对机体细胞功能的各种调节。作为一种重要的炎症因子,过敏毒素C3a可通过与其受体C3aR的相互作用趋化和激活白细胞[14-17]。近年的研究显示[11],除了广泛表达于各种免疫细胞外,过敏毒素C3a的受体C3aR还表达于包括脑、肝、肺、肾脏在内的多种器官中的组织细胞中,且在不同的生理和病理情景中显示出了多种重要功能。在肾脏,C3aR主要表达于上皮细胞(包括肾小管上皮细胞、肾小球足细胞和壁层上皮细胞)[12-13],但目前对于肾组织细胞中C3aR的生理功能和各种病理情景下的病理意义仍不清楚。考虑到多种肾病患者肾组织中存在的补体过度活化现象(即有大量的过敏素素C3a会被释放出来并可能激活其肾组织细胞中的受体C3aR)、C3a信号传导在一些组织细胞中所表现出来的包括影响细胞发育分化、细胞增殖或凋亡等在内的重要功能[18-22]以及肾小球足细胞损伤在糖尿病肾病等肾脏疾病中的重要性,我们推测:在糖尿病肾病等病理情况下,肾组织补体过度活化产生的过敏素素C3a很可能通过激活其位于足细胞上的受体参与足细胞损伤过程,从而在疾病的发生发展中发挥作用。为了探讨过敏毒素C3a在肾小球足细胞损伤中的可能病理作用和分子机制,本文进行了分泌性过表达过敏毒素C3a人肾小球足细胞株的构建。我们首先设计合成了过敏毒素C3a分泌性表达单元,并成功地将其克隆到了慢病毒表达载体上,经全序列测序验证,得到序列完全正确的过敏毒素C3a分泌性慢病毒表达载体。在此基础上,笔者利用293 T细胞进行了重组慢病毒的包装,并得到了高滴度的过敏毒素C3a分泌性表达重组慢病毒。利用过敏毒素C3a分泌性表达重组慢病毒转染HPC细胞48 h后,笔者在荧光显微镜下观察到了大量的能发出绿色荧光的转染细胞。这些发出绿色荧光的转染细胞可分为两类:基因组中插入重组慢病毒DNA的细胞和基因组中未插入重组慢病毒DNA的细胞(重组DNA在细胞基因组外游离存在)。其中,只有基因组中插入重组慢病毒DNA的细胞可长期稳定地传递和表达转基因(包括过敏毒素C3a基因、绿色荧光蛋白基因和杀稻瘟菌素分解酶基因),故称为稳定转染细胞。而重组DNA游离在细胞基因组外的转染细胞却不能将转基因(包括过敏毒素C3a基因、绿色荧光蛋白和杀稻瘟菌素分解酶基因)稳定地传递到下一代细胞,其转基因的表达具有瞬时性,故称为瞬时转染细胞。根据这一原理,本文利用在培养液中长期加杀稻瘟菌素的办法来除去瞬时转染细胞和未转染细胞,得到了稳定转染细胞群。在此基础上,本文又利用连续梯度稀释克隆法进行了细胞的克隆化筛选培养,最终得到了稳定转染了过敏毒素C3a分泌性表达重组慢病毒的足细胞株HPCC3a。利用PCR和ELISA方法,本文对HPC-C3a细胞株过敏毒素C3a的表达和分泌情况进行了分析,结果证实了过敏毒素C3a在HPC-C3a细胞株中的分泌性高水平表达,说明成功构建了分泌性过表达过敏毒素C3a的人肾小球足细胞株。上述工作不仅为进一步研究各种病理情况下过敏毒素C3a在人肾小球足细胞损伤中的作用和意义,探讨补体活化产生的过敏毒素C3a致肾小球足细胞损伤的分子机制提供了很好的细胞模型,所建立的过敏毒素C3a分泌性表达慢病毒体系也为进一步开展C3a对其他细胞的作用和病理意义创造了条件。
[1] Lappegard KT,Garred P,Jonasson L,et al.A vital role for complement in heart disease[J].Mol Immunol,2014,61(2):126-134.
[2] Schramm EC,Clark SJ,Triebwasser MP,et al.Genetic variants in the complement system predisposing to age-related macular degeneration:a review[J].Mol Immunol,2014,61(2):118-125.
[3] Peterson SL,Anderson AJ.Complement and spinal cord injury:traditional and non-traditional aspects of complement cascade function in the injured spinal cord microenvironment[J].Exp Neurol,2014,258:35-47.
[4] Hertle E,Stehouwer CD,van Greevenbroek MM.The complement system in human cardiometabolic disease[J].Mol Immunol,2014,61(2):135-148.
[5] 甘燕玲,杨至宜,孙朝晖,等.快速CRP检测对儿童上呼吸道感染的鉴别诊断价值[J].华南国防医学杂志,2011,25(3):264-265.
[6] 陈金弟,王智华,李华良,等.抗脑抗体对精神分裂症自身免疫反应的探讨[J].东南国防医药,2004,6(3):171-172.
[7] 任红旗,吴梅月,蔡 青,等.肾淀粉样变性10例临床病理分析[J].东南国防医药,2011,13(4):348-349.
[8] Fearn A,Sheerin NS.Complement activation in progressive renal disease[J].World J Nephrol,2015,4(1):31-40.
[9] Thurman JM1.Complement in kidney disease:core curriculum 2015[J].Am J Kidney Dis,2015,65(1):156-168.
[10]郑敬民,尹 广,姚根宏,等.肾病患者肾组织补体活化与肥大细胞滑润的关系研究[J].医学研究生学报,2012,25(10):1040-1044.
[11] Klos A,Wende E,Wareham KJ,et al.International Union of Basic and Clinical Pharmacology[corrected].LXXXVII.Complement peptide C5a,C4a,and C3a receptors[J].Pharmacol Rev,2013,65(1):500-543.
[12] Braun MC,Reins RY,Li TB,et al.Renal expression of the C3a receptor and functional responses of primary human proximal tubular epithelial cells[J].J Immunol,2004,173(6):4190-4196.
[13]郑敬民,朱小东,张明超,等.过敏毒素受体(C3aR)在db/db糖尿病肾病小鼠肾脏中的表达及病理意义分析[J].生物化学与生物物理进展,2010,37(8):847-845.
[14] Mueller-Ortiz SL,Morales JE,Wetsel RA.The receptor for the complement C3a anaphylatoxin(C3aR)provides host protection against listeria monocytogenes-induced apoptosis[J].J Immunol,2014,193(3):1278-1289.
[15] Niebuhr M,Bumer W,Kietzmann M,et al.Participation of complement 3a receptor(C3aR)in the sensitization phase of Th2 mediated allergic contact dermatitis[J].Exp Dermatol,2012,21(1):52-56.
[16] Bao L,Wang Y,Haas M,et al.Distinct roles for C3a and C5a in complement-induced tubulointerstitial injury[J].Kidney Int,2011,80(5):524-534.
[17] Zhou W.The new face of anaphylatoxins in immune regulation[J].Immunobiology,2012,217(2):225-234.
[18] Carmona-Fontaine C,Theveneau E,Tzekou A,et al.Complement fragment C3a controls mutual cell attraction during collective cell migration[J].Dev Cell,2011,21(6):1026-1037.
[19] Yu M,Zou W,Peachey NS,et al.A novel role of complement in retinal degeneration[J].Invest Ophthalmol Vis Sci,2012,53(12):7684-7692.
[20] Tu Z,Bu H,Dennis JE,et al.Efficient osteoclast differentiation requires local complement activation[J].Blood,2010,116(22):4456-4463.
[21] Lim J,Iyer A,Suen JY,et al.C5aR and C3aR antagonists each inhibit diet-induced obesity,metabolic dysfunction,and adipocyte and macrophage signaling[J].FASEB J,2013,27(2):822-831.
[22] Xu XH,Peng HS,Sun MQ,et al.C-terminal peptide of anaphylatoxin C3a enhances hepatic function after steatotic liver transplantation:a study in a rat model[J].Transplant Proc,2010,42(3):737-740.

