地塞米松预处理减轻异丙肾上腺素所致心肌损伤及TNF-α的表达
张严高,余 磊,王建莉,尹戴佳佳,朱闽湘,祝春华,范 洁
Debonera等[1]发现糖皮质激素对肝脏缺血-再灌注具有保护作用,首次证实地塞米松(Dexamethasone,DEX)可以通过炎症信号通路削弱实质性脏器缺血-再灌注损伤。已有研究证实削弱炎症反应可减轻急性心肌缺血损伤,DEX等药物的预处理在心脏缺血-再灌注损伤、肾脏缺血-再灌注损伤等能有诱导保护作用[2-3]。本研究观察DEX预处理或治疗对异丙肾上腺素(isoprotereno,ISO)致小鼠急性心肌缺血损伤影响,并探索相关作用机制。
1 材料与方法
1.1 实验动物、主要试剂及仪器 昆明种小鼠16只,雄性,体质量20~22g,浙江大学实验动物中心提供[实验动物合格证号2007000580817,许可证号SCXK(沪)2012-0002]。盐酸异丙肾上腺素注射液(1 mg/2 mL,上海禾丰制药有限公司,产品批号131003),地塞米松磷酸钠注射液(5 mg/1 mL,湖北天药药业股份有限公司,产品批号1408231);7180型全自动生化分析仪(日本日立公司),谷草转氨酶(AST)试剂盒(北京执诚公司,产品批号ZCAPRN012)、乳酸脱氢酶(LDH)试剂盒(产品批号3102511)、肌酸激酶(CK)试剂盒(产品批号403281A)、肌酸激酶同功酶(CK-MB)试剂盒(产品批号404213D,以上均为北京利德曼公司产品);肿瘤坏死因子-α(TNF-α)ELISA试剂盒(美国 Ebioscience公司,货号BMS607HS)。
1.2 动物模型分组与制备 采用腹腔注射ISO建立小鼠急性心肌缺血模型。将16只小鼠随机分为正常对照(control,CON)、异丙肾上腺素损伤(ISO)组、地塞米松预处理(Dexamethasone pretreatment,DEX-pre)组、地塞米松治疗(DEX)组,每组4只。CON组、ISO组首次处理前30 min给予等量0.9%氯化钠注射液腹腔注射预处理,然后CON组给予等量0.9%氯化钠注射液腹腔注射处理,ISO组小鼠给予ISO(5 mg/kg ISO)腹腔注射,1次/d,连续3 d;DEX-pre组在首次 ISO注射前30 min给予 DEX(1.25 mg/kg)腹腔注射,余同ISO组;DEX组在第2天、第 3天 ISO注射 30 min后给予 DEX(1.25 mg/kg)腹腔注射,余同ISO组。第4天各组小鼠用10 g/L戊巴比妥钠(50 g/kg)麻醉,在超净台中进行心脏取血后取全心室。
1.3 血清 AST、LDH、CK、CK-MB含量检测 各组小鼠取血离心分离血清,转置于-20℃低温冰箱保存待测,采用生化自动分析仪进行ASL、LDH、CK及CK-MP值检测,ELISA法检测血清TNF-α含量。
1.4 心脏组织HE染色 取小鼠心脏后用甲醛固定,石蜡包埋,行心肌间断连续切片,切片厚约5 μm,常规HE染色,光镜下观察各组动物心肌病理改变。形态学计分标准参照文献[4]方法进行。0级:心肌细胞排列紧密,横纹清晰,心肌纤维染色均匀,核居中,间质未见血管扩张及炎细胞浸润,组织间隙无水肿,无出血坏死,心外膜、心内膜无异常计0分;Ⅰ级:心肌细胞排列稀疏,间质血管扩张及少量炎细胞浸润,肌浆分布不匀,心肌间质水肿,无出血,可见心肌散在的点状坏死,主要为凝固性坏死灶,局限在心内膜下,计2分;Ⅱ级:部分心肌坏死灶呈片状分布,灶间无连接,病变累及心壁全层,间质可见血管扩张及炎细胞浸润,有灶性出血,心肌间质有炎性出血及心肌间质水肿,计4分;Ⅲ级:心肌广泛性大片坏死,灶间相互连接累及心壁全层,有明显的间质血管扩张、水肿、出血及炎细胞浸润,计6分。
1.5 统计学处理 用SPSS 16.0软件进行数据分析。所有实验数据采用均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 血清 ASL、LDH、CK、CK-MP含量检测 与CON组比较,ISO组ASL、LDH、CK均明显升高(P<0.01),CK-MP无明显改变(P>0.05);与ISO组比较,DEX-pre组ASL、CK下降非常显著(P<0.01),LDH、CK-MP轻度下降(P<0.05);与ISO组比较,DEX组ASL、LDH、CK、CK-MP均无明显改变(P>0.05,表1)。
2.2 心肌组织的病理学改变 光镜下观察各组动物心肌病理显示,CON组心肌细胞排列整齐、致密,胞质着色均匀,胞核清晰,间质细胞无增生,未见炎性渗出、无水肿(图1①)。ISO组心肌细胞体积增大呈圆形或类圆形,排列紊乱,细胞核固缩深染,血管和心肌细胞之间可见纤维增多、炎性细胞浸润、少许淋巴细胞浸润,少量红细胞外渗,多处见局灶性坏死,肌溶解、核消失或不着色(图1②)。DEX-pre组心肌损害较ISO组明显减轻,可见残存正常肌纤维明显增多,核圆形、有核仁,胞浆深红色,局灶性坏死明显减少散在的点状,肌纤维排列紊乱改善,血管和心肌细胞之间未见纤维增多、炎性细胞浸润、淋巴细胞浸润(图1③)。DEX组肌纤维间充血水肿明显,可见残存少许正常肌纤维;多处见肌溶解、核消失或不着色的局灶性坏死,炎性细胞浸润不明显(图1④)。与CON组比较,ISO组心肌损伤明显加重,形态学计分为4.0比0.0(P<0.01);与ISO组比较,DEX-pre组心肌损伤得到明显改善,形态学计分为2.0比4.0(P<0.01),DEX 组心肌损伤无明显变化,形态学计分为 3.5 比4.0。
表1 各组ASL、LDH、CK、CK-MP水平(±s)

表1 各组ASL、LDH、CK、CK-MP水平(±s)
注:与 CON 组比较,**P<0.01;与 ISO组比较,▲P<0.05,▲▲P <0.01
组别 n ASL(U/L) LDH(U/L) CK(U/L) CK-MP(U/L)CON组4 4 156 ±9.8 436 ±18.9 671 ±30.2 214 ±18.2 83 ±5.2 309 ±12.6 452 ±22.4 195 ±16.2 ISO 组 4 170 ±12.8** 451±21.6** 692±28.6** 215±18.2 DEX-pre组 4 87±6.1▲▲ 385±14.3▲ 329±24.3▲▲ 187±13.6▲DEX组
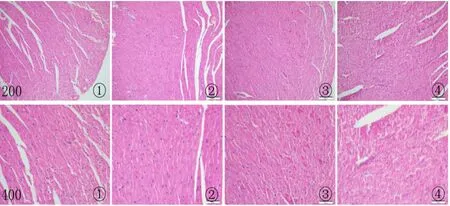
图1 光镜下各组心肌组织形态结构(HE染色 上×200,下×400)
2.3 血清TNF-α含量检测 ISO组TNF-α明显升高[ISO 组、CON 组分别为(2.346±0.423)pg/mL、1.578 ±0.205)pg/mL,P <0.05)];DEX-pre组与ISO组比较,TNF-α下降非常显著[分别为(0.415±0.089)pg/mL、(2.346 ± 0.423)pg/mL,P < 0.01];DEX组与ISO组比较,TNF-α升高非常显著[分别为(18.728 ±2.803)pg/mL、(2.346 ±0.423)pg/mL,P<0.01];DEX-pre组TNF-α明显低于CON组[分别为(0.415 ± 0.089)pg/mL、(1.578 ± 0.205)pg/mL,P <0.01]。
3 讨论
采用皮下注射或腹腔注射ISO可导致心肌细胞缺血缺氧损伤,是常用的动物实验性急性心肌缺血模型。目前认为ISO诱导的心肌损伤与心肌相对缺血缺氧、膜通透性改变、氧自由基损伤等有关[5]。连续注射ISO使心肌中氧化应激剧增导致氧自由基聚集,细胞膜通透性增高,肌浆内的可溶性酶大量释放进入血液中,导致血清心肌酶(ASL、LDH、CPK)的水平显著升高。AST、CK、LDH的活力及心肌病理学改变是评价心肌细胞损害程度的重要指标[6]。本研究中ISO造成心肌细胞损伤后ASL、LDH、CK的水平显著升高,心肌局灶性坏死明显,与以往研究相符[4,6],说明本文小鼠心肌缺血模型造模成功。TNF-α是重要的前炎性细胞因子和免疫调节因子,在介导炎症反应中有重要的作用。临床研究提示,冠心病患者血清TNF-α水平明显高于正常人,并随病情的加重而升高,TNF-α在急性心梗发病早期即可明显升高,检测TNF-α对急性心梗发病早期诊断具有重要意义[7-9],TNF-α水平的升高亦与心肌功能抑制有明显的相关性[10]。本研究证实ISO造成心肌细损伤后TNF-α明显升高(P<0.05),TNF-α与急性心肌缺氧损伤有一定相关性。
TNF-α可通过肿瘤坏死因子受体参与信号传递和T细胞增殖,而肿瘤坏死因子受体对TNF也具有动态调节作用[11];核转录因子-kB抑制剂可通过干扰TNF-α的基因转录而导致其分泌的蛋白量降低,发挥有益效应[12],以往研究证实 DEX预处理可减轻缺血再灌注后心肌损伤并起保护作用[13-14]。糖皮质激素通过调节细胞生长、发育、自身稳定和细胞凋亡来维持机体组织细胞的平衡及其功能,而且糖皮质激素具有抗炎等作用。本研究以糖皮质激素受体(glucocorticoid receptor,GR)激动药DEX通过干扰TNF-α合成,对急性心肌缺氧损伤产生保护作用。研究结果显示经DEX预处理,ISO导致的ASL和CK升高得到明显抑制(P<0.01),ISO导致的TNF-α升高亦得到明显抑制(P<0.01),心肌损害明显减轻,表明DEX预处理对小鼠心肌缺血缺氧有一定的保护作用,与以往DEX对小鼠心肌缺血-再灌注损伤、肾缺血-再灌注损伤、脑出血大鼠脑水肿引起 TNF-α 水平的改变的报道相符[3,15]。而 ISO 导致小鼠心肌损伤后给予DEX治疗却没有相似的保护作用,在ISO导致损伤后给予DEX治疗后TNF-α反而明显升高(P<0.01)。因此,本文认为DEX预处理对ISO所致小鼠心肌缺血具一定的保护作用,其中TNF-α水平的改变发挥重要的作用,但以DEX治疗并无明显得益。可能DEX预处理可显著减少炎症因子TNF-α的表达,使ISO导致心肌炎性损伤控制在一定的水平,从而减轻心肌缺血损伤;DEX预处理还可通过发挥抗凋亡等多途径作用,而减轻心肌缺血损伤,而以DEX治疗使TNF-α明显升高可能抵消DEX预处理诱导的其他有益作用。在ISO所致急性心肌细胞缺血缺氧损伤中,DEX预处理诱导产生的早期保护作用和延迟保护作用,尤其后者保护时间长更具潜在的实用价值,使机体较长时间处于一种保护状态。这种保护作用,可能在不稳定性冠心病,尤其是急性心肌梗死超早期产生的类似效应,具有一定的临床应用价值。
[1] Debonera F,Krasinkas AM,Gelman AE,et al.Dexamethasone inhibits early regenerative response of rat liver after cold preservation and transplantation [J].Hepatology,2003,38(6):1563-1572.
[2] 庄 梅,方 颖,吴立荣,等.地塞米松对大鼠心肌缺血再灌注后细胞凋亡及金属硫蛋白表达的影响[J].中华老年心脑血管病杂志,2008,10(7):533-536.
[3] 张 炯,张 颖,江 潮,等,地塞米松预处理减轻肾缺血再灌注损伤[J].临床肾脏病杂志,2014,14(3):173-176.
[4] 石孟琼,白彩虹,孙桂林,等.开口箭不同提取部位对异丙肾上腺素所致小鼠心肌缺血损伤的影响[J].中国临床药理学与治疗学,2013,18(12):1344-1352.
[5] 任 平,杜 敏,闵 清,等.黄芪注射液与牛磺酸合用对小鼠实验性急性心肌缺血的保护作用[J].咸宁学院学报,2009,23(5):369-372.
[6] 严思敏,吴 双,蒋碧梅,等,异丙肾上腺素所致小鼠心肌肥厚中核仁的表达[J].中南医学科学杂志,2013,41(2):113-117.
[7] 董 军,姜 华,陈树涛.白细胞介素-6、白细胞介素-10、肿瘤坏死因子-α与冠心病关系的初步研究[J].天津医药,2014,42(11):1112-1113.
[8] 陈文惠.肿瘤坏死因子与白细胞介素-8在不同类型冠心病患者中的表达水平[J].白求恩医学杂志,2014,12(3):211-213.
[9] 吴心语,张朝明,王 刚,等.探讨白细胞介素-6、肿瘤坏死因子-α等血清炎性因子在急性心梗中的应用价值[J].实用检验医师杂志,2014,6(1):31-34.
[10]冉 华,王正中,何 艺,等.心肌缺血再灌注损伤中肿瘤坏死因子-α血清水平表达对心肌收缩功能影响的实验研究[J].中华临床医师杂志(电子版),2014,8(9):140-143.
[11]陆春雷,韩晓鹏,田志强,等.肾上腺髓质素对大鼠肾脏机械损伤早期TNF-β及其受体表达的影响[J].东南国防医药,2012,14(5):416-418.
[12]吴 勇,叶 芬,葛轶睿,等.SN50对缺血再灌注损伤中TNF-α影响的实验研究[J].东南国防医药,2014,16(5):453-455.
[13]奚群英,祝宝华,刘 晨.乳鼠心肌细胞缺血预适应模型的建立及电镜下超微结构的改变[J].实用临床医药杂志,2005(3):18-20.
[14]庄 梅,方 颖,吴立荣,等.地塞米松对缺血再灌注大鼠血流动力学和心肌超微结构的影响[J].贵阳医学院学报,2007,32(1):24-28.
[15]方 洁,陆 勤,王 浩,等.糖皮质激素对脑出血大鼠脑水肿的 TNF-α 影响研究[J].河北医学,2013,19(3):321-324.

