核酸适体技术及其在兽药残留检测中的应用
段 烨,高志强,王慧珊,张鹤晓,李 灏
(1.北京化工大学生命科学与技术学院,北京 朝阳 100029;2.北京出入境检验检疫局,北京 朝阳 100026;3.北京森康生物技术开发有限公司,北京 怀柔 101400)
核酸适体技术及其在兽药残留检测中的应用
段 烨1,高志强2,王慧珊3,张鹤晓2,李 灏1
(1.北京化工大学生命科学与技术学院,北京 朝阳 100029;2.北京出入境检验检疫局,北京 朝阳 100026;3.北京森康生物技术开发有限公司,北京 怀柔 101400)
近年来,随着食品安全事件的频繁发生,兽药残留已逐渐成为人们普遍关注的一个社会热点问题。传统的兽药残留检测方法主要包括气相色谱法、液相色谱法、毛细管电泳法等,这些方法其具有检测灵敏度较高、稳定性较好等特点,但对样品洁净度的要求较高以及检测成本较高,使得这几种检测方法无法满足现场快检的要求。因此,人们有必要开发更为简单、快速、有效的兽药残留检测方法。
核酸适体(aptamer),取自于拉丁文的“aptus”(意为适合)与希腊单词“meros”,中文译为“适体”、“适配子“或“核酸适体”[1]。适体的功能类似于抗体,适体-靶分子的结合与抗原-抗体的结合相似,同样具有高度特异性,此外,适体还具有许多明显优于抗体的特性:(1)适体的靶分子范围非常广泛;(2)适体的亲和力强、特异性高;(3)适体稳定性好。
正是基于核酸适体的上述优点,核酸适体技术在分析化学[2]、临床[3]、食品安全[4]、分子识别[5]、药物筛选[6]及药物残留检测等方面都展现了广阔的应用前景。本文就核酸适体技术及其在兽药残留检测分析中的应用进展及相关问题进行综述。
1 核酸适体技术及其研究进展
核酸适体技术主要运用由Tuerk和Gold等人于1990年建立的指数富集的配基系统进化技术(Systematic evolution of ligands by exponential en⁃richment,SELEX),对体外人工合成的随机寡核苷酸序列库进行反复筛选,从而获得能以极高亲和力和特异性与靶分子结合的一段寡核苷酸序列[7]。
1.1 SELEX技术原理及步骤 SELEX技术原理如图1所示,通过重复筛选与扩增,一些与靶物质不结合或亲和力较低的DNA或RNA分子被洗脱,而与靶物质具有高亲和力的DNA或RNA(适体)被从起初随机文库中分离出来,且其纯度随SELEX过程的进行而增高,从pmol级到nmol级,最终占据库的大多数(>90%)。
1.2 核酸适体筛选中的分离方法 如何分离与
靶物质结合的寡核苷酸分子是筛选过程的关键,但是在实际筛选中,SELEX技术往往受到筛选环境及技术本身限制,影响分离效果和筛选效率。近年来,研究人员在传统SELEX基础上,发展出许多不同的筛选分离方法。
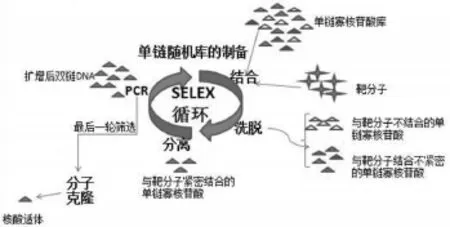
图1 SELEX流程
1.2.1 硝酸纤维素膜(Nitrocellulose filtermembrane,NC)过滤法 硝酸纤维素膜过滤法利用NC膜能吸附蛋白而不吸附游离DNA的特性,将共孵育的混合物经NC膜用真空抽吸过滤,与靶分子结合的寡核苷酸分子滞留在滤膜上,而未结合靶分子的游离寡核苷酸分子则被滤除掉。经洗涤、剪碎滤膜,利用洗脱、乙醇沉淀等回收与NC膜结合的寡核苷酸分子。刘晓静[8]于2004年用硝酸纤维素膜过滤法筛选到了人TGF-βRII核酸适体。该法操作简单、成本低,无需特殊设备;但此法不能应用于较小的靶分子,且对具有丰富构象的随机寡核苷酸序列有较强的背景吸附。
1.2.2 亲和柱法 亲和柱法是将靶分子通过共价键或亲和力连接到凝胶树脂上,将随机单链寡核苷酸库灌注层析柱,其与靶分子在层析柱上作用一定时间后,用冲洗缓冲液进行冲洗,与靶物质结合的文库序列会滞留在树脂上,未结合序列则流出层析柱,最后加入洗脱液洗脱下结合序列,即可获得相应的核酸适体。该法操作简便,能适用于小分子靶物质的核酸适体筛选。
2008年秦川[9]把青霉素与Epoxy(环氧基)活化琼脂糖凝胶FF偶联做固定相,通过亲和柱层析SELEX筛选方法,筛选获得青霉素的核酸适体。
1.2.3 磁珠法 磁珠可作为固相载体用于SELEX筛选,该法不仅可改善传统硝酸纤维素膜过滤法和亲和柱法相对费时费力、效率低下等问题,还可用于分离和建立所筛选的次级文库。1997年,Bruno等人[10]率先将甲苯磺酰基活化的磁珠作为固相载体连接靶蛋白,利用SELEX技术筛选核酸适体,他们将PCR引物进行生物素标记,经PCR扩增后核酸适体会被生物素标记,加入固定在磁珠上的靶蛋白及链亲和素就可检测每轮筛选文库与靶蛋白的结合力。
1.2.4 聚丙烯微孔板法 聚丙烯微孔板法是将靶分子固定在微孔板上,用牛血清封闭其余的位点,然后加入随机寡核苷酸文库,共孵育之后通过简单洗涤即可除去未结合的寡核苷酸序列,最后洗脱回收结合的寡核苷酸序列。2007年,冯香玲[11]将DON(脱氧雪腐镰刀菌烯醇)人工抗原吸附在微孔板上,以其作为固定相,经过10轮的筛选和扩增,得到了DON特异性的核酸适体。该法操作简单,成本低;但筛选效率较低。
1.2.5 毛细管电泳(Capillary electrophoresis,CE)法
毛细管电泳法基于结合靶分子的寡核苷酸分子电泳迁移速度变缓的原理,进行核酸适体的筛选分离。
2004年,Mendonsa等人[12]利用毛细管电泳成功分离获得免疫球蛋白IgE的核酸适体。CE-SELEX的出现极大提高了筛选效率和靶蛋白的适体亲和力,仅需2-4轮筛选就可获得靶分子高亲和力的ssDNA特异适体。但该法也存在诸如分离量小、不同靶分子的电泳条件需要各自优化等缺点,对不能引起较高电泳迁移率的靶分子如一些小分子、细胞等的分离效率低下;此外毛细管电泳仪的低普及程度也限制了CE-SELEX技术应用和推广。
以上这5种分离方法都有它们的优缺点,因此,要根据靶分子的性质特性以及获得的核酸适体的用途来选择何种分离方法。
2 核酸适体技术在兽药残留检测分析中的应用
兽药在预防和治疗动物疾病,特别是细菌病、寄生虫病方面极其重要,有些兽药作为饲料添加剂在促进动物生长。兽药的长期过度使用导致了兽药残留。兽药残留(Residues ofveterinary drug)是指动物用药后,任何可食动物源性产品中所含有的原型药物或/和其代谢产物,以及与兽药有关杂质的残留[13]。残留在动物体内的兽药,可随食物链进入人体,对人类健康构成潜在威胁。核酸适体技术具有高特异性及灵敏度,可较好地进行兽药残留检测。
2.1 核酸适体技术在抗生素类药物检测分析中的应用 为有效预防和治疗畜禽疾病,抗生素类药品和饲料被广泛应用于畜禽养殖,然而抗生素滥用,对环境安全及人类健康均造成极大威胁。因此,针对抗生素残留超标的检测不容忽视。
由于大部分抗生素都是半抗原,用免疫反应获得其抗体比较困难,但核酸适体技术的出现为抗生素残留的检测提供了新思路,即以抗生素作为靶物质通过体外筛选其核酸适体,进而用于检测分析。近年来,已有多种抗生素的核酸适体被筛选获得并在检测中得以应用(表1)。Wochner等人[21]则将所筛选出的柔红霉素的核酸适体固定于金纳米颗粒,构建了一种电化学传感器,用于检测人尿液中该药物的残留。2009年,Lee等人[22]将他们所筛选的土霉素的核酸适体作为分子识别元件,利用电化学生物传感器对土霉素进行检测,检测线范围为1~100 nmol/L。

表1 部分抗生素核酸适体
2.2 核酸适体技术在磺胺类药物以及驱虫剂类药物检测分析中的应用 磺胺类药物为广谱抗菌药,对许多革兰阳性菌和阴性菌均有效。在近15-20年,动物源食品中磺胺类药物残留量超标现象十分严重,所以对其检测迫在眉睫。2013年,倪姮佳[23]利用SELEX技术,经过9轮筛选成功获得磺胺甲基嘧啶的核酸适体,其筛选率约为75%;并建立了基于磺胺甲基嘧啶核酸适体的直接竞争化学发光免疫分析方法。其检测限为0.92 nmol/mL,IC50为5.61 ng/mL,线性范围为1.85~21.57 ng/mL。该方法可成功检测牛奶中磺胺甲基嘧啶残留,其回收率为88.0%~98.2%,变异系数为10.0%~23.4%。
驱虫剂类以有机磷类化合物应用最广泛,可有效杀灭生物机体内外的寄生虫。近几年来,核酸适体技术在驱虫剂检测分析中的应用正在兴起。例如,王丽等人[24]于2013年利用核酸适体技术,从一个固定的随机ssDNA库中对甲拌磷、丙溴磷、水胺硫磷、氧化乐果等4种有机磷农药的DNA适体进行了同时筛选并建立了检测方法。
2.3 核酸适体技术在激素与其他生长促进剂类检测分析中的应用 在畜牧生产过程中,为加快畜禽增长及出栏率,过量激素或生长素经常被人为添加。当人食用这些含大量激素的肉类食品后,也会导致相应疾病的发生,甚至导致死亡。因此,很有必要加大对食品中这些物质的检测、监管力度。为了更快捷、方便的检测,科研工作者筛选获得了多种激素的核酸适体(表2)。Kim等人[25]将17-β雌二醇的核酸适体与电极相连,利用电化学生物传感器对17-β雌二醇进行检测。
2.4 核酸适体技术在其他非法添加物检测分析中的应用 孔雀石绿曾被许多国家广泛用作水产养殖业中的杀虫剂和杀菌剂,用以杀灭体外寄生虫和鱼卵中的真菌。由于孔雀石绿在鱼体内和环境中残留时间长,并具有潜在致突变、致畸和致癌的危险性,故我国、美国、加拿大以及欧盟等许多国家均禁止将其作为兽药用于人类食用鱼。2001年,Grate等人[28]利用RNA适体对孔雀石绿进行检测,检出限可达到1μmol/L,从此该核酸适体被作为识别元素用于鱼肉组织内的孔雀石绿的荧光检测。
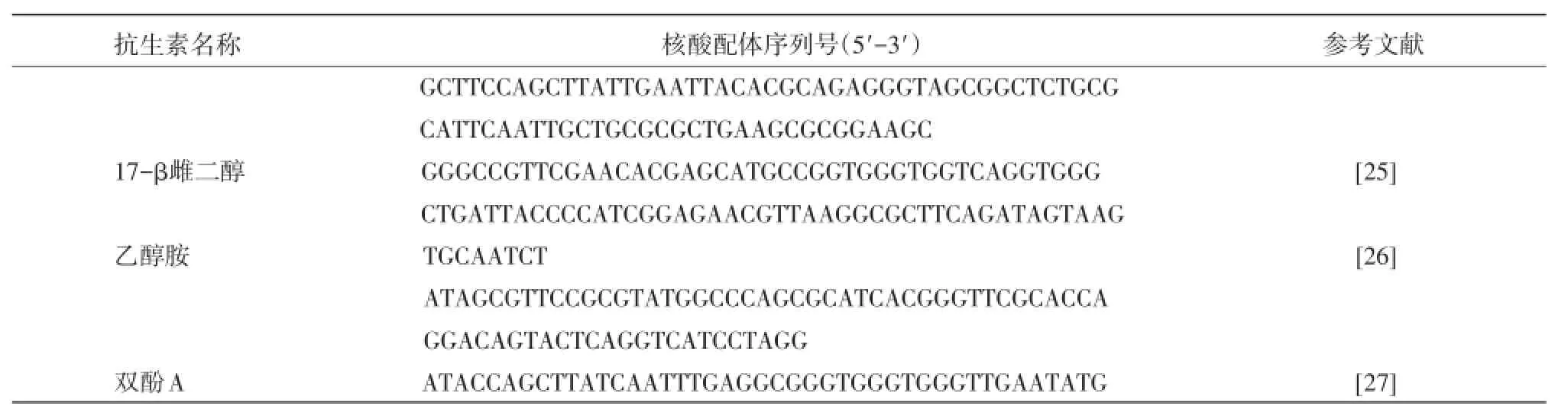
表2 部分激素核酸适体
此外,各种汞制剂如氯化亚汞、硝酸亚汞、乙酸汞、吡定基乙酸汞,曾被作为有效的杀虫剂而用于动物杀虫,但因其剧毒性,现已被禁止作为兽药继续使用。2009年,Xu等人[29]设计了6条长
度为20个核苷酸且富含T碱基的DNA序列,利用非修饰的纳米金建立了基于纳米金颜色变化的Hg+检测方法,结果发现含有4个T-T碱基对序列的检测效果最好,检出限可达0.51μmol/L。
3 展望
核酸适体技术自问世以来,在筛选技术上不断丰富和完善,应用领域不断拓展。通过筛选获得的核酸适体已被广泛用于激素类、杀菌剂、抗生素、驱虫剂等兽药残留的检测,其检出限已经超过了传统检测方法,其检测灵敏度可完全达到相关国家标准。
与其他传统的检测方法如色谱法、酶标法相比,基于核酸适体的检测方法有很强的发展潜力,具有操作简单,耗时短,灵敏度高,成本低廉,且易于现场检测等特点,非常适用于兽药残留的现场快速检测和风险预警。但是核酸适体技术在兽药残留检测分析领域依旧面临着许多问题和挑战,例如,相比于种类繁多的抗体,针对不同兽药的核酸适体的种类是有限的,这也是制约核酸适体用于兽药残留检测发展的主要瓶颈。
此外,传统SELEX技术以小分子为靶分子进行筛选时,通常把靶分子固定在凝胶或者磁珠上,来实现分离过程。但是类似兽药等小分子,直接固定在基质上有一定难度,需要在小分子上引入活性基团使其与固相载体结合。而兽药靶分子的改造需要保证其活性不被破坏,且不能掩盖与核酸的结合位点。因此,如何既能固定靶分子,又能保证靶分子的活性以及其结合位点不被阻断,将是未来的重要研究方向。
总之,随着核酸适体技术的不断进步,其在兽药残留检测中的应用也将更为广泛和深入,必将促进兽药残留检测的发展。
[1]http://baike.baidu.com/view/1185010.htm.
[2]张月侠,宋茂勇,李涛,等.适配体的筛选及在生命分析化学中的应用[J].生物技术,2009,19(5):90-94.
[3]张贝,邬芳玉,张烷和.核酸适配子及其在肿瘤诊断与治疗中的应用[J].国际肿瘤学杂志,2006,38(10):756-763.
[4]徐敦明,吴敏,邹远,等.核酸适体技术在食品安全分析中的应用[J].分析化学评述与进展,2011,6(6):925-933.
[5]周成林,许化溪.SELEX技术及Aptamer在小分子中的应用进展[J].中国国境卫生检疫杂志,2011.8(34):276-288.
[6]Micheal Famulok,Jorg S.Hartig and gunter mayer fuctional ap⁃tamers and aptazymes in biotechnology,diagnostics,and therapy [J].ChemicalReview,2007,8:3715-3743.
[7]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase [J].Science,1990,249(4968):505-510.
[8]刘晓静.SELEX技术筛选人TGF-βRII亲和核酸库方法的建立[D].重庆:第三军医大学.2004.
[9]秦川,SELEX技术筛选青霉素类抗生素适体及其运用方法的初步探索[D].重庆:西南大学,2008.
[10]Bruno J G.In vitro selection of DNA to chloroaromatics using magnetic microbead-based affinity separation and fluorescence detection[J].Biochem Biophys Res Commun,1997,234(1):117-120.
[11]冯香玲,采用SELEX技术筛选脱氧雪腐镰刀菌烯醇适配子的初步研究[D].南昌:南昌大学,2007.
[12]Mendonsa SD,Bowser M T.In vitro evolution of functional DNA using capillaryelectrophoresis[J].JAm Chem Soc,2004,126(1):20-21.
[13]http://baike.baidu.com/view/1140479.htm.
[14]Jaytry Mehta,Bieke Van Dorst,Elsa Rouah-Martin,Wouter Her⁃rebout,Marie-Louise Scippo.In vitro selection and characteriza⁃tion of DNA aptamers recognizing chloramphenicol[J].Journal of Biotechnology,2011,10(155):361-369.
[15]秦川,SELEX技术筛选青霉素类抗生素适体及其运用方法的初步探索[D].重庆:西南大学,2008.
[16]Niazi JH,Lee S J,Kim Y S,et al.Ssdna Aptamers That Selec⁃tively Bind Oxytetracycline[J].Bioorganic and Medicinal Chemis⁃try,2008,16(3):1254-1261.
[17]Zhou N,Wang J,Zhang J,et al.Selection and Identification of Streptomycin-Specific Single-Stranded DNA Aptamers and the Application in the Detection of Streptomycin in Honey[J].Talanta,2013,108(0):109-116.
[18]Niazi JH,Lee S J,Gu M B.Single-Stranded DNA Aptamers Spe⁃cific for Antibiotics Tetracyclines[J].Bioorganic and Medicinal Chemistry,2008,16(15):7245-7253.
[19]Song K M,Cho M,Jo H,et al.Gold Nanoparticle-Based Colori⁃metric Detection of Kanamycin Using a DNA Aptamer[J].Analyti⁃cal Biochemistry,2011,415(2):175-181.
[20]Schiirer H,Stembera K,Knoll D,et al.Aptamers That Bind to the Antibiotic Moenomycin A[J].Bioorganic and Medicinal Chem⁃istry,2001,9(10):2557-2563.
[21]Wochner A,Menger M,Orgel D,et al.A DNA Aptamer with High Affinity and Specificity for Therapeutic Anthracyclines[J]. Analytical Biochemistry,2008,373(1):34-42.
[22]Niazi JH,Lee S J,Kim Y S,et al.Ssdna Aptamers That Selec⁃tively Bind Oxytetracycline[J].Bioorganic and Medicinal Chemis⁃try,2008,16(3):1254-1261.
[23]倪姮佳,恩诺沙星和磺胺二甲嘧啶核酸适配体的筛选及化学发光检测方法的研究[D].北京:中国农业大学,2013.
[24]王丽,刘贤金,张存政,等.4种有机磷农药DNA适体的筛选及结构分析[J].南京农业大学学报,2013,36(6):117-122.
[25]Kim Y S,Jung H S,Matsuura T,et al.Electrochemical Detection of 17β-Estradiol Using DNA Aptamer Immobilized Gold Elec⁃trode Chip[J].Biosensors and Bioelectronics,2007,22(11):2525-2531.
[26]Jo M,Ahn J Y,Lee J,et al.Development of Single-Stranded DNA Aptamers for Specific Bisphenol a Detection[J].Oligonucle⁃otides,2011,21(2):85-91.
[27]Maim D,Reinemann C,StoHenburg R,et al.In Vitro Selection of DNA Aptamers Binding Ethanolamine[J].Biochemical and Bio⁃physical Research Communications,2005,338(4):1928-1934.
[28]Grate D,Wilson C.Inducible regtllation of the S.cerevisiae cell cy⁃cle mediated by an RNA Aptanler-ligand complex[J].Medicinal Chemistry,2001.9(10):2565-2570.
[29]Xu X,Wang J,Jiao K,etal.Colorimetric detection ofmercury ion(Hg2+)based on DNA oligonuclectides and unmodified gold nanoparticles sensing system with a tunable detection range[J].Bi⁃osensors and Bioelectronics,2009,24(10):3153-3158.
S852.65
A
0529-6005(2015)11-0075-03
2014-12-05
质检公益性行业科研专项(201310253)
段烨(1988-),女,硕士生,主要从事生物工程研究,E-mail:duanziling@foxmail.com
李灏,E-mail:lihao@mail.buct.edu.cn

