杜仲注射液的制备及安全性试验
赵微微,武 瑞,吴国军,王翠媛,于德斌,梁建斌,李启涛
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
杜仲注射液的制备及安全性试验
赵微微,武 瑞,吴国军,王翠媛,于德斌,梁建斌,李启涛
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
为了制备杜仲注射液,并对其安全性进行评价,通过单因素试验对附加剂最适用量范围进行研究,应用L9(3)4正交试验方法研究注射液配方最佳用量,采用单因素试验对活性碳用量、吸附时间以及吸附温度进行确定;根据热原检查法、异常毒性试验检查法、过敏性试验检查法以及溶血和凝聚试验检查法对杜仲注射液的安全性进行评价。结果:最佳制备工艺为在杜仲叶提取液中加入0.14%亚硫酸氢钠(W/V)、0.05%吐温-80(V/V)和0.2%药用活性炭(W/ V),45℃吸附25min,过滤,分装,灌封;杜仲注射液符合安全性试验检查规定。
杜仲注射液;制备工艺;安全性
杜仲(Eucommia ulmoidesOlive)在我国已有2000多年的用药历史,《神农本草经》和《本草纲目》中均有记载,被列为上品。杜仲叶与杜仲皮含有绿原酸、杜仲酸、多糖、珊瑚苷以及黄酮类等相似活性成分,其具有抗菌、抗炎、抗肿瘤、增强免疫力以及抗氧化等多种药理作用[1-4]。《中国药典》(2005版)确定绿原酸为杜仲叶主要药用有效成分和含量检测标准[5]。杜仲叶提取液在畜牧生产中应用广泛,但多为散剂,影响疗效。本试验旨在制备一种杜仲注射液,并对其进行安全性评价。
1 试验材料
1.1 试验材料与动物 绿原酸标准品(中国食品药品检定研究院);乙醇(天津市永大化学试剂有限公司);氢氧化钠(天津市光复科技发展有限公司);吐温-80(天津市瑞金特化学品有限公司);亚硫酸氢钠(天津市致远化学试剂有限公司);明胶(天津市复兴精细化工研究所);药用活性炭(上海宝曼生物科技有限公司);家兔、小鼠、豚鼠(长春生物制品研究所)。
1.2 试验仪器 1200型高效液相色谱仪(美国Agilent);DK-S12型恒温水浴锅(上海森信实验仪器有限公司公司);DRP-9272型电热恒温培养箱(上海森信实验仪器有限公司);AL204电子天平(梅特勒-托利多仪器上海有限公司);RE52-99旋转蒸发仪(上海亚荣生化仪器厂);SH2-Ⅲ循环水真空泵(上海亚荣生化仪器厂);实验室pH计FE20(梅特勒-托利多仪器上海有限公司)。
1.3 试验方法
1.3.1 高效液相色谱法绘制绿原酸标准曲线 色谱条件:色谱柱为Sepax Bio-C18(250 mm×4.5 mm,5μm,美国Sepax公司);流动相为88%A(磷酸缓冲液,0.03mol/L,pH值=4.71),12%B(乙腈);流速为1.00mL/min;柱温为28℃;UV检测波长为328 nm;进样量为10μL。
绿原酸标准液制备:精密称取绿原酸标准品15mg,加入注射用水使其充分溶解,制成绿原酸标准液15 mg/mL,再用注射用水稀释成不同浓度备用,以绿原酸含量(mg)为横坐标,以峰面积为纵坐标绘制绿原酸标准曲线。
1.3.2 杜仲注射液的制备 (1)杜仲叶提取液的前处理:取杜仲叶提取液适量,适度浓缩后加入乙醇,使药液乙醇浓度为75%,4℃避光静止24 h,3000 r/min离心20min,过滤,回收乙醇,将药液浓缩至1.5 g/mL。向浓缩后的药液中加入4%明胶,至不再产生沉淀为止,避光静止30 min,加入乙醇,使药液乙醇浓度为85%,4℃避光静止24 h,3 000 r/min离心30min,过滤,回收乙醇,将药液浓缩至1 g/mL,备用;(2)亚硫酸氢钠、吐温-80常用范围分别为0.05%~0.25%(W/V),0.04%~0.15%(V/ V),pH值常用范围为4~9,本试验采用单因素试验对亚硫酸氢钠、吐温-80用量以及注射液pH值适合范围进行筛选。以单因素试验结果为依据,应用正交试验确定最适亚硫酸氢钠、吐温-80用量和pH值,通过绿原酸含量、注射液颜色和澄明度进行评价,评价标准如表1,总分数=峰面积/ 100+外观得分;(3)采用单因素试验对药用活性炭用量[0.1%、0.2%、0.3%、0.4%(W/V)]、吸附温度(30℃、45℃、60℃、75℃、90℃)、吸附时间(15 min、25min、35 min、45min)进行确定,通过绿原酸含量和透光率进行评价;(4)根据《中国兽药典》(2010版二部附录)安全性检查法,对杜仲注射液安全性进行评价。见表1。

表1 外观评分标准
2 试验结果与分析
2.1 高效液相色谱法绘制绿原酸标准曲线 回归方程为y=142.99x+85.123,R2=0.9977(n=6),其中x为绿原酸含量(mg),y为绿原酸峰面积,由此可知绿原酸含量在2.5~15mg范围内具有良好的线性关系。见图1。
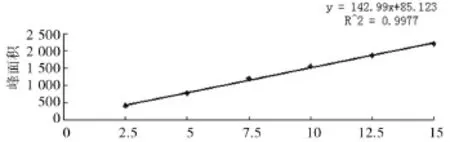
图1 绿原酸标准曲线
2.2 附加剂筛选结果 单因素试验结果表明,最佳的亚硫酸氢钠用量范围为0.14%~0.16%,吐温-80用量范围为0.05%~0.06%,最适pH值范围为5~6。正交试验因素及水平见表2,试验结果显示pH值对试验影响最大,亚硫酸氢钠次之,最适配方为0.14%亚硫酸氢钠,0.05%吐温-80,pH值为5。见表2。
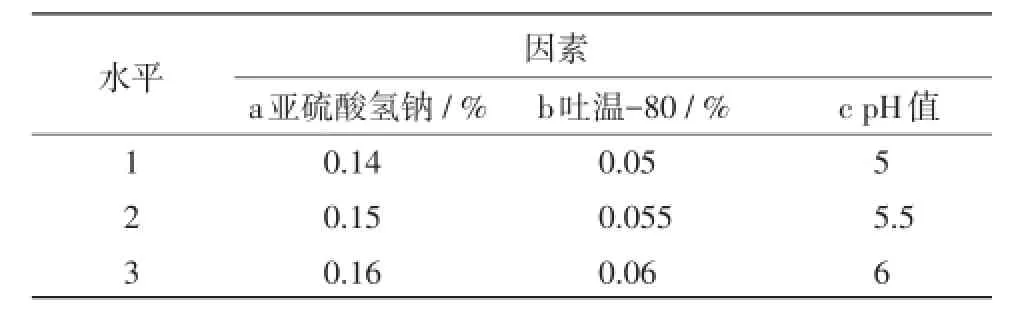
表2 正交试验因素与水平考察
2.3 脱色条件选择结果 通过对绿原酸含量和透光率两方面的综合考虑,结果显示,当脱色条件为0.2%的药用活性炭,45℃吸附25min效果最佳。
2.4 安全性试验结果
2.4.1 热原检查结果 3只家兔体温升高温度均低于0.6℃,且体温升高总和为0.5℃,低于1.3℃,符合《中国兽药典》(2010二部附录)热原检查的规定。
2.4.2 异常毒性检查结果 以静脉注射、腹腔注射、皮下注射以及口服给药的20只试验小鼠在48 h内未出现死亡,符合《中国兽药典》(2010二部附录)异常毒性检查法的规定。
2.4.3 过敏试验 6只试验豚鼠在给药30min后未出现竖毛、发抖、干呕、连续喷嚏3声、连续咳嗽3声等过敏现象,符合《中国兽药典》(2010二部附录)过敏性试验规定。
2.4.4 溶血与凝血试验 1、2号管上清液有色澄明且上清液颜色与5号试管无明显差异,红细胞全部下沉,3 h内未出现溶血和凝聚,符合《中国兽药典》(2010版二部附录)溶血与凝聚检查法的规定。
3 讨论
徐北平研究发现,抗氧化剂对绿原酸的降解有一定抑制作用,其中亚硫酸氢钠效果最好[6]。而亚硫酸氢钠常用浓度为0.05%~0.2%,试验结果表明,药液亚硫酸氢钠浓度为0.14%效果最好;常用的中药增溶剂有吐温-80和胆酸盐,其中胆酸盐适合pH值在6以上的中药注射液,pH值在6以下时,胆酸易析出;而吐温-80是注射液中用的较多的增溶剂,常用浓度为0.04%~0.2%,试验结果表明,药液吐温-80浓度为0.05%时得分最高;注射液pH值一般在4~9之间,如果血液中pH值忽然过高或过低,则会危害细胞代谢,危及生命。试验结果显示,pH值为5时综合评分最高。
杜仲叶提取液中含有很多有色物质,颜色较深,影响注射液的颜色,活性炭可将有色物质吸附在表面上,从而达到脱色的作用。同时,活性炭吸附法还能起到除热原的作用。活性炭吸附法在脱色和吸附热原的同时,也会吸附一些药物成分,应注意活性炭用量、吸附时间和吸附温度等因素,试验结果表明,活性炭用量、吸附时间和吸附温度超过一定值时对绿原酸含量都有一定影响,而对透光率影响不大。因此选择0.2%药用活性炭,45℃吸附25min,吸附后0.45μm微孔滤膜粗滤,0.20μm微孔滤膜精滤。
4 结论
综上所述,本试验成功制备了杜仲注射液,其符合《中国兽药典》(2010版二部附录)安全性检查规定。
[1]秦国利.浅谈杜仲的化学成分及药理作用[J].中医中药,2012,10(26):613-614.
[2]彭红梅,李小姝.杜仲的药理研究现状及应用展望[J].中医学报,2013,28(176):72-73.
[3]王志宏,彭胜,雷明盛,等.杜仲主要生物活性研究进展[J].天然产物研究与开发,2013,25:1302-1309.
[4]Ohrishi M.Inhibitory effects of chlorogenic acids on linoleicacid peroxide ation and haemolysis[J].phytochemistry,1994,36(3):576-583.
[5] 国家药典委员会.中国药典[S].2005版一部:114.
[6]徐北平.杜仲叶中高纯度绿原酸的提取及稳定性研究[D].南昌:南昌大学,2012.
[7] 中国兽药典委员会.中国兽药典[S].2010版二部,附录:176.
S853.7
B
0529-6005(2015)11-0070-02
2014-06-25
赵微微(1989-),女,硕士,从事中兽药开发研究,E-mail:821320288@qq.com
武瑞,E-mail:fuhewu@126.com

