猪繁殖与呼吸综合征病毒N蛋白的原核表达和间接ELISA方法的建立
王麒文,张鹤晓,高志强,林祥超,张乐萃
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.北京出入境检验检疫局,北京 朝阳 100026)
猪繁殖与呼吸综合征病毒N蛋白的原核表达和间接ELISA方法的建立
王麒文1,张鹤晓2,高志强2,林祥超1,张乐萃1
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.北京出入境检验检疫局,北京 朝阳 100026)
根据猪繁殖与呼吸综合征病毒JX株编码N蛋白的ORF7基因序列设计特异性引物。采用RT-PCR方法扩增猪繁殖与呼吸综合征病毒ORF7基因片段(367 bp),将其克隆于表达载体pET-32a上。测序验证后将重组质粒pET-32a-JX-N转入宿主菌Rosetta,经0.7mmol/L IPTG诱导,SDS-PAGE显示外源基因编码的重组N蛋白在宿主菌中表达效率较高。Western-Blot试验结果显示,重组N蛋白具有反应原性。将纯化的重组N蛋白包被酶标板,建立并优化了能够用于PRRSV抗体检测的间接ELISA方法。
猪繁殖与呼吸综合征病毒;N蛋白;重组表达;间接ELISA
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的,对猪有极强感染性的免疫抑制性传染病。1996年中国境内首次分离到美洲型PRRSV[1]。一直以来PRRSV主要危害的是妊娠期的母猪和仔猪,在2006年变异的PRRSV(HPPRRSV)显示出了更强的致病性,除了妊娠期的母猪和仔猪以外,包括公猪在内的其他猪只也会因感染本病毒而死亡[2-3]。PRRSV含有一个单股正链RNA基因组,它的全长包含有9个开放阅读框(ORF1a、ORF1b、ORF2-ORF7),其中ORF7编码的N蛋白在流行的毒株中,具有较高的保守性,可与大多数美洲株和欧洲株病毒抗体起反应[4]。
抗体依赖的病毒感染增强作用(ADE)[5]以及PRRSV导致机体产生的持续性患病和免疫抑制,造成病猪发生严重的继发性和持续性感染,从而使临床症状出现多样化。因此建立准确而有效的PRRS检测方法,有利于制定有效的PRRSV防控策略。
本研究应用原核表达并纯化的PRRSV JX株N蛋白作为包被抗原,建立并优化了能够有效检测PRRSV抗体的间接ELISA方法。
1 材料与方法
1.1 主要试剂 Taq DNA聚合酶,限制性内切酶Bam HI,Hind III,质粒提取试剂盒,T4 DNA连接酶,购自TaKaRa公司;TRIZol,购自Invitrogen公司;M-MLV反转录酶,购自Promega公司。
1.2 病毒、宿主菌、质粒和阳性血清 猪繁殖与呼吸综合征病毒JX株,原核表达质粒pET-32a,动物疫病诊断联合实验室保存;大肠杆菌(E.coli)Rosetta,Top10,购自北京康为世纪生物科技有限公司;PRRSV阳性血清,本实验室保存。
1.3 猪繁殖与呼吸综合征病毒ORF7基因扩增参照JX株PRRSV编码N蛋白的ORF7基因序列设计一对引物,设计的引物名称、序列见表1。

表1 PRRSV的引物名称和序列
提取JX株猪PRRSV核酸进行RT-PCR扩增,扩增条件如下:30℃5min,42℃60min,70℃15min,94℃预变性3min后进入扩增循环,循环参数是94℃变性30 s、54℃退火30 s、72℃延伸50 s,30个循环后,72℃延伸10min。扩增目的片段-20℃保存。
1.4 原核表达载体构建与测序分析 对于表达载体pET-32a和上述目的片段,分别使用限制性内切酶BamH I,Hind III在37℃条件下作用5 h,之后在16℃条件下用连接酶连接过夜后,转化至Top10感受态细胞,涂板后挑取单菌落,菌落PCR鉴定后送测序。将序列比对正确的阳性菌进行扩大培养后提取质粒,并命名为pET-32a-JX-N。
1.5 重组N蛋白的表达与纯化 将提取的pET-32a-JX-N重组质粒转化至Rosetta表达工程菌种中,在恒温空气震荡摇床中进行扩大培养。在菌液OD600nm
值为0.6时加入一定浓度的IPTG,在加入IPTG前取少量菌液作为未表达的阴性对照。取诱导后以及未诱导的菌体进行裂解煮样后,进行SDS-PAGE电泳,根据考马斯亮蓝染色结果来判定重组蛋白是否表达,并通过改变重组蛋白诱导表达过程中诱导时间、IPTG的终浓度及培养温度等条件来改变该重组蛋白表达性质,以期获得最佳表达条件。
对于收集的菌体利用超声进行裂解,取裂解产物上清通过His·Bind试剂盒进行纯化。
将纯化的蛋白进行SDS-PAGE电泳,并将目的条带电转至硝酸纤维素膜,以PRRSV感染的猪血清作为一抗进行Western-Blot检测,根据反应结果来判定该重组蛋白的反应原性。
1.6 重组N蛋白间接ELISA方法的建立 本研究中利用棋盘滴定法分别对抗原包被浓度及包被条件,最佳封闭液种类及一抗稀释度,二抗稀释度等条件进行了优化。
1.7 阴阳性临界值的确定 在摸索的间接ELISA方法最佳条件下,随机检测30份临床PRRSV抗体阴性血清,显色后读取OD450nm值,计算30份阴性血清OD450nm的平均值(-x)和标准差(SD),以-x+3SD作为该方法判定阴阳性的临界值,即当待检血清OD450nm值高于此临界值时判为阳性,否则为阴性。
1.8 重复性试验 分别选取5份阳性及阴性PRRSV血清样品进行检测,每个血清重复3个酶标孔,用同一次包被的酶标板进行板内重复性试验;另外将重组蛋白分别在不同时间段包被酶标板,同样分别利用5份PRRSV阴阳性血清作为一抗,检测板间重复性,分别计算板内和板间变异系数。
1.9 特异性试验 用建立的间接ELISA方法分别检测猪繁殖与呼吸综合征病毒、猪圆环病毒2型、口蹄疫病毒、猪流行腹泻病毒、猪传染性胃肠炎病毒和猪瘟病毒的阳性血清,判定该方法对于检测PRRSV抗体的特异性。
1.10 间接ELISA符合率试验 利用本研究建立的间接ELISA方法检测30份猪血清样品,同样条件下用IDEXX公司的PRRSV ELISA抗体检测试剂盒进行重复性检测。并对检测结果进行以下处理,统计二者检测的阳性数与二者检测的阴性数,相加后与检测总数相除得到符合率。
1.11 间接ELISA与中和试验比较 利用中和试验测定30份猪血清样品的中和效价,同时对这30份猪血清样品从1∶2依次倍比稀释至1∶256后用本试验所建立的间接ELISA方法进行检测,测得其ELISA效价,与先前的中和效价进行比较分析。
2 结果
2.1 猪繁殖与呼吸综合征病毒N蛋白基因片段扩增结果 对PRRSV编码N蛋白的ORF7基因片段进行RT-PCR扩增,1.25%琼脂糖凝胶电泳结果显示,RT-PCR扩增产物与预期大小(367 bp)一致(图1)。

图1 RFF7基因片段RT-PCR扩增结果1:目的片段RT-PCR扩增结果;M:DL-2 000DNA分子Marker
2.2 猪繁殖与呼吸综合征病毒N蛋白原核表达重组载体构建及质粒序列分析 目的片段和表达载体pET-32a分别经BamH I,Hind III进行双酶切后,连接并转化后,挑取单菌落送去公司测序,经过比对分析,该测序结果与与预期结果一致。将测序正确的阳性菌进行扩大培养后成功提取了pET-32a-JX-N质粒。
2.3 猪繁殖与呼吸综合征病毒N蛋白的诱导表达与纯化 重组质粒转化至Rosetta工程菌,挑取单菌落进行扩大培养,并扩大至200mL含有氨苄的LB液体培养基中进一步扩大培养,当OD600nm值升至0.6后,加入终浓度为0.7mmol/L的IPTG,在37℃空气摇床中进行5 h的诱导表达。SDSPAGE结果显示,该重组蛋白在此诱导条件下主要为上清表达,且经过考马斯亮蓝染色后在30 kDa处可见目的蛋白条带(图2)。使用His·Bind试剂盒纯化后得到高纯度的目的蛋白(图3)。
经过Western-Blot检测,根据蛋白Marker判定在约30 kDa处有预期条带(图4)。表明该重组N蛋白的反应原性较好。
2.4 重组N蛋白间接ELISA方法的建立 对于建立ELISA过程中的各个条件进行摸索,优化结果如下:抗原最佳包被浓度为0.64μg/mL,最佳包被条件为37℃作用2 h加4℃过夜;较为理想的封闭液为5%脱脂奶;合适的血清稀释度为1∶80;HRP标记的rec Protein G按照1∶1 000倍稀释最佳。
2.5 临界值的确定 经对30份PRRSV阴性血清进行测定,确定样本临界值为0.32。
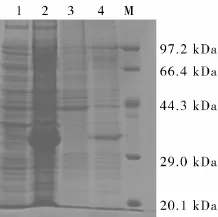
图2 SDS-PAGE电泳结果M:低分子量蛋白Marker;1:未经IPTG诱导的菌体上清;2:经IPTG诱导的菌体上清;3:未经IPTG诱导的菌体沉淀;4:经IPTG诱导后的沉淀

图3 纯化后的重组蛋白M:低分子量蛋白Marker;1:纯化后的重组蛋白

图4 Western-Blot试验结果
2.6 重复性试验 经测定计算,板内变异系数为1.07%~5.67%,板间变异系数为1.16%~4.27%,均小于10%,证明该方法重复性良好。
2.7 特异性试验 特异性试验的结果显示:猪繁殖与呼吸综合征病毒阳性血清OD450nm值高于临界值,为阳性。检测的PCV-2、FMDV、PEDV、TGEV和CSFV阳性血清OD450nm值均小于0.32,为阴性。
2.8 间接ELISA符合率试验 根据本研究建立的间接ELISA方法在检测30份猪血清临床样本的基础上,同时用IDEXX公司的PRRSV ELISA抗体检测试剂盒进行对照,对比得出二者的符合率为93%。对于30份猪血清临床样本检测结果见表2。

表2 N蛋白间接ELISA与IDEXX检测结果比较
2.9 间接ELISA与中和试验比较 对30份猪血清同时使用本研究建立的间接ELISA方法和中和试验进行抗体检测,统计结果见表3。
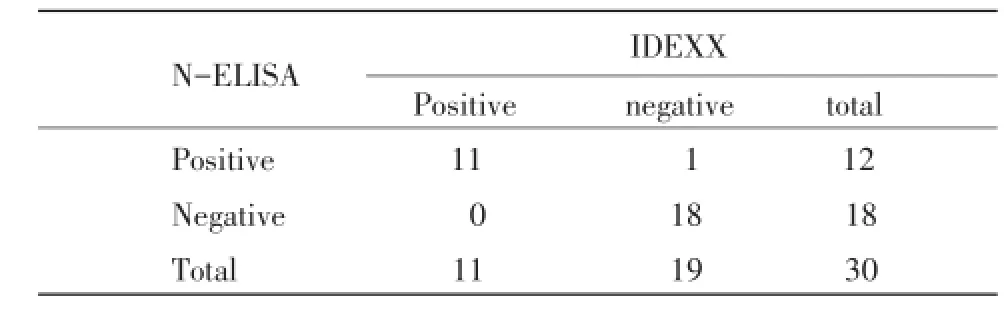
表3 N蛋白间接ELISA与中和试验检测结果比较
3 结论与讨论
本试验对于N蛋白进行了重组表达并利用其作为包被抗原,建立了可用于PRRSV抗体检测的间接ELISA方法。
中国境内流行的PRRSV主要为美洲株,国内赵耘等鉴定到欧洲型PRRSV分离株的存在[6],因而作为间接ELISA方法检测用的包被抗原N蛋白是首选蛋白。
在间接ELISA方法建立过程中,通过对反应条件的探索,初步建立了针对PRRSV抗体的间接ELISA方法,对于检测过程中发生假阳性的现象,通过调整PBST洗涤次数,由初期洗涤3次改为洗涤5次,产生假阳性的现象明显减少,同时板内变异系数也相应降低。究其原因主要是对于每个试验孔用PBST洗涤5次比洗涤3次更加彻底,前者能够降低非特异性结合现象的发生,从而增加了检测的准确性。
对30份猪血清样品,同时利用本研究所建立的间接ELISA方法和中和试验检测PRRSV抗体的结果,经过统计分析后显示二者没有相关性。其主要原因是猪在感染PRRSV后1周左右就能产生特异性抗体,但这些抗体并非中和抗体,中和抗体产生较晚,而且机体产生量较低。中和试验只能检测机体产生的中和抗体,这也就解释了检测结果中间接ELISA方法检测结果为阳性而中和试验检测为阴性的现象。
间接ELISA符合率试验显示,本研究建立的间接ELISA方法与进口试剂盒具有较高的符合率,有望应用于PRRSV抗体的临床检测和流行病学调查,同时重组N蛋白的表达和纯化也为单克
隆抗体的制备打下了基础。
[1]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996,87(2):1-5.
[2]Tian K G,Yu Xiu-ling,Zhao Tie-zhou,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China andmolecular dissection of the unique hallmark[J].PLoSONE,2007,2(6)e526:1-10.
[3]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-327.
[4]黄小波,钱洪喜,曹三杰,等.猪繁殖与呼吸综合征ORF7基因的克隆及其在毕赤酵母中表达[J].中国兽医学报,2013,33(8):1137-1141.
[5]Mascolar J R,Mathieson B J,Zack P,et al.Summary report: Workshop on the potential risks of antibody-dependent enhance⁃ment in human HIV vaccine trials,AIDSRes[J].Hum.Retrovirus⁃es,1993,9:1175-1184.
[6]赵耘,罗长宝,陈茹,等.猪繁殖和呼吸综合征病毒B13株ORF7基因的克隆及在杆状病毒系统中的表达[J].病毒学报,2001,17(1):75-80.
S852.65+1
A
0529-6005(2015)11-0049-03
2015-06-11
质检公益性行业科研专项“动物疫病核酸标准物质制备关键技术研究(201310253)
王麒文(1990-),男,硕士生,研究方向为动物检验检疫,E-mail:13718231269@163.com
张乐萃,E-mail:lczhang@qau.edu.cn

