DSS诱导血管内皮细胞ECV304凋亡及机制研究
张宸豪,陈 为,王月华,李 强,李 妍
(吉林医药学院检验学院,吉林 吉林 132013)
DSS诱导血管内皮细胞ECV304凋亡及机制研究
张宸豪,陈 为,王月华,李 强,李 妍
(吉林医药学院检验学院,吉林 吉林 132013)
为了研究葡聚糖硫酸钠(DSS)诱导血管内皮细胞ECV304增殖和凋亡的影响。体外培养血管内皮细胞ECV304,采用不同浓度DSS诱导细胞,流式细胞术分析细胞凋亡、活性氧(ROS)、线粒体膜电位(MMP)、细胞周期;WST-1法检测细胞增殖抑制率。结果显示,随着DSS浓度的增加细胞凋亡率增加,并导致细胞GOG1期阻滞,细胞内活性氧含量减少,同时线粒体膜电位下降,细胞增殖抑制率明显升高。结果表明,DSS可以抑制血管内皮细胞ECV304增殖并诱导细胞凋亡。
DSS;凋亡;血管内皮细胞
炎症性肠病(inflammatory bowel disease,IBD)是一组病因不明的慢性肠道炎症性疾病[1]。在人类表现为两种独立的疾病,溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),虽然IBD发病机制还尚不明确,但环境因素、遗传因素、肠道菌群失调和机体免疫功能失调在IBD发病机制中占有重要地位[2]。葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)是一种人工合成的硫酸多糖体,具有和肝素同样的抗止血及抗凝血作用,其诱导的小鼠肠道损伤是人类炎性肠病的最常用的实验性动物模型[3],近年来有学者认为,肠道黏膜血管内皮损伤和局部免疫细胞活化在IBD进程中具有重要作用[4],但尚无文献报道DSS对血管内皮细胞是否有损伤作用,以及损伤血管内皮细胞的机制也未见报道。因此,本研究以体外培养的血管内皮细胞ECV304为模型,用不同浓度的DSS处理细胞,分析细胞增殖、凋亡、活性氧和线粒体膜电位变化。进一步揭示其损伤机制,这对研究IBD发生机制及药物筛选均有重要意义。
1 材料与方法
1.1 材料 人ECV304血管内皮细胞,购自中国科学院上海细胞所;1640培养液,购自Gibco公司;小牛血清,购自Hyclone公司;PI和Annexin-V-FITC细胞凋亡试剂盒,购自eBiocience公司。JC-1线粒体膜电位(mitochondrialmembrane potential,MMP)检测试剂盒(产品编号C2006)和ROS荧光探针双氯荧光黄乙酸乙酯(Dichlorofluorescin diacetate,DCFH-DA),购自上海碧云天生物技术研究所;DSS,购自Sigma公司。流式细胞仪型号为Epics XL(美国贝克曼公司)。
1.2 细胞培养和处理 试验前1周,自液氮中取出冻存的细胞,复苏后在如下条件下培养:含10%小
牛血清1640培养液、5%CO2、饱和湿度和37℃。2~3 d传代1次,取对数生长期细胞用于试验。按如下分组加入DSS制剂:DSS0,200,400,800,1 600 μg/mL和3 200μg/mL诱导细胞24 h进行ROS和凋亡检测,或采用DSS 0,200,800μg/mL和3200μg/ mL作用24 h,收集细胞进行线粒体膜电位和细胞周期分析,DSS 0,200,800μg/mL和3 200μg/mL作用72 h,收集细胞进行增殖试验。
1.3 ROS检测 取5×105个细胞,PBS洗涤2次,100μL PBS重悬细胞,加入DCFH-DA储存液,至其终浓度为5μmol/L,混匀后在37℃避光反应30min,PBS洗2次后流式细胞仪分析。
1.4 细胞凋亡分析 取5×105个细胞,用PBS洗涤2次,取195μL结合缓冲液重悬细胞,加入5μL FITC-标记Annexin-V,室温下避光反应30min;结合缓冲液洗涤细胞2次,400μL结合缓冲液重悬细胞,加入PI溶液5μL,5min后用流式细胞仪分析。
1.5 线粒体膜电位分析 取5×105个细胞,参考试剂盒说明书提供的方法,配制JC-1染色工作液和染色缓冲液(冰沐保存)。500μL JC-1染色工作液重悬细胞,37℃避光反应30min;离心后弃上清,染色缓冲液洗涤细胞2次;500μL染色缓冲液重悬细胞,流式细胞仪FL1通道(525 nm)检测细胞所发射的荧光。
1.6 细胞周期分析 预冷PBS洗细胞两次,之后用80%预冷乙醇固定细胞,-20℃保存过夜,上机检测前调细胞浓度为1×107个/mL,取100μL细胞悬液加入400μL含有0.01 g/LPI,20×106mol/L的RNase A和0.02%Triton-X100的PBS,室温闭光处理30min后,流式细胞术检测细胞周期,并采用SubG1法分析凋亡细胞百分率。
1.7 细胞增殖分析 接种细胞于96孔细胞培养板,加DSS至不同浓度(0,200,800μg/mL和3 200μg/ mL),每个处理因素设3个复孔。继续培养72 h,每孔加入WST-1溶液10μL,37℃培养2 h后,用酶联检测仪分析450 nm的吸光度值。用3次独立试验的数据,计算不同浓度DSS对ECV304细胞增殖的抑制率(IR)。
1.8 统计学分析 以3次试验的平均值±标准差来表示最终结果。组间均数的比较采用t检验,用SPSS15.0软件做统计分析,检验水准α=0.05。
2 结果
2.1 用DSS对血管内皮细胞ROS的影响 0,200, 400,800,1 600μg/mL和3 200μg/mLDSS处理细胞24 h,流式细胞术分析细胞内活性氧(图1),结果表明,细胞内ROS随浓度增加而降低(表1)。

图1 DSS对血管内皮细胞ROS的影响

表1 DSS对血管内皮细胞ROS的影响
2.2 DSS对血管内皮细胞凋亡的影响 PI和FITC-Annexin-V双染法分析细胞凋亡,图中左下,左上,右上和右下象限分别代表活细胞,坏死细胞,晚期凋亡和早期凋亡细胞(图2);凋亡细胞(含早期凋亡和晚期凋亡)百分率随浓度增加而增加(表1)。
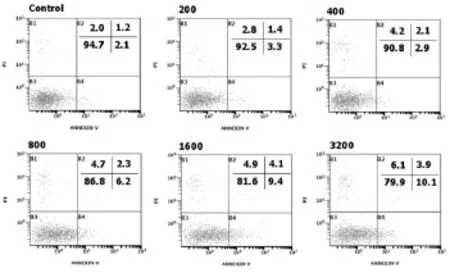
图2 DSS对血管内皮细胞凋亡的影响
2.3 DSS对血管内皮细胞线粒体膜电位的影响
JC-1是一种新型荧光探针,进入细胞后,其存在状态和发射荧光与线粒体功能紧密联系。线粒体功能正常时,JC-1主要聚集在线粒体基质,形成聚合物,发射红色荧光;而在MMP较低时,JC-1主要以单体形式存在,发射绿色荧光(图3);与对照组比较,JC-1单体的绿色荧光逐渐增加(图3),即DSS以浓度依赖的方式导致MMP下降。
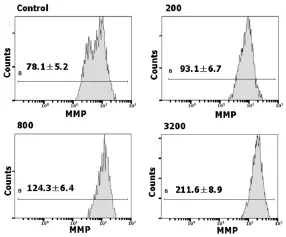
图3 DSS对血管内皮细胞线粒体膜电位的影响
2.4 DSS对血管内皮细胞周期增殖的影响 PI染色和流式细胞术分析细胞周期,与对照组比较,200,800μg/mL和3 200μg/mL的DSS导致G2/M期细胞减少,G0G1期细胞增加;凋亡细胞(SubG1期细胞)出现(图4)。

图4 DSS对血管内皮细胞周期的影响
2.5 DSS对血管内皮细胞增殖的影响 DSS处理细胞72 h,200,800μg/mL和3 200μg/mL DSS对血管内皮细胞的抑制作用随着浓度的增加而增加(见图5)。
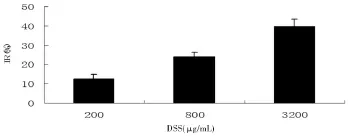
图5 DSS对血管内皮细胞增殖的抑制作用
3 讨论
癌症是导致人类死亡的主要原因之一,而约1/ 4癌症病例的病因和发病机制与感染和慢性炎症相关[5]。炎症性肠病(IBD)是一类病因和发病机制未明的肠道炎症性疾病,其发病率且呈逐年上升和年轻化趋势;IBD患者发生结直肠癌(colorectal cancer,CRC)的风险率增高[5-6]。葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱发的结肠炎相关性癌症(colitis associated cancer,CAC)动物模型由于成功地模拟IBD诱发CRC的全过程,被广泛用于研究IBD相关性CRC的癌变机理,阐明其病理变化与癌变原理有助于发现结直肠癌治疗新的候选靶点。
化学致炎剂DSS是一种人工合成的硫酸盐多糖,小鼠经饲喂含有DSS的饮水可以形成炎症性肠病模型(DSS模型)。其病理改变接近人类UC,往往出现以血便、肠道黏膜溃疡和粒细胞浸润为特征的结肠炎症。DSS的致炎机制尚未阐明,可能与DSS携带的负电荷影响DNA合成、抑制上皮细胞增生、破坏肠黏膜屏障、导致巨噬细胞功能障碍及肠道菌群失调有关[7-9]。近期研究表明,肠道局部血管内皮细胞和免疫细胞在IBD进程中具有重要作用,但尚无文献报道DSS对血管内皮细胞是否有损伤作用,以及影响血管内皮细胞的机制也未见报道。为此本研究以体外培养的血管内皮细胞为模型,用不同浓度的DSS处理细胞,分析细胞增殖、凋亡、活性氧和线粒体膜电位。研究发现,DSS可显著诱导内皮细胞凋亡、抑制其增殖,并导致细胞GOG1期阻滞,具有剂量依赖性。DSS对细胞内ROS产生有抑制作用,抑制效应随DSS浓度增大而增大。虽然高浓度的ROS本身是过氧化导致细胞损伤的重要因素,但ROS也是细胞正常生长期线粒体功能的重要产物,一定浓度的ROS是细胞内源的“生长因子”。本研究发现,DSS抑制ROS的同时,细胞线粒体膜电位也显著下降,线粒体膜功能受损,凋亡细胞增加,所以DSS可以通过抑制血管内皮细胞ROS产生和增殖诱导细胞凋亡。
[1]涂梦莹,宋丽君.炎症性肠病的诊断与治疗进展[J].实用儿科临床杂志,2012,27(7):552-556.
[2]林勇,张德纯.溃疡性结肠炎的微生态学研究现状与展望[J].中国微生态学杂志,2002,14(4):1199-1203.
[3]徐丽红,肖芳,兰小琴,等.葡聚糖硫酸钠诱导C57BL/6J小鼠急性结肠炎模型的建立与评价[J].医学研究生学报,2014,27(9):918-922.
[4]Punit S,DubéPE,Liu C Y,etal.Tumor Necrosis Factor Receptor 2 Restricts the Pathogenicity of CD8+TCells in Micewith Colitis[J]. Gastroenterology,2015,S0016-5085(15):00820-00823.
[5]何晓生,陈泽贤,兰平.炎症性肠病癌变研究进展[J].中国实用外科杂志,2013,33(7):604-606.
[6]陈曦,杨世忠.炎症性肠病动物模型的研究进展[J].中国老年学杂志,2007,13(27):1326-1328.
[7]常玉英,欧阳钦.微生态失衡与炎性肠病[J].国际消化病杂志,2008,28(1):34-36.
[8]Maloy K J,Powrie F.Intestinal homeostasis and its breakdown in inflammatory bowel disease[J].Nature,2011,474(7351):298-306.
[9]Maltby S,Wohlfarth C,Gold M,et al.CD34 is required for infi ltrationof eosinophils into the colon and pathology associatedwith DSS-induced ulcerative colitis[J].Am JPathol,2010,177:1244-1254.
Study on theM echanism of ECV304 Apoptosis Induced by DSS
ZHANGChen-hao,CHENWei,WANG Yue-hua,LIQiang,LIYan
(DepartmentofMedical laboratory,Jilin MedicalCollege,Jilin 132013,China)
The objective of this studywas to investigate the influence of DSSon proliferation and apoptosis in endothelial cells(ECV304).Different concentrations of DSSwere used to treat ECV304 cells in vitro.Apoptosis,reactive oxygen species(ROS),mitochondrial transmembrane potential(MMP)and cell cycle were analyzed by flow cytometry(FCM),and cellular proliferation in⁃hibition rate wasmeasured by WST-1.The results showed thatwith the rising concentration of DSS,apoptosis rate and the percent⁃ageof cellsofG0G1 increased,intracellular reactiveoxygen contentandmitochondrialmembrane potentialdecreased,and the prolif⁃eration inhibition rate was significantly increased.DSS can inhibit proliferation of ECV304 and induce apoptosis.
DSS;apoptosis;EndothelialCells
LIYan
R 363
A
0529-6005(2015)11-0039-03
2015-07-07
吉林省科技厅中青年科技创新领军人才及团队项目(20130521018JH);吉林省教育厅十二五"科学技术研究(吉科教合字[2012]第487号);吉林省卫生厅项目(2013Z09-1);吉林市科技计划项目(201133101)
张宸豪(1972-),男,副教授,博士,从事抗感染免疫的机制研究,E-mail:zhangchenhao0618@163.com
李妍,E-mail:liyan@jlmpc.cn

