外生菌根真菌Xerocomus chrysenteron产漆酶能力及其对外加DDT和重金属的响应
赵曦,黄艺,李娟
1. 深圳市环境科学研究院,广东 深圳 518001;2. 北京大学环境科学与工程学院,北京 100871
外生菌根真菌Xerocomus chrysenteron产漆酶能力及其对外加DDT和重金属的响应
赵曦1*,黄艺2,李娟1
1. 深圳市环境科学研究院,广东 深圳 518001;2. 北京大学环境科学与工程学院,北京 100871
为评价外生菌根真菌红绒盖牛肝菌(Xerocomus chrysenteron)在不同营养条件和污染条件下产漆酶的能力,采用改良的Kottke营养液培养法研究了不同碳氮比、DDT处理和重金属处理对X. chrysenteron漆酶活性的影响,探讨了不同处理对漆酶活性的影响机制。结果表明:(1)X. chrysenteron漆酶粗酶对底物ABTS的米氏常数Km值为0.038 mmol·L-1。在接种X. chrysenteron后,漆酶活性的峰值出现在菌丝生长的稳定期,静置培养63 d后漆酶活性可达118 U·L-1。在静置和振荡条件下,X. chrysenteron在改良的Kottke营养液中的最大产漆酶量均为157 U·L-1,振荡培养不能提高最大漆酶产量。高的碳氮比条件下(葡萄糖与(NH4)2HPO4质量浓度之比为20)可以获得较大的漆酶活性。(2)在培养的第54天,1 mg·L-1DDT和5 mg·L-1DDT处理的培养基中的漆酶活性相比对照分别提高了0.5倍和1倍,显示出DDT对产漆酶的诱导作用。(3)低浓度(1 mmol·L-1)的不同重金属对X. chrysenteron漆酶活性有不同的影响,在培养的第54天,Cu和Cd能够将漆酶活性分别提高2.6倍和0.3倍,Mn对漆酶活性没有明显的影响,Zn降低了漆酶活性,Hg则完全抑制了漆酶活性。高浓度的Cu(5 mmol·L-1)对漆酶活性的提高不明显,而高浓度的Cd(5 mmol·L-1)则降低了漆酶活性。重金属对X. chrysenteron漆酶活性的影响机制可能包括通过对漆酶基因的诱导或抑制,以及对菌丝生物量的影响,进而对漆酶活性产生影响。研究表明,高的碳氮比、适当质量浓度的DDT处理及低浓度的Cu、Cd处理均能促进X. chrysenteron产漆酶,显示出其在POPs和重金属复合污染环境下对POPs的降解潜力。
外生菌根真菌;Xerocomus chrysenteron;漆酶;DDT;重金属
外生菌根真菌(英文名ectomycorrhizal fungi,简称ECMF)具有降解持久性有机污染物(英文名persistent organic pollutants,简称POPs)的能力。据统计,在已经进行的外生菌根真菌降解POPs的研究中,45种菌种中有36种能降解至少一类POPs,有12种能降解多类POPs(赵曦等,2007)。DDT是一种有机氯农药,也是POPs的一种。本研究课题组分别于2007年和2013年首次报道了外生菌根真菌X.chrysenteron对DDT的降解作用(Huang等,2007)和矿化作用(Huang和Wang,2013)。
外生菌根真菌对DDT的这种降解和矿化作用可能与其产生的木质素降解酶密切相关。大量研究表明外生菌根真菌能产生一系列与白腐真菌木质素降解酶系统相似的酶,这些酶具有降解POPs的巨大潜力(Meharg和Cairney,2000)。在木质素降解酶系的三种酶中,漆酶的生成不需要严格的限碳和限氮条件且无需大量的 H2O2作为辅助剂,因此相比木质素过氧化物酶(LiP)和锰过氧化物酶(MnP)具有更实际的应用前景。一些研究者直接采用从白腐真菌提取的漆酶对土壤中的 DDT进行处理,得了较高的DDT降解率(Zhao等,2010;Fan等,2013),显示出真菌漆酶在POPs污染环境生物修复中的应用前景。
土壤环境的营养条件复杂,而且当前环境中的污染物也趋于多元化和复杂化,环境污染逐渐以由各种污染物构成的复合污染为主(郑振华,2001)。复合污染土壤的生物修复逐渐成为研究热点,有研究者报道了采用植物和微生物结合的方式,对DDT和 Cd复合污染土壤的生物修复研究(Zhu等,2012)。外生菌根真菌对重金属有较好的耐受性(张英伟等,2014),其在POPs和重金属复合污染环境下的产酶及对 POPs的降解效果研究具有现实意义。
本研究文通过实验设计,探讨 X. chrysenteron产漆酶的能力及不同碳氮比、DDT处理和重金属处理对X. chrysenteron漆酶活性的影响。
1 材料与方法
1.1 实验材料
1.1.1 供试菌种
实验所用菌种为红绒盖牛肝菌(Xerocomus chrysenteron),采自北京西山无污染的针阔混交林,由北京林业大学森林病理研究室雷增普教授提供。
1.1.2 液体培养
将改良的Kottke营养液(Kottke等,1987)pH调至5.5,加入250 mL三角瓶,1.4×105Pa下126 ℃高温灭菌20 min,冷却。在无菌操作环境下,分别接种供试菌种于液体培养基上,封口,在 25 ℃下培养,备用。
1.2 实验设计与处理
对照:制备改良Kottke液体培养基,每个250 mL三角瓶加入100 mL培养基,灭菌,冷却。接种3片9 mm直径的X. chrysenteron固体培养琼脂块。封口,在25 ℃无光静置培养。
振荡培养:除采用100 r·min-1转速振荡培养,其他同对照。
不同C质量浓度:以对照的10 g·L-1葡萄糖质量浓度为基准,设置葡萄糖质量浓度为5和20 g·L-1的处理。
不同 N质量浓度:以对照的 0.5 g·L-1(NH4)2HPO4质量浓度为基准,设置(NH4)2HPO4质量浓度为0.25和1 g·L-1的处理。
DDT处理:在接种后的第18天,加入DDT使质量浓度达到1.0和5.0 mg·L-1。
重金属处理:在接种后的第 18天,分别加入CuSO4、CdCl2、MnSO4、ZnSO4、HgI2使浓度达到1 mmol·L-1。另外加设Cu和Cd的高浓度处理,分别加入CuSO4、CdCl2使浓度达到5 mmol·L-1。
每个处理设4个重复。所有处理在接种18 d后,每3 d取样测定。
1.3 漆酶粗酶的提取方法
从培养有外生菌根真菌的三角瓶中取 500 µL培养液,用注射器配0.2 µm孔径的滤头过滤,制得漆酶粗酶液。置于1.5 mL V型离心管中,4 ℃以下冷藏待测。
1.4 测定方法
1.4.1 漆酶活性定量测定
以 ABTS (英 文 名 2, 2’-azino-bis (3-ethylbenzthiazoline-6-sulfonate) )为漆酶活性底物。3 mL的反应体系包括 0.5 mmol·L-1ABTS,100 mmol·L-1乙酸钠缓冲液(pH 5.0),和0.1 mL粗酶液。25 ℃下,通过加入粗酶液来启动反应。测A420下的吸光度的变化速率。1个单位(U)的酶活性定义为 25 ℃下每分钟氧化 1 µmol ABTS(ε=36 L·mmol-1·cm-1)所需酶量。
1.4.2 酶动力学参数测定
以 ABTS为漆酶活性底物,测定不同浓度ABTS下的酶反应速率。
1.4.3 菌丝干质量测定
对液体培养基用真空泵(SHB-III)直接抽滤。将菌丝体连同滤纸一起在105 ℃烘箱内灭菌1 h,再置于烘箱内80 ℃下烘干24 h,干燥器内冷却48 h,恒质量后用分析天平(AR1140)测量干质量。
1.4.4 剩余葡萄糖质量浓度测定
采用蒽酮比色法。
1.5 数据处理
均值和标准偏差计算采用 Microsoft Office Excel 2003软件。t检验采用SPSS13.0软件。产酶曲线拟合采用Origin 8.0软件,Logistic方程拟合,N=K/(1+exp(a-rt))。
2 结果与分析
2.1 X. chrysenteron产漆酶的特性
2.1.1 X. chrysenteron漆酶产粗酶的酶动力学特征
测定在不同浓度底物(ABTS)的反应体系中X. chrysenteron漆酶粗酶反应的初速度,并采用最小二乘法回归求解(图1)。结果显示,X. chrysenteron漆酶粗酶具有典型的酶动力学特征(v=20.24c/(0.038+c),r2=0.996),其米氏常数Km值为0.038 mmol·L-1。
Km值反映的是酶对底物亲和力的大小,Km值越小,酶对底物的亲和力越大,其催化反应的效率就越高。目前鲜见关于外生菌根真菌的漆酶酶动力学研究报道,而白腐真菌漆酶的相关文献较多,例如白腐真菌 Pycnoporus sanguineus、Pleurotus sajor-caju、Fomes fomentarius、Panus conchatus的漆酶降解ABTS的Km值依次为0.13、0.089、0.026和0.0057 mmol·L-1(Derek等,2007;Paolo等,2011;Mohamed和Atef,2010;张丽等,2013)。可见,X. chrysenteron漆酶粗酶对ABTS的亲和力与几种高产漆酶的白腐真菌相比,处于中等水平。
2.2.2 不同培养阶段X. chrysenteron产漆酶活性
对在静置的液体培养基中生长的 X.chrysenteron的菌丝干质量及其产生的漆酶进行连续测定(图2)。根据菌丝的生长曲线分析,在接种X. chrysenteron静置的液体培养基中,接种后的0~6 d为菌丝生长的调整期,6~18 d为菌丝生长的对数期,18 d之后为菌丝生长的稳定期。在 X. chrysenteron菌丝生长的调整期和对数期,培养基中只检测到少量的漆酶。而在菌丝生长进入稳定期后,漆酶活性逐渐呈现出对数增长趋势,并在第63天达到了118 U·L-1。
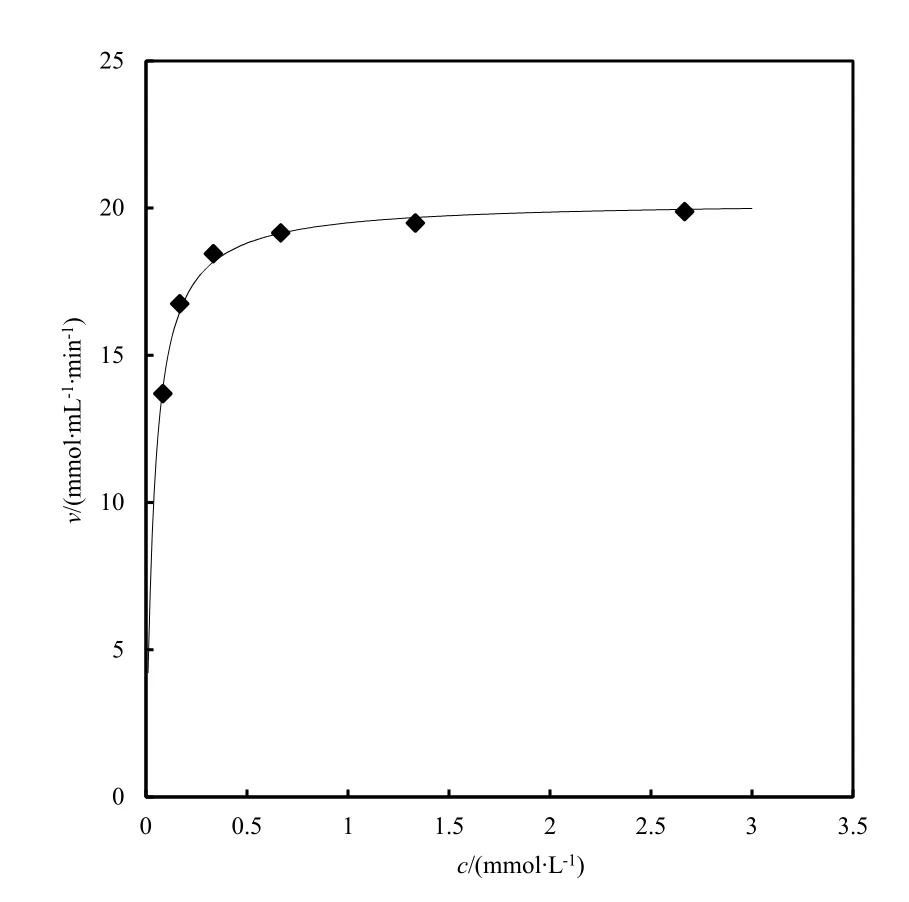
图1 X. chrysenteron漆酶粗酶氧化ABTS的米氏方程拟合曲线Fig. 1 Fitting curve of Michaelis-Menten equation for oxidation of ABTS by crude laccase from X. chrysenteron
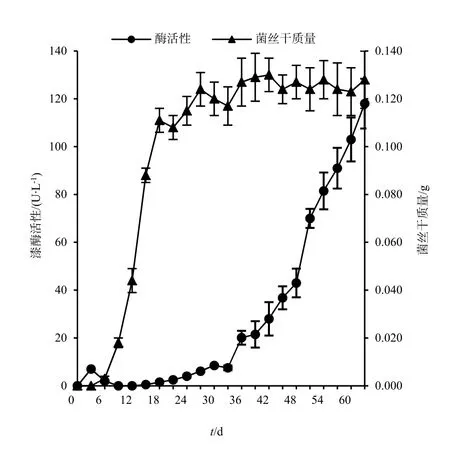
图2 X. chrysenteron在静置的Kottke培养基中的产酶时间线Fig. 2 Time course of laccase activity during the growth of X. chrysenteron in Kottke medium
与多种白腐真菌在接种的菌丝生长对数期即达到漆酶活性峰值相比(张丽等,2013;尚洁等,2013),X. chrysenteron漆酶活性在菌丝生长稳定期才达到很高的浓度,63 d之后可达118 U·L-1,产酶量与多种漆酶高产白腐真菌的漆酶产量相当。大量研究表明,不同的白腐真菌的菌种,由于其漆酶基因的差异,表达阶段差别较大,例如,白腐真菌Trametes sp.I62的漆酶基因有lcc1和lcc2两种,前者在菌丝生长的早期即可表达,而后者在菌丝生长的稳定期才能表达(Mansur等,1998)。X. chrysenteron的在菌丝生长稳定期表达的特征,应与其漆酶基因的类型密切相关。
2.2.3 正常培养下X. chrysenteron最大漆酶活性
振荡培养条件下的漆酶活性增长速度比静置条件下快,对静置和振荡条件下的产酶曲线进行非线性拟合(图 3),两个产酶曲线都较好地符合Logistic曲线L=K/(1+exp(a-rt)):
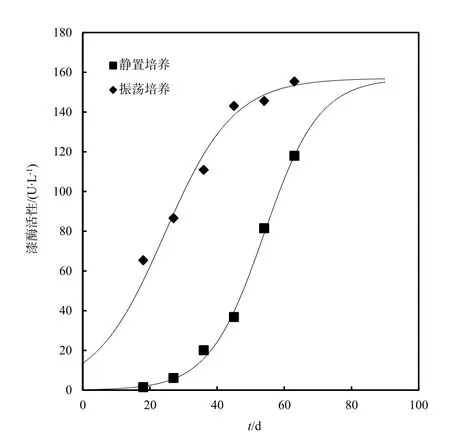
图3 X. chrysenteron在Kottke培养基中的产酶时间线Fig. 3 Time course of laccase activity during the growth of X. chrysenteron in Kottke medium

其中,K表示最大产酶量;a表示与初始产酶量有关的参数;r表示酶量瞬时增长率。
这个结果表明,培养体系中漆酶的积累模式符合 Logistic曲线,具有一个增长极限值,即最大产酶量。在静置和振荡条件下,X. chrysenteron在改良的Kottke营养液中的最大产漆酶量均为157 U·L-1。
2.3 不同碳、氮条件下X. chrysenteron漆酶产量
碳源和氮源的质量浓度和种类及其比值对漆酶活性影响较大,其中氮源起着关键作用(Eggert等,1996)。接种的第54天(表1),本研究中使用的正常 Kottle培养基的碳源葡萄糖质量浓度为 10 g·L-1,氮源(NH4)2HPO4质量浓度为0.5 g·L-1。当葡萄糖质量浓度降为5 g·L-1时,X. chrysenteron漆酶产量比正常Kottle培养基中的漆酶产量减少了74%(P<0.001);而当葡萄糖质量浓度增至20 g·L-1时,漆酶产量与正常Kottle培养基中的漆酶产量之间没有显著性差异(P=0.461)。当(NH4)2HPO4质量浓度降为 0.25 g·L-1时,漆酶产量没有明显变化(P=0.668);而当(NH4)2HPO4质量浓度增为 1 g·L-1时,漆酶产量比正常Kottle培养基中的漆酶产量减少了61%(P<0.001)。从C/N比来看,C/N比降低到10时,漆酶活性变小;而C/N比提高至40,漆酶活性并不能有效提高。限氮条件有利于提高漆酶活性。
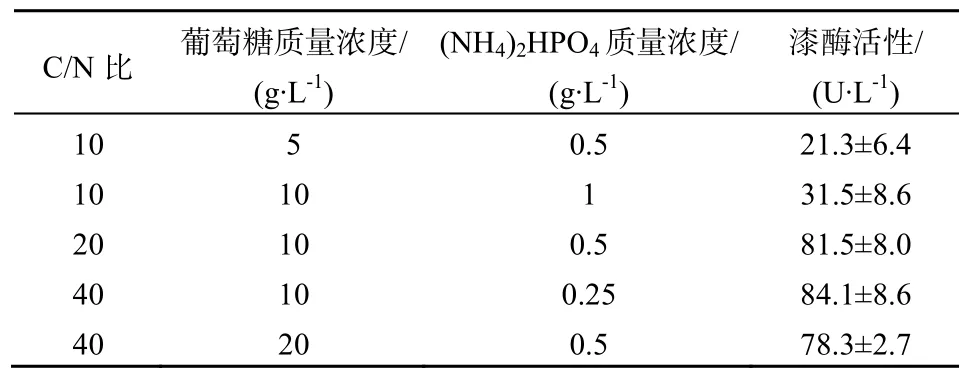
表1 接种54 d后不同C/N比下X. chrysenteron的漆酶活性Table1 Laccase activity in X. chrysenteron medium of various carbon/nitrogen ratios after 54 d of culture
2.4 DDT对X. chrysenteron产漆酶的影响
在本研究课题组报道的酶点试实验中,DDT增强了外生菌根真菌X. chrysenteron的漆酶活性(黄艺等,2006)。为了确证这一结果,添加DDT到接种X. chrysenteron 18 d后的液体培养基中,使DDT质量浓度达到1和5 mg·L-1。第45天后,添加DDT的培养液中漆酶活性显著增强。在第54天,1和5 mg·L-1DDT处理的培养基中的漆酶活性分别比对照提高了0.5倍(P=0.010)和1倍(P=0.005)(图4)。
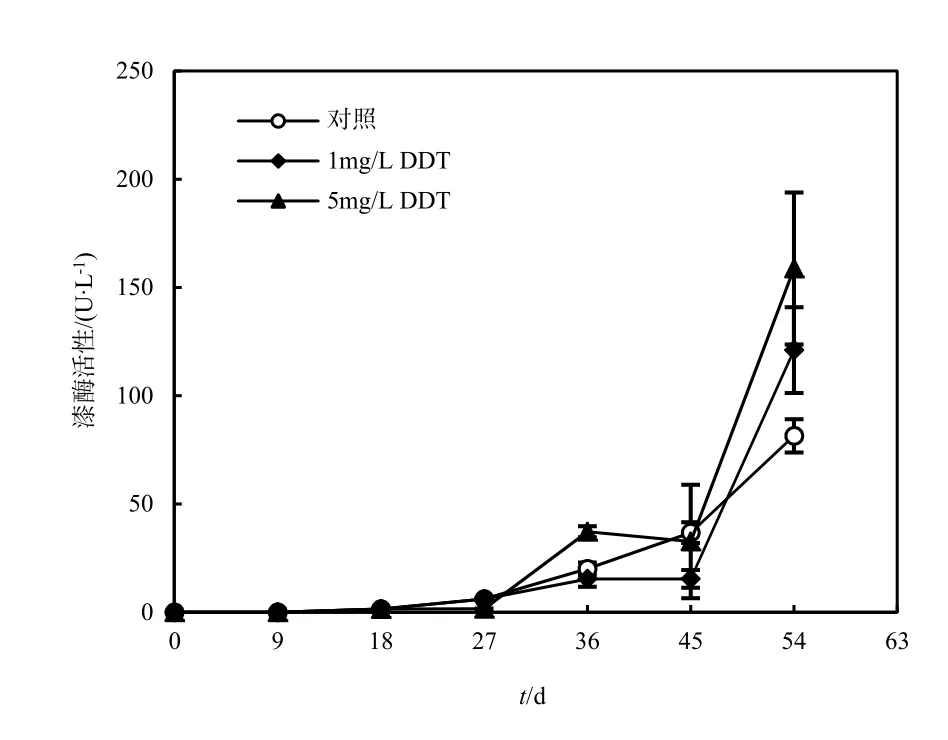
图4 X. chrysenteron在对照及添加1和5 mg·L-1DDT培养基中的产酶时间线Fig. 4 Time course of laccase activity during the growth of X. chrysenteron in unsupplemented medium and medium containing 1 and 5 mg·L-1DDT
2.5 重金属对X. chrysenteron产漆酶的影响
为了探讨重金属对漆酶的影响,本研究选择了Cd2+、Cu2+、Hg+、Mn2+、Zn2+等5种重金属离子作为添加物和潜在的漆酶诱导剂。图5显示了在各种重金属以 1 mmol·L-1浓度存在的情况下,X. chrysenteron产漆酶时间线。
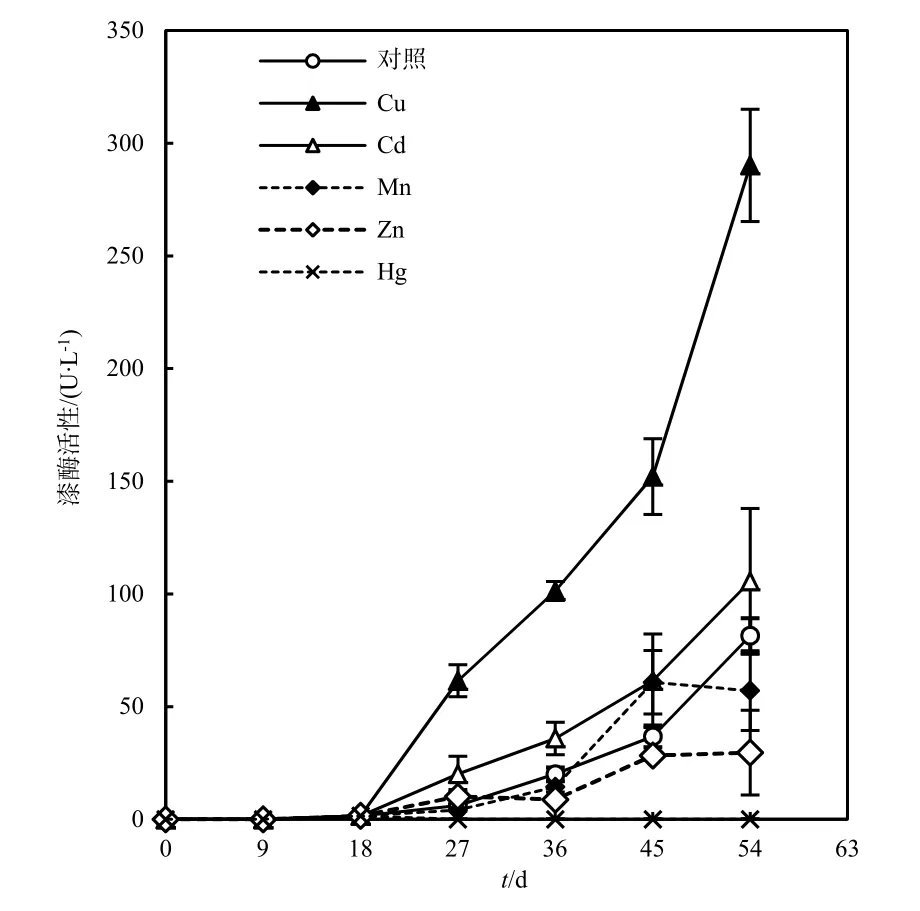
图5 X. chrysenteron在对照及添加1 mmol·L-1Cu、Cd、Mn、Zn和Hg培养基中的产酶时间线Fig. 5 Time course of laccase activity during the growth of X. chrysenteron in unsupplemented medium and medium containing 1 mmol·L-1Cu, Cd, Mn, Zn and Hg
Cu是本研究中最有效的漆酶诱导剂,在加入到培养基后很快就诱导了 X. chrysenteron漆酶的产生。Cu处理的培养基和对照(正常培养基中Cu的浓度为0.05 µmol·L-1)之间漆酶活性的差距随着时间推移而扩大。在第54天,Cu处理的培养基中漆酶活性比对照提高了2.6倍(P<0.001)。作为一种生物非必需元素,Cd也提高了X. chrysenteron胞外漆酶的产量。在第54天,Cd处理的培养基中漆酶活性比对照提高了0.3倍(P=0.197)。与Cu和Cd的诱导效果相反,其他3种重金属都抑制了漆酶的产量。Mn(P=0.045)和 Zn(P=0.002)降低了漆酶的活性,而在 Hg的处理下漆酶活性完全消失(P<0.001)。
重金属对酶的作用与其浓度有很大关系。考虑到在1 mmol·L-1浓度的Mn,Zn和Hg的处理下,漆酶活性已经受到抑制,因此只对Cu和Cd设计5 mmol·L-1的高浓度处理,并做进一步研究。两种浓度的Cu处理都提高了漆酶活性。不过,高浓度的Cu(5 mmol·L-1)对漆酶活性的提高不明显(P=0.430),而高浓度的Cd(5 mmol·L-1)则降低了漆酶活性(P=0.032)(表2)。
值得注意的是,在5 mmol·L-1Cu和Cd处理下,X. chrysenteron的生长受到了抑制,生物量分别下降了32%和24%。这表明,重金属离子可以直接抑制或增强X. chrysenteron的产漆酶能力,也可以通过抑制菌丝生物量来间接降低漆酶活性。在本研究中,菌丝生物干质量和葡萄糖剩余量的结果显示 5 mmol·L-1的Cu以及Cd、1 mmol·L-1的Zn和Hg都抑制了菌丝的生长(表2)。
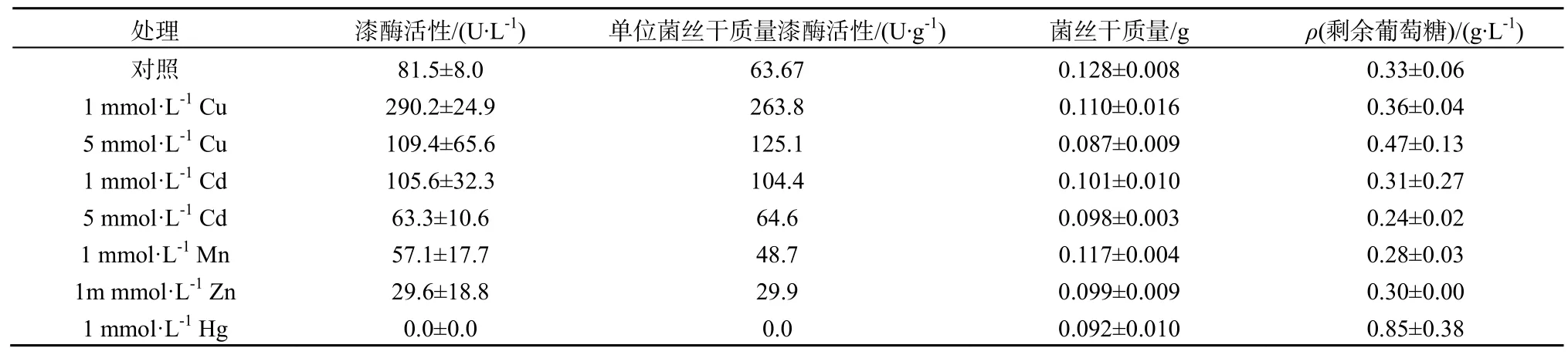
处理 漆酶活性/(U·L-1) 单位菌丝干质量漆酶活性/(U·g-1) 菌丝干质量/g ρ(剩余葡萄糖)/(g·L-1)对照 81.5±8.0 63.67 0.128±0.008 0.33±0.06 1 mmol·L-1Cu 290.2±24.9 263.8 0.110±0.016 0.36±0.04 5 mmol·L-1Cu 109.4±65.6 125.1 0.087±0.009 0.47±0.13 1 mmol·L-1Cd 105.6±32.3 104.4 0.101±0.010 0.31±0.27 5 mmol·L-1Cd 63.3±10.6 64.6 0.098±0.003 0.24±0.02 1 mmol·L-1Mn 57.1±17.7 48.7 0.117±0.004 0.28±0.03 1m mmol·L-1Zn 29.6±18.8 29.9 0.099±0.009 0.30±0.00 1 mmol·L-1Hg 0.0±0.0 0.0 0.092±0.010 0.85±0.38
3 讨论
X. chrysenteron是一种外生菌根担子菌(Triguerosa等,2003)。County等(2006)发现在法国的一个自然林土壤环境下,X. chrysenteron在多个外生菌根真菌菌种中表现出了最强的漆酶活性。Luis等(2005)认为X. chrysenteron具有典型的漆酶基因,并用该菌种的漆酶基因来对德国巴伐利亚北部的针阔混交林中的土壤样品提取出的漆酶转录序列进行归类。本研究的结果验证了 X. chrysenteron产漆酶的能力,并且该菌的漆酶基因可能主要在菌丝生长的稳定期表达。在改良的Kottke营养液中,培养 63 d后产漆酶量可达 118 U·L-1,与多种漆酶高产白腐真菌产漆酶水平相当(Derek等,2007;Paolo等,2011;Mohamed和Atef,2010;张丽等,2013;尚洁等,2013)。正是由于X. chrysenteron的这种较强产漆酶能力,本研究课题组选择该菌种作为外生菌根真菌降解 DDT和产漆酶研究的模式菌种。
一般认为,对产漆酶真菌采用振荡培养方式可以获得较高的漆酶活性,因为振荡培养提高了营养物和氧气在细胞间的传质效率(高大文等,2005)。本研究中静置培养和振荡培养的最大产酶量一致,振荡培养只是缩短了菌丝生长的对数期,使其提前进入了生长稳定期并大量产酶,但并没有最终提高其产漆酶的能力。这一点与其他学者的结论一致,Collins和 Dobson(1997)的研究表明,氧气量的增加既不能促进真菌漆酶mRNA的转录,也不能提高真菌产漆酶的能力。
碳、氮的含量和种类及碳氮比对真菌漆酶产量起着关键作用。在白腐真菌中,漆酶的生成主要通过营养限制(主要是限N)来启动。本研究中,无论C含量和N含量如何变化,C/N比(葡萄糖质量浓度/(NH4)2HPO4质量浓度)都是影响漆酶产量的最主要因素。Kottke正常培养基的C/N比为20,此条件下即可获得较高的漆酶活性。相比无机氮,有机氮能够因其能提高生物量而进一步提高漆酶活性(Arora和 Rampal,2002)。本研究中使用的氮源(NH4)2HPO4为无机氮,若更换为有机氮源,也许能进一步激发X. chrysenteron的产漆酶和降解DDT的能力。
本研究证实了 DDT能够刺激外生菌根真菌的漆酶合成。Ritch和Gold(1992)、Soden和Dobson(2001)和 Xiao等(2006)分别在白腐真菌 P. chrysosporium、P. sajor-caju和Trametes sp. AH28-2的漆酶基因lac的启动子中均发现了异生化合物结合序列(英文名xenobiotic responsive elements,简称XREs),该XREs编码的结合蛋白能够和许多异生芳环化合物结合(Fujisawa-Sehara等,1987)。鉴于外生菌根真菌漆酶基因和白腐真菌漆酶基因的同源性(Chen等,2003),可以推测,外生菌根真菌漆酶基因可能含有相似的XREs,而DDT作为一种异生芳环化合物,可能在基因水平上影响了外生菌根真菌的漆酶生成。
一些重金属能在基因转录水平上提高真菌漆酶的产量,其中Cu是已经被大量文献广泛确认的真菌产漆酶诱导剂(Alessandra等,2011;Galhaup和 Haltrich,2001)。在本研究中,Cu提高了 X. chrysenteron漆酶的产量,不过提高的幅度(2.6倍)与一些文献报道的幅度(增加1~3个数量级)尚显偏低(Alessandra等,2011),可能与本研究选择的Cu浓度有关。这些文献采用的 Cu浓度在 0.15~1 mmol·L-1之间,而本研究采用的是1 mmol·L-1。虽然 Cu是漆酶合成的必需元素,但是高浓度的 Cu能够抑制菌丝的生长。在本研究培养的后期,5 mmol·L-1Cu 处理中菌丝的干质量只有(0.087±0.009) g,甚至比1 mmol·L-1Hg处理中菌丝的干质量(0.092±0.010) g还低。这表明在高浓度Cu处理下,X. chrysenteron的生长受到了严重的抑制。另外,高浓度的Cu也有可能抑制了漆酶基因的转录和表达。诱导 X. chrysenteron产漆酶的最佳 Cu浓度可能应低于1 mmol·L-1。
有研究表明,低浓度的Cd能促进白腐真菌的漆酶活性(Baldrian和Gabriel,2002)以及外生菌根真菌 Paxillus involutus漆酶基因的转录水平(Jacob等,2004)。在本研究中,低浓度的Cd提高了X. chrysenteron漆酶的产量,而高浓度的Cd降低了X. chrysenteron的漆酶产量,不过对菌丝的生长却没有太大的影响(5 mmol·L-1处理中菌丝干质量(0.098±0.003) g;1 mmol·L-1处理中菌丝干质量(0.101±0.010) g。这个结果表明,在5 mmol·L-1Cd处理下X. chrysenteron漆酶产量的下降主要原因可能是Cd对漆酶转录的抑制而不是菌丝生长的抑制。Jacob等(2004)的研究也表明,外生菌根真菌 P. involutus漆酶RNA的合成在0.05 ppm Cd处理下显著提高,而在5 ppm Cd处理下受到抑制。因此,高浓度的Cu和Cd对X. chrysenteron漆酶的产量影响机理有所不同,高浓度的Cu主要通过抑制菌丝生长来影响漆酶产量,而高浓度的Cd则主要通过抑制漆酶mRNA的转录来影响漆酶产量。
Mn也被认为能够诱导真菌产漆酶,Scheel等(2000)发现0.133 mmol·L-1的Mn提高了3种白腐真菌漆酶基因的转录水平,Soden和Dobson(2001)也发现Mn可以诱导真菌P. sajor caju、Clitocybula dusenii和Nematoloma frowardii产漆酶。不过本研究中1 mmol·L-1的Mn处理对X. chrysenteron漆酶的产量没有明显的影响,可能与Mn对漆酶的诱导作用具有菌种差异性有关,也可能与Mn浓度偏高有关。Manubens等(2007)的研究表明0.16~0.194 mmol·L-1的Mn可以抑制真菌C. subvermispora产漆酶。
Collins和 Dobson(1997)的研究表明0.0004~0.2 mmol·L-1的Zn对漆酶基因转录没有影响(Collins和Dobson,1997)。本研究中,1 mmol·L-1的Zn在没有诱导作用的前提下,由于抑制了菌的生长,而降低了菌的漆酶产量。
4 结论
(1)外生菌根真菌X. Chrysenteron具有很强的产漆酶能力,且 DDT对其产漆酶具有诱导作用。目前已经有许多研究采用白腐真菌漆酶降解土壤DDT(Zhao等,2010;Fan等,2013),菌根真菌X. Chrysenteron及其漆酶在DDT污染土壤的修复中具有实际应用潜力。
(2)在低浓度的Cu2+和Cd2+等重金属离子的处理下,X. Chrysenteron的产漆酶能力有所提高,显示出其在 POPs和重金属复合污染环境下对 POPs的降解潜力。
(3)碳源和氮源的选择及 C/N 比对 X. Chrysenteron 的产漆酶能力影响很大,X. Chrysenteron的产漆酶能力在合适的营养条件下,应还有较大的提升空间。
DDT和重金属复合处理对X. Chrysenteron漆酶活性的影响,以及复合污染环境下 X. Chrysenteron对DDT的降解效果,尚需通过进一步研究探讨。
ALESSANDRA P, PAOLA G, VINCENZO L, et al. 2011. Induction and transcriptional regulation of laccases in fungi[J]. Current Genomics, 12: 104-112.
ARORA D S, RAMPAL P. 2002. Laccase production by some Phlebia species[J]. J Basic Microbiol, 42: 295-301.
BALDRIAN P, GABRIEL J. 2002. Copper and cadmium increase laccase activity in Pleurotus ostreatus[J]. FEMS Microbiol Lett, 206: 69-74.
CHEN D M, BASTIAS B A, TAYLOR A F S, et al. 2003. Identification of laccase-like genes in ectomycorrhizal basidiomycetes and transcriptional regulation by nitrogen in Piloderma byssinum[J]. New Phytologist, 157: 547-554.
COLLINS P J, DOBSON A D W. 1997. Regulation of laccase gene transcription in Trametes versicolor[J]. Applied and Environmental Microbiology, 63(9): 3444-3450.
COURTY P, POUYSEGUR R, BUEE M, et al. 2006. Laccase and phosphatase activities of the dominant ectomycorrhizal types in a lowland oak forest[J]. Soil Biology and Biochemistry, 38: 1219-1222.
DEREK L, MARIELLE JV, ANDRE T. 2007. Purification and kinetics of a thermostable laccase from Pycnoporus sanguineus (SCC 108) [J]. Enzyme and Microbial Technology, 40(4): 563-568.
EGGERT C, TEMP U, ERIKSSON KEL. 1996. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl Environ Microbiol, 62: 1151-1158.
FAN B, ZHAO Y C, MO G H, et al. 2013. Co-remediation of DDT-contaminated soil using white rot fungi and laccase extract from white rot fungi[J]. J Soils Sediments, 13: 1232-1245.
FUJISAWA-SEHARA A, SOGAWA K, YAMANE M, et al. 1987. Characterization of xenobiotic responsive elements upstream from the drugmetabolizing cytochrome P-450c gene: similarity to glucocorticoid regulatory elements[J]. Nucleic Acids Res, 15: 4179-4191.
GALHAUP C, HALTRICH D. 2001.Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J]. Appl Microbiol Biotechnol, 56: 225-232.
HUANG Y, WANG J. 2013. Degradation and mineralization of DDT by the ectomycorrhizal fungi Xerocomus chrysenteron[J]. Chemosphere, 92: 760-764.
HUANG Y, ZHAO X, LUAN SJ. 2007. Uptake and Biodegradation of DDT by 4 Ectomycorrhizal Fungi[J]. Science of the Total Environment, 385: 235-241.
JACOB C, COURBOT M, MARTIN F, et al. 2004. Transcriptomic responses to cadmium in the ectomycorrhizal fungus Paxillus involutus[J]. FEBS Lett, 576: 423-427.
KOTTKE I, GUTTENBERGER M, HAMMPP R, et al. 1987. An in vitromethod for establishing mycorrhizae on coniferous tree seedlings[J]. Trees, 1: 191-194.
LUIS P, KELLNERA H, MARTINB F, et al. 2005. A molecular method to evaluate basidiomycete laccase gene expression in forest soils[J]. Geoderma, 128: 18-27.
MANSUR M, SUA´REZ T, GONZA´LEZ AE. 1998. Differential gene expression in the laccase gene family from basidiomycete I-62 (CECT 20197)[J]. Appl Environ Microbiol, 64: 771-774.
MANUBENS A, CANESSA P, FOLCH C, et al. 2007. Manganese affects the production of laccase in the basidiomycete Ceriporiopsis subvermispora[J]. FEMS Microbiol Lett, 275: 139-145.
MEHARG A A, CAIRNEY J W G. 2000. Ectomycorrhizas-extending the capabilities of rhizosphere remediation?[J]. Soil Biol Biochem, 32: 1475-1484.
MOHAMED N, ATEF J. 2010. Purification, characterization and decolourization ability of Fomes fomentarius laccase produced in solid medium[J]. Journal of Molecular Catalysis B: Enzymatic, 64(1-2): 68-74.
PAOLO Z, ANTONIO R. 2011. Induction, purification and characterization of a laccase isozyme from Pleurotus sajorcaju and the potential in decolorization of textile dyes[J]. Journal of Molecular Catalysis B: Enzymatic, 68(2): 216-222.
RITCH T G J, GOLD M H. 1992. Characterization of a highly expressed lignin peroxidase-encoding gene from the basidiomycete Phanerochaete chrysosporium[J]. Gene, 118: 73-80.
SCHEEL T, HÖFER M, LUDWIG S, et al. 2000. Differential expression of manganese peroxidase and laccase in white-rot fungi in the presence ofmanganese or aromatic compounds[J]. Appl Microbiol Biotechnol, 54: 686-691.
SODEN DM, DOBSON AD. 2001. Differential regulation of laccase gene expression in Pleurotus sajor-caju[J]. Microbiology, 147: 1755-1763.
TRIGUEROSA V, LOUGARREA A, ALI-AHMEDA D, et al. 2003. Xerocomus chrysenteron lectin: identification of a new pesticidal protein[J]. Biochimica et Biophysica Acta, 1621: 292-298.
XIAO Y Z, HONG Y Z, LI J F, et al. 2006. Cloning of novel laccase isozyme genes from Trametes sp. AH28-2 and analyses of their differential expression[J]. Appl Microbiol Biotechnol, 71: 493-501.
ZHAO Y C, YI X Y, ZHANG M, et al. 2010. Fundamental study of degradation of dichlorodiphenyltrichloroethane in soil by laccase from white rot fungi[J]. Int J Environ Sci Tech, 7(2): 359-366.
ZHU Z Q, YANG X, WANG K, et al. 2012. Bioremediation of Cd-DDT co-contaminated soil using the Cd-hyperaccumulator Sedum alfredii and DDT-degrading microbes. Journal of Hazardous Materials, 235-236: 144-151.
高大文, 文湘华, 钱易. 2005. 白腐真菌培养条件对其分泌木质素降解酶的影响[J]. 中国环境科学, 25(5): 572-575.
黄艺, 赵曦, 敖小兰. 2006. 4种外生菌根真菌对滴滴涕的耐受性及生理响应[J]. 环境科学研究, 19(4): 36-41.
尚洁, 吴秋霞, 练小龙, 等. 2013. 碳源和氮源对木蹄层孔菌产漆酶的影响及酶学性质研究[J]. 中国生物工程杂志, 33(11): 32-37.
张丽, 付时雨, 傅恺, 等. 2013. 白腐菌Panus conchatus产漆酶的诱导、纯化及酶学特性研究[J]. 造纸科学与技术, 32(2): 24-36.
张英伟, 柴立伟, 王东伟, 等. 2014. Cu和Cd胁迫下接种外生菌根真菌对油松根际耐热蛋白固持重金属能力的影响[J]. 环境科学, 35(3): 1169-1175.
赵曦, 黄艺, 敖小兰. 2007. 持久性有机污染物(POPs)的生物降解与外生菌根真菌对 POPs的降解作用[J]. 应用与环境生物学报, 13(1): 140-144.
郑振华, 周培疆, 吴振斌. 2001. 复合污染研究的新进展[J]. 应用生态学报, 12(3): 469-473.
Efficiency of Laccase Secretion by the Ectomycorrhizal Fungus Xerocomus chrysenteron and Its Responses to the Addition of DDT and Heavy Metals
ZHAO Xi1, HUANG Yi2, LI Juan1
1. Shenzhen Academy of Environmental Sciences, Shenzhen 518001, China; 2. College of Environmental Science and Engineering, Peking University, Beijing 100871, China
The efficiency of laccase secretion by the ectomycorrhizal fungus Xerocomus chrysenteron and its responses to medium carbon: nitrogen ratio and the addition of DDT and heavy metals were studied in the modified Kottke medium. Additionally, the mechanisms underlying the observed responses were explored. Laccase secreted by X. chrysenteron showed high affinity for degrading 2,2'-azino-bis(3-ethylthiazoline-6-sulfonic acid) (ABTS) with a half saturation constant (Km) of 0.038 mmol·L-1. Laccase activity was found to be highest at the stationary phase and reached 118 U·L-1after 63 d of culture. The maximum laccase activity could reach 157 U·L-1in both the static culture and the shaking culture. Elevating medium carbon: nitrogen ratio to 20 led to higher laccase activity. Adding 1 mg·L-1and 5 mg·L-1of DDT increased the laccase production by 0.5 and 1 fold after 63 d of culture, respectively. Adding 1 mmol·L-1of different heavy metals showed differential effects on laccase production. Cu and Cd increased the laccase production by 2.6 and 0.3 fold after 63 d of culture, respectively; Zn and Hg inhibited the laccase production; Mn showed no significant effects. Adding 5 mmol·L-1of Cu had no significant effects on the laccase production, while 5 mmol·L-1of Cd decreased the laccase production. These effects of heavy metals may be explained by laccase induction (or inhibition) and decreases in mycelium production caused by the metals. This study demonstrated that high carbon: nitrogen ratio and the addition of suitable concentrations of DDT, Cu and Cd could promote the laccase production by X. chrysenteron, suggesting the potential application of this fungus for degrading POPs in multiple-contaminant environment.
ectomycorrhizal fungi; Xerocomus chrysenteron; laccase; DDT; heavy metals
10.16258/j.cnki.1674-5906.2015.02.023
X171.5
A
1674-5906(2015)02-0329-07
赵曦,黄艺,李娟. 外生菌根真菌Xerocomus chrysenteron产漆酶能力及其对外加DDT和重金属的响应[J]. 生态环境学报, 2015, 24(2): 329-335.
ZHAO Xi, HUANG Yi, LI Juan. Efficiency of Laccase Secretion by the Ectomycorrhizal Fungus Xerocomus chrysenteron and Its Responses to the Addition of DDT and Heavy Metals [J]. Ecology and Environmental Sciences, 2015, 24(2): 329-335.
国家自然科学基金项目(41271325)
赵曦(1982年生),男,工程师,主要从事重金属和持久性有机污染物的环境影响与污染防治研究。E-mail: zhaoxi5257@sina.com
2015-01-14

