烟草体内外拮抗细菌协同控制根黑腐病及诱导寄主抗性试验
易 龙,马冠华
1.赣南师范学院生命与环境科学学院,江西省赣州市开发区 341000
2.西南大学植物生态病理研究所,重庆市北碚区天生路1号 400716
烟草体内外拮抗细菌协同控制根黑腐病及诱导寄主抗性试验
易 龙1,2,马冠华2
1.赣南师范学院生命与环境科学学院,江西省赣州市开发区 341000
2.西南大学植物生态病理研究所,重庆市北碚区天生路1号 400716
烟草内生细菌T295和烟草土壤根际细菌R27均能有效抑制烟草根黑腐病,为探索烟草体内外拮抗细菌协同作用于烟株的防病效果及控病机理,测定了菌株T295和R27协同作用对烟草根黑腐病的防效和对菌丝、孢子的抑制作用,以及对烟草体内苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)和超氧化物歧化酶(SOD)等相关防御酶活性的影响。结果表明:内生细菌T295和土壤根际细菌R27协同作用于烟草能明显提高对烟草根黑腐病的控制效果,其无菌发酵液混合处理可以明显提高病原菌菌丝生长的抑制效果,但对孢子萌发抑制作用不明显。经内生细菌T295处理后的烟草,其体内5种酶活性高于R27处理,但混合菌液与T295处理的烟草酶活性变化差异不显著,内生细菌T295和土壤根际细菌R27两者诱导抗性未表现出累加效应,表明混合菌液处理的烟株诱导抗性主要与内生细菌T295能提高烟草中相关防御酶活性有关。
烟草;拮抗细菌;根黑腐病;协同控病;诱导抗性
烟草根黑腐病是由基生根串珠霉菌(Thielaviopsis basicola)引起的烟草根部真菌性病害,在烟草生长期内均可发病,尤以烟草还苗期至现蕾期发病较重。自20世纪70年代以来,随着我国烟区的扩大,病害逐渐蔓延[1],且在各产烟区均有发生,其中以云南、贵州、湖北等地发生严重,近年来此病害在山东、河南、安徽、吉林和福建等地有逐年加重趋势。烟草是叶用经济作物,在生产中主要通过化学农药对烟草根黑腐病进行防治[2],由此引起的农药残留等一系列问题降低了烟叶品质并影响了卷烟安全性。生物防治是烟草生产上有害生物综合治理的发展方向,作者在前期烟草根黑腐病的防治研究中,从烟草茎秆内部筛选获得了对烟草根黑腐病菌具有较好抑制效果和控病作用、并能在烟草植株体内定殖的内生枯草芽孢杆菌T295菌株[3]。来自烟草体外的菌株R27分离自烟草根际土壤,为枯草芽孢杆菌,能抑制烟草根黑腐病菌菌丝生长[4]。但烟草体内外拮抗细菌协同作用于烟株的防治病害研究尚未见报道。因此,将内生细菌T295菌株和土壤根际细菌R27菌株协同作用于烟草,测定其对烟草根黑腐病的控制效果,并从抑菌能力、诱导抗病性等方面分析烟草体内外拮抗细菌协同作用对根黑腐病的控病机理,旨在为烟草根黑腐病的有效防治提供依据。
1 材料与方法
1.1 材料
供试品种K326种子由云南省烟草农业科学研究院提供,在室内培育至10~12片真叶。供试菌株烟草根黑腐病菌由西南大学植物生态病理研究所提供。烟草根黑腐病的拮抗内生细菌T295菌株[3]和烟草根际细菌 R27[4]由前期试验获得。对照药剂:70%“甲基托布津”可湿性粉剂(日本曹达株式会社)、50%“多菌灵”可湿性粉剂(四川国光农化有限公司)均为市售药品。
1.2 试验方法
1.2.1 拮抗菌的控病作用
(1)拮抗菌的准备:将活化的拮抗菌株T295和R27参照易龙等[3]的方法进行培养发酵。用无菌水将发酵液配制成浓度为6×108cfu·mL-1的悬浮液,以单独的拮抗细菌T295和R27菌液分别处理,协同控病试验以T295和R27菌株用6×108cfu·mL-1悬浮液按1∶1(体积比)比例配制混合菌液。在5 mL发酵液中加无菌水10 mL稀释后灌根处理烟苗,每处理15株,重复4次,设70%“甲基托布津”可湿性粉剂、50%“多菌灵”可湿性粉剂1 000倍液为药剂对照,以未接菌的液体培养基处理为对照(CK),24 h后灌根接种烟草根黑腐病菌。
(2)灌根接种:将在PDA平板上培养9 d的烟草根黑腐病菌用无菌水洗脱孢子,调至浓度为2×105个/mL。取2 mL孢子悬浮液对烟株进行灌根接种,温度为25~26℃,接种15 d后根据标准方法[5]调查发病严重度。
1.2.2 拮抗菌发酵液的抑菌作用
参照易龙等[3]的方法制备拮抗菌T295和R27无菌发酵液。设置T295无菌发酵液、R27无菌发酵液以及T295和R27两者按1∶1混合的无菌发酵液3种处理。
(1)菌丝生长的测定:采用菌落直径法[6],将5 mm大小的病菌菌块置于上述3种无菌发酵液终浓度为10%的PDA平板中央,以未接菌的液体培养基过滤液按比例制成的平板为对照,设3次重复。26°C培养3、6和9 d后,测量各处理菌落直径,并计算抑菌率。
(2)孢子萌发的测定:将3种无菌发酵液20%的稀释液按1∶1(体积比)与浓度为2×105个/mL病菌孢子悬浮液混合,使无菌发酵液终浓度为10%,以未接菌的液体培养基过滤液以相同比例处理为对照,重复3次。26°C下培养,每隔1 h镜检1次,于培养6、12和24 h时统计孢子萌发数,以芽管长度超过孢子直径的一半为萌发标准,并计算孢子萌发抑制率。
1.2.3 酶活性的诱导
烟草灌根喷施3种菌液(1.2.1节中配制),以未接菌的液体培养基处理为对照,分别于1、3、5、7、9和11 d后采集处理及对照烟叶0.5 g,冷冻保存(-80℃),用于酶活性的测定。参考李合生[7]的方法测定苯丙氨酸解氨酶(PAL)活性;参考陈利锋等[8]的方法测定过氧化氢酶(CAT)活性;采用愈创木酚法测定过氧化物酶(POD)活性[9];采用邻苯二酚法测定多酚氧化酶(PPO)活性[9];采用NBT光还原法测定超氧化物歧化酶(SOD)活性[8]。酶活性测定试验均重复3次。
采用SPSS软件Duncan新复极差法进行试验数据的统计分析。
2 结果与分析
2.1 拮抗菌对烟草根黑腐病的控病作用
表1表明:拮抗菌T295和R27混合处理的烟苗发病率和发病严重度均低于对照和药剂对照,经T295和R27混合菌液处理的防治效果达85.4%。对照烟苗地上部分出现萎蔫症状,生长不良,拔出根部发现植株根系出现黑色,表现出烟草根黑腐病症状(图1)。经T295和R27混合菌液处理的烟苗地上部分未出现萎蔫症状,根系正常。病情指数统计结果表明,经混合菌液处理的烟株与单一菌株T295、R27以及对照处理相比,差异达到显著水平,说明混合菌液对烟草根黑腐病的防效优于单一菌株T295和R27菌液的效果。
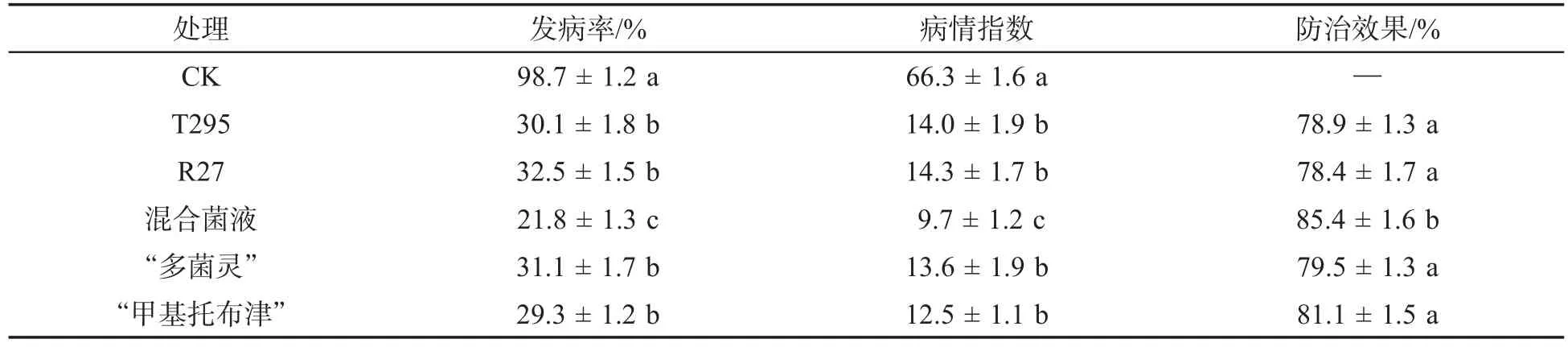
表1 拮抗菌对烟草根黑腐病的控病效果①

图1 拮抗菌协同对烟草根黑腐病的防治效果
2.2 拮抗菌无菌发酵液对烟草根黑腐病菌的抑制作用
2.2.1 对根黑腐病菌菌丝生长的影响
由表2可见,试验中3种无菌发酵液在终浓度10%条件下能有效地抑制病菌菌丝生长,在处理9 d后依然具有抑制能力,其中混合无菌发酵液对烟草根黑腐病菌的抑制效果明显优于单一菌液,表明T295和R27菌株无菌发酵液混合使用后存在明显的增效效应,增强了对病菌菌丝生长的抑制能力。
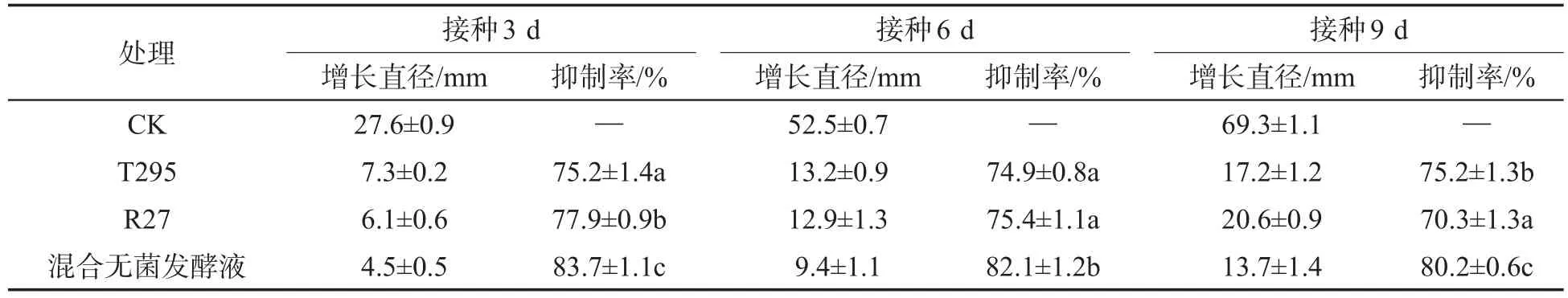
表2 拮抗菌无菌发酵液对烟草根黑腐病菌菌丝生长的抑制效果
2.2.2 对根黑腐病菌孢子萌发的影响
图2表明:拮抗菌T295、R27及其混合无菌发酵液在终浓度10%条件下对病菌孢子萌发均表现出抑制作用。试验中观察发现,在培养6 h前对烟草根黑腐病菌孢子萌发抑制效果较好,培养12 h后有大量的病菌孢子萌发,但萌发的孢子生长的菌丝扭曲、前端膨大、呈畸形,不能正常生长发育。
由表3可见,拮抗菌T295和R27混合无菌发酵液对烟草根黑腐病菌孢子萌发的抑制效果与单独使用无菌发酵液的处理无明显差异,表明混合无菌发酵液未能增强对病菌孢子萌发的抑制作用。
2.3 拮抗菌对烟草酶活性的诱导作用
经拮抗内生细菌T295、土壤根际细菌R27及其混合菌液处理后,烟草体内PAL、POD、PPO、CAT和SOD活性变化,见图3。从图3可见,拮抗菌T295、R27及其混合菌液均能促使烟草体内PAL、POD、PPO、CAT和SOD酶活性发生变化。在接种病原菌后第3天酶活性变化达到最大,随着时间的推移逐渐降低,变化趋于平稳。混合菌液处理3 d后POD提高216.3%,PAL提高96%,PPO提高86.3%,CAT提高153.6%,SOD提高88.4%,均显著高于对照(P<0.05)。可见,以内生细菌T295处理后烟株体内酶活性提高幅度最大,说明其诱导作用最强,来自烟草根际细菌R27诱导酶活性变化较小,相对平稳,混合菌液处理产生的诱导抗性与单一使用内生细菌T295处理的效果无显著差异,但明显高于R27的诱导效果。

图2 拮抗菌混合无菌发酵液对烟草根黑腐病菌孢子萌发的抑制效果

表3 拮抗菌无菌发酵液对烟草根黑腐病菌孢子萌发的抑制作用

图3 不同处理烟草体内PAL、PPO、POD、CAT和SOD酶活性的变化
3 结论与讨论
烟草根黑腐病菌主要通过菌丝在寄主体内生长和扩展导致植株发病[1]。在本试验中,拮抗菌T295和R27无菌发酵液及其混合无菌发酵液对烟草根黑腐病菌的菌丝生长均有较好的抑制作用,混合无菌发酵液的抑制效果显著高于T295和R27单独处理,说明T295和R27无菌发酵液混合后存在明显的增效作用,增强了对病原菌的抑制能力,其作用机理是否与化学药剂复配剂的增效机理相同还有待进一步试验。虽然对孢子萌发的影响并未像抑制菌丝生长那样表现出明显的协同增效作用,但试验中观察到经无菌发酵液处理后,孢子萌发产生的芽管发育不良,并失去了正常菌丝的形态及繁殖能力。
经拮抗菌T295、R27及其混合菌液处理后的烟株体内PAL、POD、PPO、CAT和SOD酶活性均有不同程度的提高。其中POD、CAT和SOD与植株体内活性氧的清除密切相关,PAL和PPO与木质素的形成和酚类物质的氧化有关,这些酶与植物系统抗性密切相关,在植物机体防御体系中起重要作用,此类酶活性的增强对植物的抗病性十分有利[10-12]。内生细菌T295处理的酶活性增加最为明显,土壤根际细菌R27相比则变化较小,混合菌液诱导的酶活性与内生细菌T295单独处理差异不明显,说明内生细菌比土壤根际细菌更易对烟草产生诱导抗性,混合菌液的诱导抗性主要来自于内生细菌的诱导作用,并未表现出内生细菌和土壤根际细菌诱导抗性的累加效应。
本试验中来自烟株茎内部的T295菌株和烟草根际的菌株R27均为枯草芽孢杆菌,芽孢杆菌是植物和土壤微生态区系中的优势菌群,能产生多种抗菌物质,对不同病原菌具有较强的抑制作用,已有多种性状优良的芽孢杆菌在植物病害生物防治中成功应用[13-16]。内生细菌能诱导寄主产生抗性,同时又能在寄主体内定殖和运转;拮抗根际细菌适宜生存在寄主体表,能在体外阻止病菌的入侵,两者混合作用于烟株后,从烟草的体外到体内都增强了抵御外界病菌入侵的能力,从而提高了生防效果。在控病试验中也观察到拮抗内生细菌和根际细菌协同作用对烟草根黑腐病的控病效果优于单独使用一种菌株的防治效果,表现出增效作用,因此有望成为防治烟草根黑腐病的生物农药。
[1] 朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2002.
[2] 赵永强,张成玲,张薇.4种杀菌剂对烟草根黑腐病菌的室内毒力测定[J].中国烟草学报,2009,15(1):49-51.
[3] 易龙,马冠华,肖崇刚.烟草根黑腐病拮抗内生细菌的筛选及其抑菌作用[J].微生物学通报,2012,39(10):1464-1470.
[4] 易龙,肖崇刚,马冠华.防治烟草根黑腐病拮抗芽孢菌株的筛选[J].植物病理学报,2011,41(3):333-336.
[5] YC/T 39—1996烟草病害分级及调查方法[S].
[6] 黄云.植物病害生物防治学[M].北京:科学出版社,2010.
[7] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[8] 陈利锋,宋玉立,徐雍皋,等.抗感赤霉病小麦品种超氧化物歧化酶和过氧化氢酶的活性比较[J].植物病理学报,1997,27(3):279-284.
[9] Qin G Z,Tian S P.Enhancement of biological control activity ofCrytococcuslaurentiiby silicon and the possible mechanisms involved[J].Phytopathology,2005,95(1):69-75.
[10] Schneider S,Ullrich W.Differential induction of resistance and enhanced enzyme activities in cucumberand tobacco caused by treatment with various abiotic and biotic inducers[J].Physiological and Molecular Plant Pathology,1994,45:291-304.
[11]王小青,赵志,蒋士君,等.接种TMV的烟草高温胁迫后防御酶活性的变化[J].烟草科技,2006(12):51-54.
[12]臧晓静,李永宽,赵高岭,等.诱导子对烟草植株叶片酶活性及香气物质积累的效应[J].烟草科技,2012(4):76-80.
[13] Stein T.Bacillus subtilis antibiotics:structures,syntheses and specific functions[J].MolecularMicrobiology,2005,56(4):845-857.
[14]易龙,严占勇,肖崇刚.烟草赤星病拮抗细菌Ata28菌株的控病及促生效应[J].烟草科技,2007(12):60-62.
[15]王丽珍,肖崇刚.重庆烟草主要病害土壤拮抗细菌的筛选[J].烟草科技,2008(4):60-64.
[16]Liang J G,Tao R X,Zhang X.Induction of resistance in cucumber against seeding damping-off by plant growth-promoting rhizobacteria (PGPR) Bacillus megaterium strain L8[J]. African Journal of Biotechnology,2011,36(10):6920-6927.
Synergism of and Host Resistance Induced by Antagonistic Endophytic Bacteria and Rhizobacteria Against Tobacco Black Root Rot
YI Long1,2and MA Guanhua2
1.College of Life&Environmental Sciences,Gannan Normal University,Ganzhou 341000,Jiangxi,China
2.Institute of Plant Ecology&Pathology,Southwest University,Chongqing 400716,China
Both tobacco endophytic bacterium strain T295 and rhizobacterium strain R27 can effectively inhibit tobacco black root rot(TBRR).In order to analyze their control efficacy and mechanism,the synergism of T295 and R27 against TBRR and inhibition against hyphal growth and spore germination and effects on the activities of relative defensive enzymes,including phenylalanine ammonia lyase(PAL),peroxidase(POD),catalase(CAT),polyphenol oxidase(PPO)and superoxide dismutase(SOD)were determined.The results showed that the synergy of T295 and R27 improved apparently the control efficacy against TBRR and inhibited the hyphal growth of Thielaviopsis basicola(the pathogen of TBRR),but did not affect the inhibition of spore germination.The activities of PAL,POD,CAT,PPO and SOD in tobacco treated by T295 were higher than those treated by R27 and did not significantly differ from those treated by the mixture of T295 and R27.T295 and R27 did not present additive effect on the induced resistance,it indicated that the resistance of tobacco plants induced by the mixture mainly related to T295,which could promote the activities of relative defense enzymes in tobacco.
Tobacco;Antagonisticbacterium;Tobaccoblackrootrot;Synergisticdiseasecontrol;Inducedresistance
S43
A
1002-0861(2015)12-0009-05
10.16135/j.issn1002-0861.20151202
2015-04-17
2015-06-29
中国烟草总公司科技项目“全国烟草有害生物调查”(NY2010060103007);重庆市烟草公司科技项目“生物多样性控制烟草土传病害综合防治技术研究”(2008YY01010)。
易龙(1978—),博士,教授,主要从事植物病害生物防治研究。E-mail:yilongswu@163.com
易龙,马冠华.烟草体内外拮抗细菌协同控制根黑腐病及诱导寄主抗性试验[J].烟草科技,2015,48(12):9-13.YI Long,MA Guanhua.Synergism of and host resistance induced by antagonistic endophytic bacteria and rhizobacteria against tobacco black root rot[J].Tobacco Science&Technology,2015,48(12):9-13.
责任编辑 董志坚

