不同剂量沐舒坦在肺癌围术期应用的疗效及安全性的Meta分析
冯 莉,王爱平
据世界卫生组织(WHO)《世界癌症报告2014》及《2013中国肿瘤登记年报》显示,肺癌发病率和病死率均居恶性肿瘤首位[1,2]。在我国每年新发病例约60万例,死亡约49万例(男性34万例,女性15万例)[2]。美国国立综合癌症网络(NCCN)《2014肺癌诊疗指南》指出:外科手术治疗仍是非小细胞肺癌治疗的主要和首选方式,能够对肺癌肿块进行有效切除[3]。当前,手术后肺部并发症发生率接近7%,文献报道为5%~70%[4-8],占病死率的25%[5,6]。术后肺部并发症指术后发生的有临床表现的并对疾病进程产生负面影响的肺部异常[9],主要包括肺不张、肺内感染、急性肺损伤、急性呼吸窘迫综合征等。肺部并发症是手术整体风险的主要因素,其发生可增加住院费用、恶化术后结局,可能导致严重的健康问题,并且与长期病死率有关[10-12]。术后并发症的防治是保障病人术后康复的重要因素[13]。沐舒坦是一种传统有效的化痰药,主要适应证之一为围术期肺保护,预防肺部并发症的发生,其注射液药品说明书推荐剂量为30mg/d~90mg/d。随着对沐舒坦药理机制的深入研究,当其剂量达到一定程度可发挥特殊药理作用:抗感染、抗氧化、协同抗生素、促进肺泡表面活性物质生成,且具有剂量依赖性[14-23]。最 早 关 于 大 剂 量 沐 舒 坦 临 床 应 用 的 研究[24,25]主要集中在肺部感染、呼吸窘迫综合征等方面的研究。已有大剂量沐舒坦对急性肺损伤/急性呼吸窘迫综合征疗效的系统评价[26,27],结果表明疗效确切。关于沐舒坦在肺癌围术期应用的研究也越来越多,但其剂量还处于临床探索阶段,尚无相关系统评价。本研究拟对不同剂量沐舒坦在肺癌病人围术期应用的临床价值进行系统评价,旨在为沐舒坦在肺癌围术期的临床应用提供科学依据。
1 资料与方法
1.1 文献检索 为了提高文献检索的查全率和查准率,按照Cochrane推荐的文献检索4步骤进行:①在中国知网(CNKI)、万方、维普(VIP)、中国生物医学文献数据库(CBMdisc)、PubMed、Cochrane随机对照试验数据库、MEDLINE、EMbase等数据中检索相关文献,对所获文献题目、摘要、关键词及主题词进行分析,进行主题词查询,从而确定文献检索的关键词:沐舒坦、氨溴索、剂量、肺癌、胸部、手术、术后、肺保护、肺部并发症。②对关键词进行逻辑组配检索,根据题目、摘要进行初步筛选,对符合纳入标准的研究进行全文筛查。③补充检索所有可能相关的参考文献。④无法获取全文者,联系作者。检索时限均从建库至2014年8月1日。文种限定为中文或英文。
1.2 文献纳入和排除标准
1.2.1 研究类型 随机或半随机对照试验,无论是否采用分配隐藏或盲法。大剂量指超出沐舒坦说明书推荐的剂量,常规剂量为说明书推荐范围以内的剂量。
1.2.2 研究对象 经CT或病理检查确诊为肺癌并接受肺癌根治术单肺叶切除的病人,大剂量组和常规剂量组的基线情况基本一致,具有可比性,种族及性别不限。
1.2.3 干预措施 在其他治疗方案相同的基础上,大剂量组应用超说明书剂量的沐舒坦,常规剂量组应用说明书推荐剂量范围(30mg/d~90mg/d)内的沐舒坦。
1.2.4 结局指标 包括主要结局指标和次要结局指标,纳入研究需含1个或1个以上评价指标。主要结局指标有肺部并发症:包括肺不张、肺部感染、呼吸衰竭,通过支气管镜、胸部X线片、体温、白细胞计数或细菌培养等方式确诊。次要结局指标包括:①临床症状、体征,如痰量、痰液性质、咳痰难易程度;②术后抗生素使用时间,均使用二代头孢菌素类;③术后住院时间;④不良反应,包括过敏、恶心呕吐、消化道不适等。
1.2.5 排除标准 ①重要资料报告不全;②重复发表;③无法获取全文,而且联系作者未回复的研究。
1.3 资料提取 首先制定信息采集表,内容主要包括纳入研究的第一作者、发表年限、样本量等基本信息;研究方法学和质量评价相关信息;研究对象特征(年龄、性别、抽烟、手术时间)及干预措施的内容和结局指标信息。然后两名评价员经统一培训后按统一规范的评价方法独立评价,逐篇阅读文献全文,填写“文献信息采集表”。不全的资料通过邮件或电话等方式联系作者进行补充。资料提取由两名评价员独立进行,意见不一致时通过讨论决定。
1.4 统计学分析 采用Cochrane协作网提供的RevMan5.3软件对资料进行统计分析。对研究间异质性分析采用Q检验和I2检验。若P<0.1表示一致性存在统计学差异;根据I2以25%、50%、75% 分为低、中、高3个等级对异质性进行定量分析。若研究间无统计学异质性(P>0.1,I2<50%),采用固定效应模型进行数据合并分析,如研究间存在统计学异质性(P≤0.1,I2≥50%)则采用随机效应模型分析。计数资料采用相对危险度(RR)作为效应量,计量资料采用加权均数差(WMD)进行分析,二者均以95%可信区间(CI)表示,使用χ2检验进行异质性检验(检验水准为α=0.05)。
2 结果
2.1 文献检索结果及纳入研究的特征 最初共检出456篇文献,进一步阅读全文,最终纳入7篇文献。本研究共纳入523例病人,大剂量组271例,常规剂量组252例。两组基线项目包括第一作者、发表年份、研究对象、样本量、干预措施、结局指标。纳入研究的基本特征见表1。

表1 纳入研究文献的基本特征
2.2 纳入研究文献的方法学评价 纳入研究文献的方法学质量整体较低,都为C级,只有1篇研究使用随机数字表法进行随机分组,所有研究分配隐藏和盲法不清楚,结果数据均完整,无选择性报告和其他偏倚。详见表2。

表2 纳入研究文献的方法学质量评价
2.3 Meta分析结果
2.3.1 肺部并发症发生率
2.3.1.1 肺不张发生率 7项研究均比较了术后肺不张的发生率,共523例,其中大剂量组271例,常规剂量组252例。异质性检验显示:P=0.90,I2=0%,提示各研究结果不存在异质性。采用固定效应模型进行Meta分析,结果显示:大剂量组肺癌根治术病人肺不张发生率小于常规剂量组,差异有统计学意义[RR=0.22,95%CI(0.12,0.41),P=0.0001],提示大剂量沐舒坦可显著降低肺癌根治术后肺不张发生率。详见图1A。
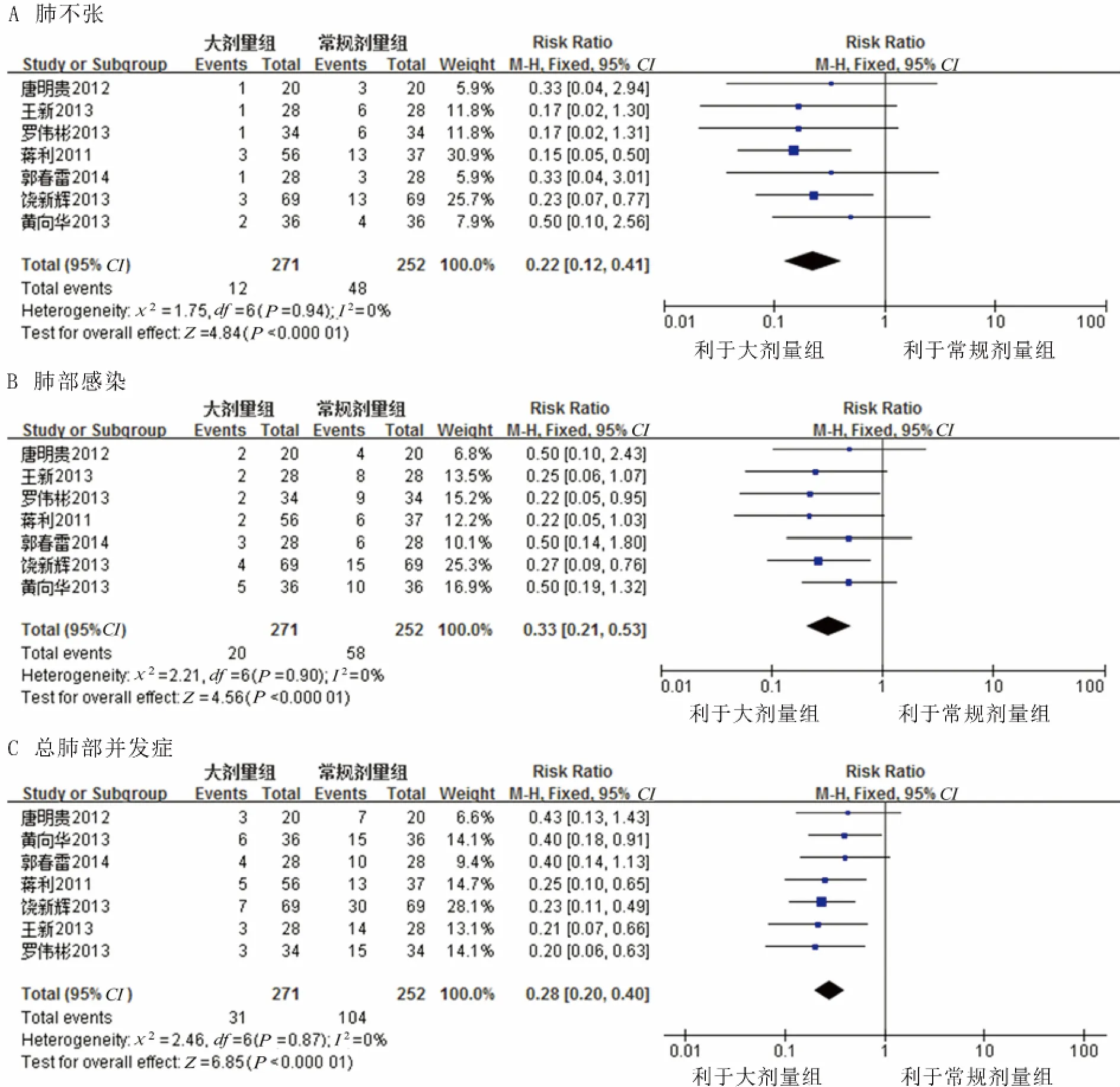
图1 术后肺部并发症发生率Meta分析结果
2.3.1.2 肺部感染发生率 7项研究均比较了术后肺部感染的发生率,各研究间无统计学异质性(P=0.93,I2=0%),采用固定效应模型进行Meta分析,结果显示沐舒坦大剂量组肺部感染发生率低于常规剂量组[RR=0.33,95%CI(0.21,0.53),P<0.05]。结果见图1B。
2.3.1.3 总肺部并发症发生率 7项研究均比较了术后总肺部并发症的发生率,共523例,其中大剂量组271例,常规剂量组252例。各研究间无统计学异质性(P=0.86,I2=0%),采用固定效应模型进行 Meta分析,结果显示大剂量组总肺部并发症发生率是常规剂量组的0.28倍[RR=0.28,95%CI(0.20,0.40),P<0.05],差异有统计学意义。见图1C。
2.3.2 术后抗生素使用时间 3项研究比较了术后抗生素使用时间,共184例,大剂量组和常规剂量组分别为92例,异质性检验无统计学差异(P=0.35,I2=4%),采用固定效应模型进行Meta分析,结果显示大剂量组较常规剂量组抗生素使用时间缩短[WMD=-1.69,95%CI(-2.19,-1.19),P<0.00001],详见图2。

图2 抗生素使用时间Meta分析结果
2.3.3 术后住院时间 两项研究[32,34]比较了术后住院时间,共128例,大剂量组和常规剂量组分别为64例,异质性检验无统计学差异(P=0.9,I2=0%),采用固定效应模型进行Meta分析,结果显示大剂量组较常规剂量组住院时间缩短[WMD=-3.18,95%CI(-3.87,-2.48),P<0.00001],详见图3。

图3 术后住院时间Meta分析结果
2.3.4 临床症状体征
2.3.4.1 咳痰容易度 4项研究[30,31,33,34]比较了不同剂量对术后咳痰容易度的影响,共273例,其中大剂量组146例,常规剂量组127例。异质性检验结果无统计学差异(P=0.74,I2=0%),采用固定效应模型进行Meta分析,结果显示:大剂量组咳痰容易度是常规剂量组的1.21倍,其差异有统计学意义[RR=1.21,95%CI(1.09,1.35),P<0.05],见图4A。

图4 咳痰症状改善率Meta分析结果
2.3.4.2 痰液稀释度 4项研究比较了不同剂量对术后痰液稀释度的影响,共273例,其中大剂量组146例,常规剂量组127例。异质性检验结果无统计学差异(P=0.20,I2=35%),采用固定效应模型进行 Meta分析,结果显示:大剂量组痰液稀释度是常规剂量组的1.26倍,其差异有统计学意义[RR=1.26,95%CI(1.13,1.41),P<0.05],见图4B。
2.3.5 不良反应 纳入研究中4项研究[28,30,31,34]报道了不良反应,除1项未发生外,其余3项出现的不良反应主要为恶心、呕吐、上腹不适、腹泻,经对症处理均缓解。大剂量组不良反应发生率均大于常规剂量组,两组差异均无统计学意义。
3 讨论
本研究结果主要表明:在肺癌根治术病人中,静脉应用沐舒坦大剂量组较常规剂量组能最大限度降低肺部并发症发生率,缩短抗生素使用时间、术后住院时间,更快改善术后咳痰症状,尚无严重不良反应。
3.1 关于大剂量沐舒坦的定义 李慧等[27]在大剂量沐舒坦对急性肺损伤/急性呼吸窘迫综合征疗效的系统评价中定义大剂量是指大于15mg/(kg·d)或>450mg/d。夏文超等[35]的研究中3个剂量990mg/d、300mg/d、90mg/d分别为大、中、小剂量。董硕等[36]研究中15mg/(kg·d)、9mg/(kg·d)、3mg/(kg·d)为大、中、小剂量。一些研究中剂量未大于15mg/(kg·d)或450mg/d,也称其为大剂量。各研究中大剂量的定义是相对的。目前,尚无大剂量的统一标准。根据沐舒坦的临床用药现状、药品说明书的滞后性[37,38]以及本研究主要目的探讨超说明书剂量沐舒坦的临床价值,所以,本研究定义大剂量为超沐舒坦说明书推荐的剂量,常规剂量为说明书推荐范围以内的剂量。
3.2 本研究Meta分析结果
3.2.1 改善临床症状和体征 本研究关于改善咳痰症状程度的比较结果为:咳痰容易度改善率RR=1.21,痰液稀释度改善率RR=1.26,提示大剂量沐舒坦稍优于常规剂量。此结果与已有研究结果一致,即沐舒坦常规剂量可发挥较好的促进纤毛摆动,调控黏液/浆液分泌作用,在改善症状程度方面大剂量并无显著优势[39]。有研究表明,大剂量沐舒坦能明显提高动脉氧分压(PaO2)、动脉氧分压和氧浓度比值(PaO2/FiO2),减轻肺损伤,更快改善肺功能及临床症状和体征[35]。本研究结果尚不能充分支持此观点,有待进一步研究。
3.2.2 降低肺部并发症 由肺部并发症的比较结果可见,在预防肺部并发症方面大剂量沐舒坦较常规剂量优势明显,与已有研究结果一致。Wang等[40]的系统评价结果表明大剂量沐舒坦与合并COPD并进行心脏或上腹部手术病人的肺保护、降低肺部并发症有关,可缩短肺叶切除术病人术后住院时间并降低住院费用;与搭桥术病人改善氧分压、缓解炎症反应、维持肺泡表面活性物质有关,此研究还推荐大剂量沐舒坦应用于高危风险的心胸外科病人。Li等[41]对急性颈脊髓损伤病人的研究表明术后连续5d静脉应用沐舒坦990mg/d可降低病人肺部感染、肺不张、低氧血症等肺部并发症。此结果也进一步证实了沐舒坦剂量达到一定程度具有抗感染、抗氧化、促进肺泡表面活性物质生成的药理作用。
3.2.3 抗生素使用时间 纳入的研究均预防性常规使用二代头孢菌素类抗生素,本研究结果显示大剂量组抗生素使用时间相对较短。可能与沐舒坦协同抗生素作用以及抗感染作用有关。有研究表明大剂量沐舒坦利于抗生素非特异性转运,促使肺组织与血浆浓度的比值上升,增强肺转运功能,增加抗生素在肺组织及其分泌物中的浓度;通过调控IgE依赖的嗜碱细胞机制[42],减少嗜碱粒细胞释放细胞因子而起到明显的抗感染、抗过敏[43]作用;通过抑制膜形成发挥抗感染作用[44],包括抗 念 珠 菌[45]、假 单 胞 菌[46,47]、铜 绿 假 单 胞菌[48]、鼻病毒[49]等感染;还可以抑制白细胞和肥大细胞释放组胺、白三烯防止肺损伤。
3.2.4 术后住院时间 本研究结果可见沐舒坦大剂量组较常规剂量组术后住院时间缩短3.14d。Refai等[50]关于肺癌根治术病人的研究中沐舒坦1000mg/d(4d)较未使用沐舒坦组术后住院时间缩短了2.54d。戴宁凰等[51]的研究中沐舒坦试验组900mg/d、对照组60mg/d,术后住院时间缩短也超过2d。本结果仅基于两篇文献报道,样本量较少,目前关于大剂量沐舒坦的使用缩短住院时间的报道较少,可能存在发表偏倚,而且住院时间受多种因素的影响,此结果有夸大效应的可能。
3.2.5 不良反应 关于不良反应的报道,大剂量组偶尔发生恶心、呕吐等不良反应,且较常规剂量频繁,但经对症处理均缓解。纳入文献均未出现变态反应、易激惹、头痛、头晕、视力模糊、眩晕、畏寒、活动过多、睡眠障碍、腹部不适、食欲不振、腹胀、腹痛、体重增加和急性肾功能损害等不良反应。有研究报道,沐舒坦可引起系统性皮炎[52],大剂量沐舒坦可增加肺灌注,使肺部渗出增多、胸腔积液增多;还可升高尿酸水平,易形成尿路结石[53,54]。因此,大剂量沐舒坦不宜用于袖状切除、尿路结石病人、过敏体质病人。此外,沐舒坦与碱性药物、中药制剂、抗生素等多种药物存在配伍禁忌,需单独泵入或使用前后冲管。
3.3 纳入文献特点 本研究纳入研究对象均为接受肺癌根治术的病人,手术方式一致,对照组均为使用常规剂量沐舒坦,异质性检验结果差异无统计学意义,纳入研究均为随机半随机对照试验,临床异质性相对较小。但在方法学方面仍有一定的局限性。本研究共纳入7项符合标准的研究,样本量较小,设计方法学质量较低,仅有1项使用随机数字表进行分组,其余研究分配隐藏、采用盲法均不清楚,可能存在选择性偏倚和测量偏倚。另外,本研究纳入文献<10篇,无法通过漏斗图判断,存在发表偏倚可能性大。因此,本研究结果的证据强度较低,临床应用需慎重考虑。
3.4 有待进一步研究的问题 本研究结果表明肺癌围术期应用超说明书剂量沐舒坦效果肯定,安全可靠。纳入文献常规剂量组为60mg/d或90mg/d,大剂量组为300mg/d~1000mg/d。目前报道有2g/d~3 g/d,24h输液泵(相当于125mg/h)泵入,疗程10d~53d,病人都同时接受血液滤过治疗。陈渊等[39]关于围术期应用氨溴索的系统评价表明:从各项术后观察指标来看大剂量沐舒坦并未显示出明显优势。分析与本研究结果不一致的原因可能为:①本研究对象为肺癌手术病人,而陈渊等[39]的研究中包括上腹部、胸部手术病人;②本研究对照为使用常规剂量沐舒坦,而陈渊等[39]的研究中部分对照组为安慰剂。关瑞宁[55]比较30mg、90mg、330mg,每日3次,认为90mg(每日3次)的效价比最高,但董硕等[36]对开胸手术病人术前3d至术后3d应用沐舒坦每日3mg/kg、6mg/kg、9 mg/kg,发现只有大、中剂量可同等程度影响术后氧分压水平,氨溴索通过提高术后1秒钟用力肺活量/用力肺活量比值(FEV1/FVC)水平,改善肺顺应性,而且大剂量更明显。也有研究表明大剂量沐舒坦显著降低肺泡表面活性物质A(SP-A)水平,调控丙二醛(MDA)、超氧化物歧化酶(SOD)、细胞间黏附因子-1(ICAM-1)因子的含量,发挥抗感染、抗氧化作用,起效时间小于3d[56]。本研究均从手术当天及术后7d内应用,有研究表明术前应用沐舒坦更有预防价值。本研究给药方式都为静脉输注,有研究报道沐舒坦雾化效果较好[57]。因此,对不同剂量沐舒坦的用药时机、适应证、用法尚待进一步研究。
4 结论
本研究结果显示大剂量可能发挥特殊药理作用,对围术期肺功能具有保护作用,降低肺不张、肺部感染等肺部并发症,改善临床症状,减轻病人痛苦,缩短住院时间使病人更快康复,缩短抗生素使用时间和住院费用、减轻病人经济负担。沐舒坦尚无严重不良反应,提示沐舒坦超说明书剂量应用,较常规剂量疗效确切,安全可靠。但本研究结果证据质量较低,影响其证据强度,临床应用需谨慎。关于不同剂量沐舒坦的适应证、用药时机、用法还有待进一步研究。
[1] Globocan 2012:Estimated cancer incidence,mortality and prevalence worldwide in 2012[R/OL].[2014-06-03].http://globocan.iarc.fr/Default.aspx.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] Non-small cell lung cancer Version I.2014[R/OL].[2014-07-18].http//www.nccn.org/patients.
[4] Smetana GW.Postoperative pulmonary complications:An update on risk assessment and reduction[J].Cleve Clin J Med,2009,76(suppl 4):S60-S65.
[5] Shander A,Fleisher LA,Barie PS,et al.Clinical and economic burden of postoperative pulmonary complications:Patient safety summit on definition,risk-reducing interventions,and preventive strategies[J].Crit Care Med,2011,39(9):2163-2172.
[6] Yoder MA,Sharma S.Perioperative pulmonary management.Emedicine 1-17[R/OL].[2014-08-09].http://emedicine.medscape.com/284983-overview.
[7] Ferreyra G,Long Y,Ranieri VM.Respiratory complications after major surgery[J].Curr Opin Crit Care,2009,15(4):342-348.
[8] Squadrone V,Coha M,Cerutti E,et al.Continuous positive airway pressure for treatment of postoperative hypoxemia:A randomized controlled trial[J].JAMA,2005,293(5):589-595.
[9] Overend TJ,Andeson CM,Lucy SD,et al.The effect of incentive spirometry on postoperative pulmonary complications:A systematic review[J].Chest,2001,120(3):971-978.
[10] Dimick JB,Chen SL,Taheri PA,et al.Hospital costs associated with surgical complications:A report from the private-sector National Surgical Quality Improvement Program[J].J Am Coll Surg,2004,199(4):531-537.
[11] Johnson RG,Arozullah AM,Neumayer L,et al.Multivariable predictors of postoperative respiratory failure after general and vascular surgery:Results from the patient safety in surgery study[J].J Am Coll Surg,2007,204(6):1188-1198.
[12] Lawrence VA,Cornell JE,Smetana GW.Strategies to reduce postoperative pulmonary complications after noncardio-thoracic surgery:Systematic review for the American College of Physicians[J].Ann Intern Med,2006,144(8):596-608.
[13] Thanavaro JL,Foner BJ.Postoperative pulmonary complications:Reducing risks for noncardiac surgery[J].Nurse Pract,2013,38(7):38-47;quiz 47-48.
[14] Wunderer H,Morgenroth K,Weis G.The cleaning system of the airways:Physiology,pathophysiology and effects of ambroxol[J].Med Monatsschr Pharm,2009,32(2):42-47.
[15] Varelogianni G,Hussain R,Strid H,et al.The effect of ambroxol on chloride transport,CFTR and ENaC in cystic fibrosis airway epithelial cells[J].Cell Biol Int,2013,37(11):1149-1156.
[16] Leffler A,Reckzeh J,Nau C.Block of sensory neuronal Na+channels by the secreolytic ambroxol is associated with an interaction with local anesthetic binding sites[J].Eur J Pharmacol,2010,630(1-3):19-28.
[17] Yamada T,Talemura Y,Niisato N,et al.Action of N-acylated ambroxol derivatives on secretion of chloride ions in human airway epithelia[J].Biochem Biophys Res Commun,2009,380(3):586-590.
[18] Peroni DG,Moser S,Gallo G,et al.Ambroxol inhibits neutrophil respiratory burst activated by alpha chain integrin adhesion[J].Int J Immunopathol Pharmacol,2013,26(4):883-887.
[19] Cataldi M,Sblendorio V,Leo A,et al.Biofilm-dependent airway infections:A role for ambroxol?[J].Pulm Pharmacol Ther,2014,28(2):98-108.
[20] Huang J,Xu J,Tian L,et al.A thioredoxin reductase and/or thioredoxin system-based mechanism for antioxidant effects of ambroxol[J].Biochimie,2014,97:92-103.
[21] Jiang K,Wang X,Mao X,et al.Ambroxol alleviates hepatic ischemia reperfusion injury by antioxidant and antiapoptotic pathways[J].Transplant Proc,2013,45(6):2439-2445.
[22] Paleari D,Ross GA,Nicolini G,et al.Ambroxol:A multifaceted molecule with additional therapeutic potentials in respiratory disorders of childhood[J].Expert Opin Drug Discov,2011,6(11):1203-1214.
[23] Malerba M,Ragnoli B.Ambroxol in the 21st century:Pharmacological and clinical update[J].Expert Opin Drug Metab Toxicol,2008,4(8):1119-1129.
[24] 张国清,朱光发.大剂量沐舒坦防治呼吸窘迫综合征的研究进展[J].国外医学:呼吸系统分册,2003,23(2):76.
[25] 张清,袁世荧,姚尚龙.大剂量盐酸氨溴索对急性呼吸窘迫综合征患者呼吸功能的影响[J].华中医学杂志,2003,27(4):174.
[26] 程艳霞,邹敏,任林,等.氨溴索预防新生儿呼吸窘迫综合征的系统评价[J].中国药房,2011,22(44):4201-4203.
[27] 李慧,徐效峰,丘绍校.大剂量氨溴索对急性肺损伤-急性呼吸窘迫综合征疗效的系统评价[J].中国呼吸与危重监护杂志,2012,11(5):459-464.
[28] 饶新辉,刘汉云,梁锦崧,等.大剂量沐舒坦对肺癌手术患者并发症的影响[J].中国医学创新,2013,10(1):6-7.
[29] 唐明贵,张军伟,王红阳,等.大剂量沐舒坦持续泵入在肺癌合并慢性阻塞性肺疾病患者肺叶切除术术后的疗效观察[J].中国医药导报,2012,9(27):86-87.
[30] 王新,王雷.大剂量盐酸氨溴索对肺癌患者围手术期的肺保护作用[J].中华胸心血管外科杂志,2013,29(2):127-128.
[31] 罗伟彬,吴国栋,彭学锋,等.不同剂量盐酸氨溴索对肺部手术患者肺部并发症的影响[J].中国医药导报,2013,10(1):71-72.
[32] 黄向华,王强,施民新,等.大剂量盐酸氨溴索在肺癌围手术期应用的临床研究[J].南通大学学报(医学版),2013,33(2):121-122.
[33] 蒋利,郎美琦,王盛,等.大剂量盐酸氨溴索预防肺叶切除术后并发症疗效观察[J].中国误诊学杂志,2011,11(32):7901-7902.
[34] 郭春雷,郑伟刚.大剂量盐酸氨溴索在普胸外科围手术期的临床效果观察[J].中外医疗,2014(8):109-111.
[35] 夏文超,韩兴鹏,韩洪利,等.不同剂量沐舒坦对肺癌术后患者的肺保护效果探讨[J].重庆医学,2012,41(17):1759-1760.
[36] 董硕,张春芳.沐舒坦临床应用剂量规范化探讨[J].实用药物与临床,2012,15(5):301-302.
[37] 王向东,李志伟,马明瑛,等.氨溴索超说明书使用与合理用药分析[J].中国药业,2013,22(8):65-66.
[38] 李玉堂,杨昌云,李炎丹,等.超说明书用药的审核分级与综合处理[J].中国药房,2011,22(17):1574-1576.
[39] 陈渊,马彬,杨克虎,等.围手术期使用盐酸氨溴索对肺保护作用的系统评价[J].中国循证医学杂志,2009,9(5):558-564.
[40] Wang S,Huang D,Ma Q,et al.Does ambroxol confer a protective effect on the lungs in patients undergoing cardiac surgery or having lung resection?[J].Interact Cardiovasc Thorac Surg,2014,18(6):830-834.
[41] Li Q,Yao G,Zhu X.High-dose ambroxol reduces pulmonary complications in patients with acute cervical spinal cord injury after surgery[J].Neurocrit Care,2012,16(2):267-272.
[42] Gibbs BF.Differential modulation of IgE-dependent activation of human basophils by ambroxol and related secretolytic analogues[J].Int J Immunopathol Pharmacol,2009,22(4):919-927.
[43] Gibbs BF.Differential modulation of IgE-dependent activation of human basophils by ambroxol and related secretolytic analogues[J].Int J Immunopathol Pharmacol,2009,22(4):919-927.
[44] Gupta PR.Ambroxol-resurgence of an old molecule as an anti-inflammatory agent in chronic obstructive airway diseases[J].Lung India,2010,27(2):46-48.
[45] Rene HD,Rene HD,Jose MD,et al.Effects of ambroxol on Candida albicans growth and biofilm formation[J].Mycoses,2014,57(4):228-232.
[46] Li F,Wang M,Hu L,et al.Effect of ambroxol on pneumonia caused by Pseudomonas aeruginosa with biofilm formation in an endotracheal intubation rat model[J].Chemotherapy,2011,57(2):173-180.
[47] Gao X,Huang Y,Han Y,et al.The protective effects of ambroxol in Pseudomonas aeruginosa-induced pneumonia in rats[J].Arch Med Sci,2011,7(3):405-413.
[48] Lu Q,Ju J,Yang X,et al.Ambroxol interferes with Pseudomonas aeruginosa quorum sensing[J].Int J Antimicrob Agents,2010,36(3):211-215.
[49] Yamaya M,Nishimura H,Nadine LD,et al.Ambroxol inhibits rhinovirus infection in primary cultures of human tracheal epithelial cells[J].Arch Pharm Res,2014,37(4):520-529
[50] Refai M,Brunelli A,Xiume F,et al.Short-term perioperative treatment with ambroxol reduces pulmonary complications and hospital costs after pulmonary lobectomy:A randomized trial[J].Eur J Cardiothorac Surg,2009,35(3):469-473.
[51] 戴宁凰,陈伟,郑中锋,等.大剂量氨溴索在老年食管癌患者术后应用的价值[J].中国保健营养,2012,12(22):5290.
[52] Monzon S,Del Mar Garles M,Lezaun A,et al.Ambroxol-induced systemic contact dermatitis confirmed by positive patch test[J].Allergol Immunopathol(Madr),2009,37(3):167-168.
[53] Drewa T,Misterek B,Pachnowska H,et al.Parenteral ambroxol treatment causes xanthine and calcium oxalate stones in rats[J].Int J Urol,2007,14(5):463-465.
[54] Drewa T,Wolski Z,Gruszka M,et al.Uric acid plasma level and urine pH in rats treated with ambroxol[J].Acta Pol Pharm,2007,64(6):565-567.
[55] 关瑞宁.不同剂量沐舒坦治疗下呼吸道感染的疗效比较[J].广州医药,2006,37(3):25-26.
[56] 王少强.短期大剂量盐酸氨溴索对老年肺癌围术期肺损伤的保护作用[D].长沙:中南大学,2012:1.
[57] 楼洪刚,刘芳,翟所迪.氨溴索雾化吸入治疗肺炎的系统评价[J].中国循证医学杂志,2006,6(6):421-429.

