右美托咪定对开颅术后延迟拔管患者应激性激素和血流动力学的影响
赵立红 尹宁宁 李 倩 陈 晗 史中华 徐 明 石广志 周建新
(首都医科大学附属北京天坛医院重症医学科,北京100050)
躁动在神经外科术后患者中是非常普遍的临床症状,可以引起儿茶酚胺和皮质醇等应激激素增多[1-2],导致患者心动过速、血压升高、心肌缺血、氧耗增加、睡眠障碍和代谢紊乱[3]。高血压还会引起脑水肿或脑内血肿,从而增加脑疝的发生率[4]。
右美托咪定是一种高选择性α2受体激动剂,可以降低血浆中儿茶酚胺浓度[5],提供充分的镇静效果,稳定血流动力学,不影响患者的自主呼吸功能[6],满足频繁进行神经功能评估的需求[7-9],近年来在神经外科的应用越来越广泛。本研究旨在评估开颅术后延迟拔管的患者中预防性应用右美托咪定镇静,对血中儿茶酚胺、皮质醇等应激激素、血流动力学和呼吸的影响,为临床用药提供指导和依据。
1 资料与方法
1.1 研究对象
1)入选标准:选取2012年7月至2013年2月对入住首都医科大学附属北京天坛医院重症监护病房(intensive care unit,ICU)的开颅术后延迟拔管患者进行筛选,年龄≥18岁且进入ICU后2 h内格拉斯哥运动评分(Glasgow Com Scale Motion,GCS-M)≥5分的患者进入研究。研究计划书及观察表由首都医科大学附属北京天坛医院伦理委员会评审通过(KY2012-006-02),并完成中国临床研究注册(ChiCTR-PRC-12002903)。每位受试者入选前均签署知情同意书。
2)排除标准:经鼻气管插管,延髓部位肿瘤术后,肝功能不全,肾功能不全,心率<50 r/min,收缩压<90 mmHg(1 mmHg=0.133 kPa),急性心肌梗死,Ⅱ~Ⅲ度房室传导阻滞,需要持续应用血管活性药维持血压,入室需呼吸机支持通气,开颅术前存在意识障碍或癫痫,开颅术前存在吞咽反射和咳嗽反射障碍,急诊手术或完成研究后再次入住ICU,入组其他研究、孕产妇。
1.2 研究方法
记录纳入患者的人口统计学基线资料数据:包括性别、年龄、身高、体质量和既往病史。记录术前、术后诊断、手术名称、肿瘤部位、肿瘤直径、手术部位、手术时间、输入液体量、出血量、尿量等术中情况。
本研究是一个前瞻、随机、双盲、对照的设计。纳入的患者根据数字表被随机分配到右美托咪定组或0.9%(质量分数)氯化钠注射液组。右美托咪定组的患者给予右美托咪定0.6 μg·kg-1·h-1(10 mg/L)持续泵入。0.9%(质量分数)氯化钠注射液组给予相同容量的0.9%(质量分数)氯化钠注射液持续泵入。拔管30 min后停止泵入。
当患者的镇静-躁动评分(Sedation Agitation Scale,SAS)≥5时,由护士报告值班医生,由值班医生根据临床情况决定给予丙泊酚(商品名得普利麻,200 mg,20 mL,阿斯利康公司,意大利)0.5 mg/kg单次静脉推注,效果不佳时给予丙泊酚0.5 mg·kg-1·h-1~2.0 mg·kg-1·h-1持续泵入以维持SAS 3~4分。需要治疗疼痛时,由值班医生决定给予枸橼酸芬太尼注射液(0.1 mg,2 mL宜昌人福药业有限责任公司)0.05 mg单次静脉推注。
遇到以下情况时需紧急终止实验:气道梗阻、呼吸暂停或节律不整、充分吸痰给氧后血氧饱和度(pulse oxygen saturation,SpO2)<90%、快速静点胶体液羟乙基淀粉(万汶,500 mL,德国费森尤斯卡比公司生产)250 mL 后仍收缩压(systolic blood pressure,SBP)<90 mmHg、硫酸阿托品注射液(0.5 mg,1 mL,天津金耀药业有限公司生产)0.25 mg入壶后心率(heart rate,HR)<50 r/min、SAS<3、二次手术。
1.3 观察指标
分别于用药前、用药后2、4、8 h和拔管后30 min研究结束时抽取患者外周血,检测血中肾上腺素、去甲肾上腺素、多巴胺和皮质醇的浓度。记录患者的血压、心率和外周血氧饱和度。研究结束时行动脉血气分析,记录pH值、动脉血氧分压(partial pressure of oxygen,PO2)、动脉血二氧化碳分压(partial pressure of carbon dioxide,PCO2)、乳酸(lactic acid,LAC)、碳酸氢根(HCO3-)水平。
1.4 统计学方法
所有数据均采用SPSS 17.0统计分析软件进行分析。基线资料采用单因素分析,计数资料用例数或百分比表示,计量资料用均数±标准差(±s)表示。实验组和对照组的血中肾上腺素、去甲肾上腺素、多巴胺、皮质醇、血压、心率和外周血氧饱和度用重复测量方差分析。实验组和对照组的pH值、动脉血氧分压(PO2)、动脉血二氧化碳分压(PCO2)、乳酸(LAC)、碳酸氢根(HCO3-)水平用t检验。双侧检验,以P<0.05为差异具有统计意义。
2 结果
2.1 患者一般情况
本研究共纳入40例神经外科开颅术后延迟拔管的患者,其中,男性18例(45%)、女性22例(55%),平均年龄(42.9±13.1)岁,平均身高(166.1±7.7)cm,平均体质量(67.2±13.2)kg。40例患者中右美托咪定组(Dex group)19例,0.9%(质量分数)氯化钠注射液组(Saline group)21例。两组患者的年龄、性别、身高、体质量、手术部位、手术时间、术中出血量、术中输血量、术中出入量和既往病史比较,差异均无统计学意义(P>0.05),详见表1。
2.2 右美托咪定对血中儿茶酚胺和皮质醇的影响
组内比较血中肾上腺素、去甲肾上腺素、多巴胺和皮质醇浓度,右美托咪定组和0.9%(质量分数)氯化钠注射液组在各时间点差异均无统计学意义(P>0.05)。两组间比较血中肾上腺素浓度的变化趋势差异无统计学意义(P>0.05)。右美托咪定组研究结束时血中去甲肾上腺素浓度低于用药前,0.9%(质量分数)氯化钠注射液组研究结束时血中去甲肾上腺素浓度高于用药前,两组间去甲肾上腺素浓度变化趋势差异有统计学意义(P<0.05)。右美托咪定组研究结束时血中多巴胺浓度下降较0.9%(质量分数)氯化钠注射液组更加明显,两组间多巴胺浓度变化趋势差异有统计学意义(P<0.05)。右美托咪定组研究结束时血中皮质醇浓度较0.9%(质量分数)氯化钠注射液组下降更明显,两组间皮质醇浓度变化趋势差异有统计学意义(P<0.01),详见表2。
表1 两组患者的基线资料Tab.1Demographic characteristics〔±s,n(%)〕
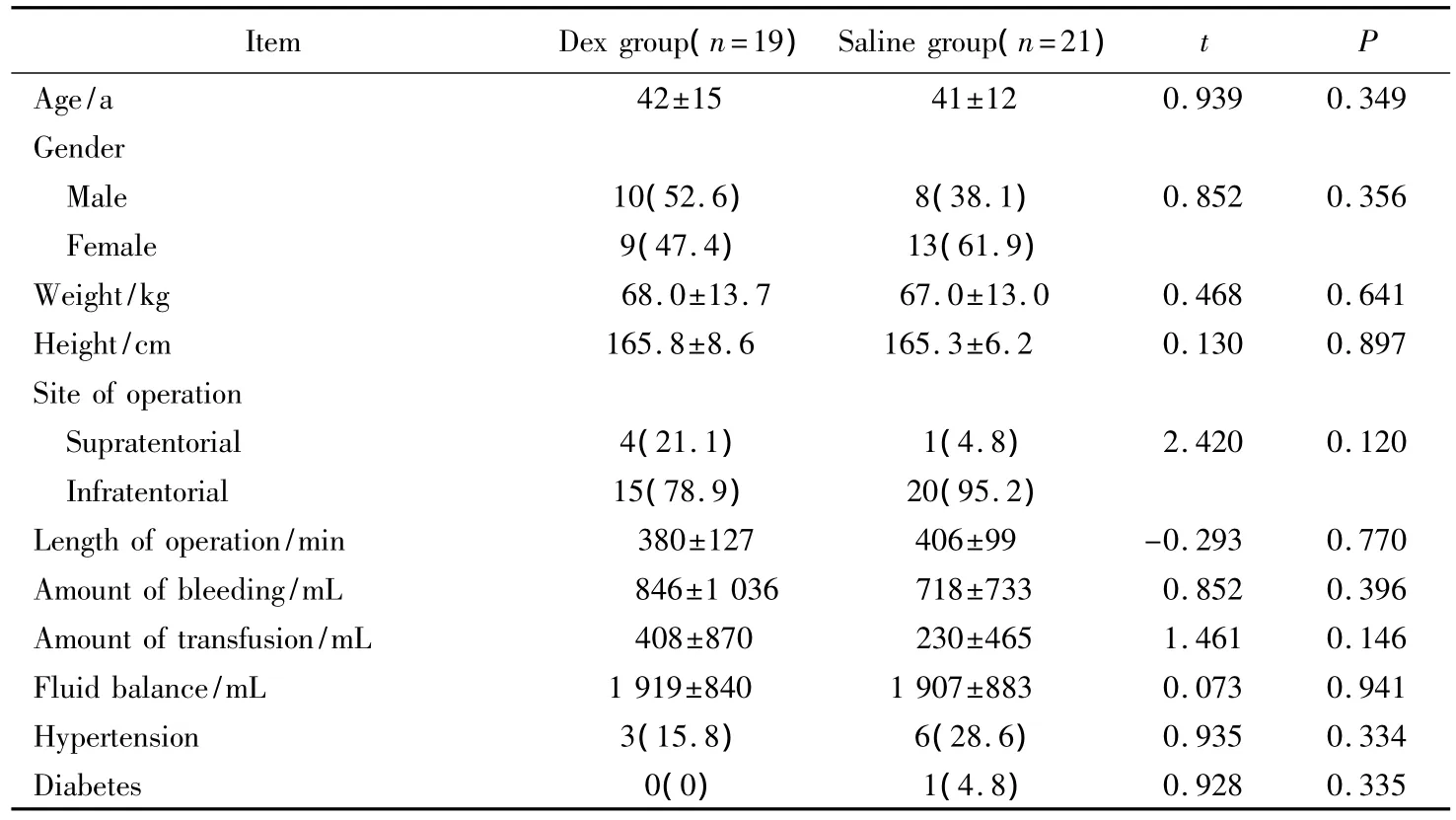
表1 两组患者的基线资料Tab.1Demographic characteristics〔±s,n(%)〕
Dex:dexmedetomidine.
Item Dex group(n=19)Saline group(n=21)t P Age/a 42±15 41±12 0.939 0.349 Gender Male 10(52.6) 8(38.1) 0.852 0.356 Female 9(47.4) 13(61.9)Weight/kg 68.0±13.7 67.0±13.0 0.468 0.641 Height/cm 165.8±8.6 165.3±6.2 0.130 0.897 Site of operation Supratentorial 4(21.1) 1(4.8) 2.420 0.120 Infratentorial 15(78.9) 20(95.2)Length of operation/min 380±127 406±99 -0.293 0.770 Amount of bleeding/mL 846±1 036 718±733 0.852 0.396 Amount of transfusion/mL 408±870 230±465 1.461 0.146 Fluid balance/mL 1 919±840 1 907±883 0.073 0.941 Hypertension 3(15.8) 6(28.6) 0.935 0.334 Diabetes 0(0) 1(4.8)0.928 0.335
表2 镇静过程中儿茶酚胺和皮质醇的变化Tab.2Concentration of stress hormone(±s,μg/L)
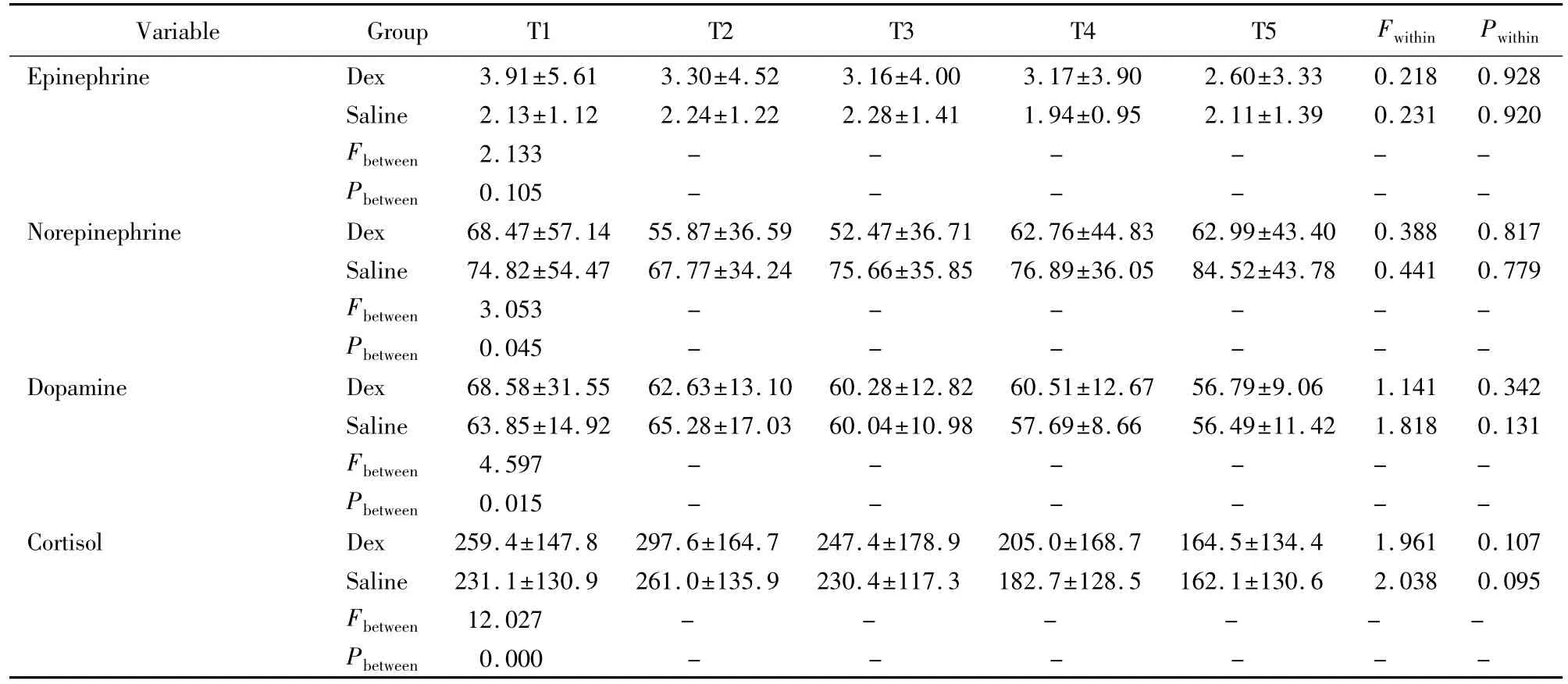
表2 镇静过程中儿茶酚胺和皮质醇的变化Tab.2Concentration of stress hormone(±s,μg/L)
T1:before infusion;T2:2 hours after infusion;T3:4 hours after infusion;T4:8 hours after infusion;T5:end of infusion;Fwithin:F value compared within group;Pwithin:P value compared within group;Fbetween:F value compared between groups;Pbetween:P value compared between groups;Dex:dexmedetomidine.
Variable Group T1 T2 T3 T4 T5 Fwithin Pwithin Epinephrine Dex 3.91±5.61 3.30±4.52 3.16±4.00 3.17±3.90 2.60±3.33 0.218 0.928 Saline 2.13±1.12 2.24±1.22 2.28±1.41 1.94±0.95 2.11±1.39 0.231 0.920 Fbetween 2.133 - - - - - -Pbetween 0.105 - - - - - -Norepinephrine Dex 68.47±57.14 55.87±36.59 52.47±36.71 62.76±44.83 62.99±43.40 0.388 0.817 Saline 74.82±54.47 67.77±34.24 75.66±35.85 76.89±36.05 84.52±43.78 0.441 0.779 Fbetween 3.053 - - - - - -Pbetween 0.045 - - - - - -Dopamine Dex 68.58±31.55 62.63±13.10 60.28±12.82 60.51±12.67 56.79±9.06 1.141 0.342 Saline 63.85±14.92 65.28±17.03 60.04±10.98 57.69±8.66 56.49±11.42 1.818 0.131 Fbetween 4.597 - - - - - -Pbetween 0.015 - - - - - -Cortisol Dex 259.4±147.8 297.6±164.7 247.4±178.9 205.0±168.7 164.5±134.4 1.961 0.107 Saline 231.1±130.9 261.0±135.9 230.4±117.3 182.7±128.5 162.1±130.6 2.038 0.095 Fbetween 12.027 - - - - - -0.000 - - - - - -Pbetween
2.3 右美托咪定对循环功能和呼吸功能的影响
组内比较,右美托咪定组的心率、收缩压和舒张压用药后明显低于用药前,差异有统计学意义(P<0.01);0.9%(质量分数)氯化钠注射液组的心率、收缩压和舒张压用药前后比较,差异无统计学意义(P>0.05)。组间比较右美托咪定组的心率、收缩压和舒张压用药后2、4、8 h和停药研究结束时均明显低于0.9%(质量分数)氯化钠注射液组,差异有统计学意义(P<0.01),详见表3。外周血氧饱和度两组用药前后以及两组差异无统计学意义(P>0.05)。研究结束时的血气分析结果两组差异无统计学意义(P>0.05),详见表 4。
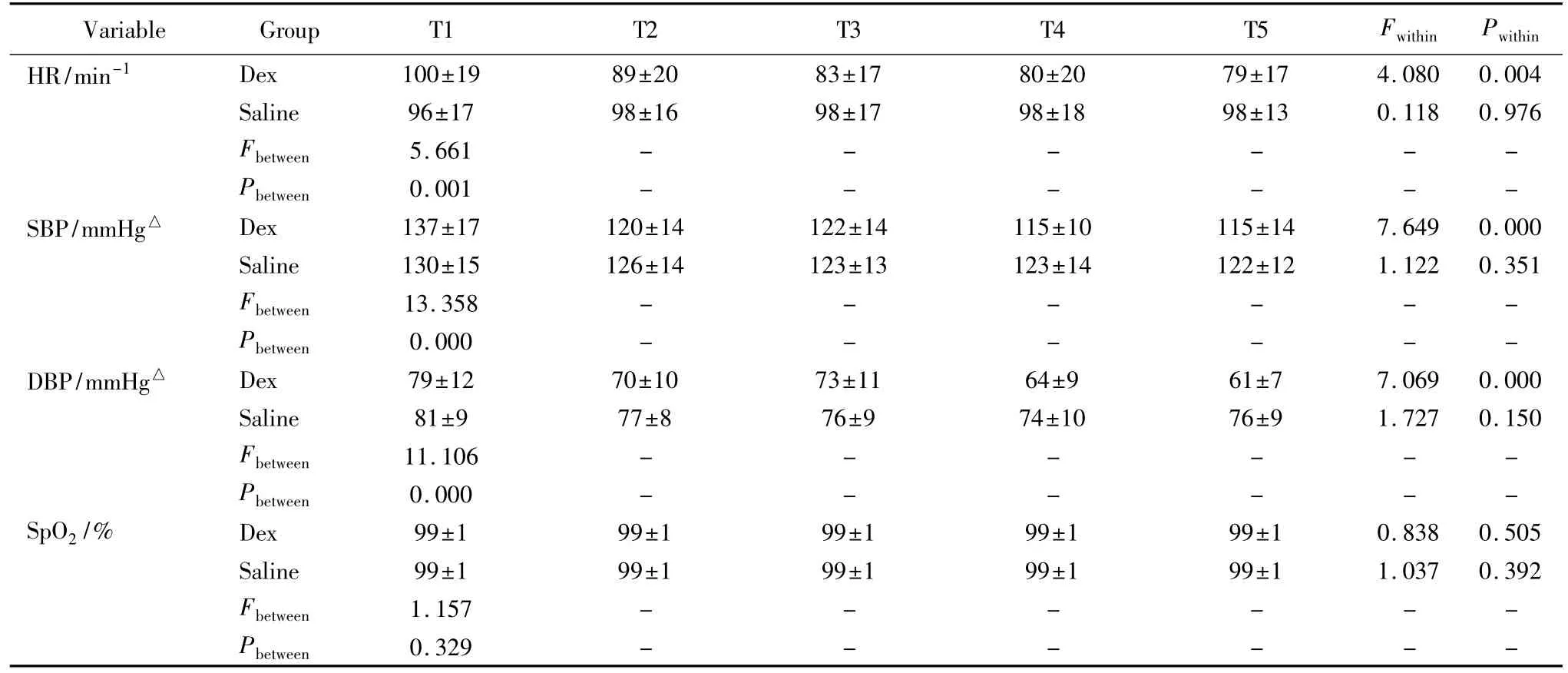
表3 镇静过程中心率、血压和血氧饱和度的变化Tab.3 Change of HR,SBP,DBP and SPO2
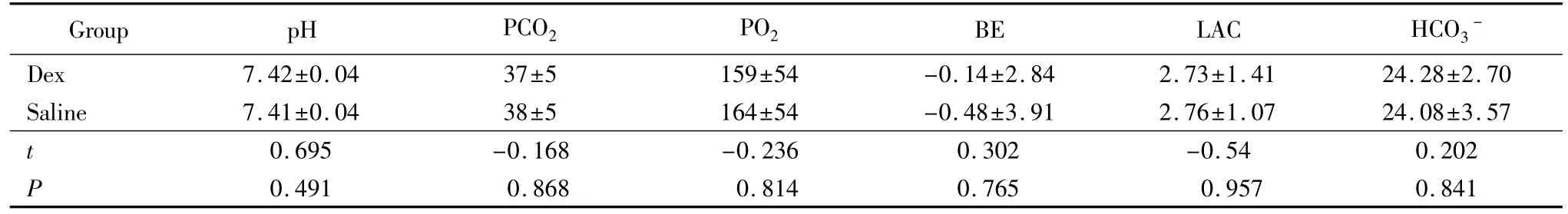
表4 血气分析结果Tab.4 Result of arterial blood gas analysis
3 讨论
开颅术后患者的躁动比较常见,本课题组[10]前期研究发现,颅内肿瘤择期开颅术后患者急性躁动的发生率可达29%,其中,80%的躁动患者属于严重躁动,非常危险。有很多因素可以引起患者躁动,包括原发病、精神紧张、谵妄、伤口引流、侵入性操作、各种医疗护理操作、气管插管的刺激、外科术后切口疼痛等[11]。躁动是患者对不良刺激产生应激反应的一种表现,可以引起体内儿茶酚胺浓度增加,造成心动过速、血压增高、氧耗增多、高血糖的发生。在神经外科的患者中,躁动引起的高血压还可以使脑水肿和颅内血肿的发生概率提高,从而造成脑疝,严重威胁患者的生命安全。
右美托咪定是一种强效、高选择性的α2受体激动剂,其与α2和α1受体的亲和力之比是1 620∶1,具有α2高度选择性。α2受体在全身都有分布,主要集中在血管平滑肌和中枢神经系统的一些核团如蓝斑核。蓝斑核是脑内去甲肾上腺素神经支配的主要区域,负责觉醒、睡眠、焦虑和药物成瘾的戒断症状。激动中枢神经系统的α2受体,可以抑制中枢交感神经发放冲动,使交感神经张力降低,能够降低交感兴奋性;激动交感神经末梢的突触前α2受体可以抑制去甲肾上腺素的释放从而降低血浆中儿茶酚胺浓度。
右美托咪定对血流动力学的影响既有中枢的作用也有外周的作用。右美托咪定起作用的是有药理活性的右旋体[12]。通过刺激桥脑蓝斑核的α2肾上腺素能受体,使蓝斑核神经元超极化降低其兴奋性,同时减少去甲肾上腺素的浓度达到抗交感作用;激动突触后α2受体则可以直接增加血管平滑肌的张力,从而降低血压和心率。输注右美托咪定最初可能有短暂的血压升高,但总体效应是显著减少血中儿茶酚胺浓度,轻度降低血压和心率。有两项研究[13-14]针对开颅手术患者应用右美托咪定,均发现应用右美托咪定改善了对患者血流动力学的控制。
由于右美托咪定具有高选择性,所以呼吸不良反应少。右美托咪定在应用临床剂量的情况下,不会产生呼吸抑制。即使血浆浓度达到治疗量的15倍,也只引起有限的呼吸不良反应,CO2有所升高,但很少发生窒息[15],因此右美托咪定的安全范围很大。研究[16-19]显示,右美托咪定不仅可以维持机械通气期间的满意镇静,还可以在拔管后继续使用以维持患者镇静,对自主呼吸无抑制作用。
本研究结果显示,右美托咪定组较对照组的去甲肾上腺素、多巴胺和皮质醇均明显降低,心率、收缩压和舒张压也明显降低,而血氧饱和度和血气分析指标无差异。因此,0.6 μg·kg-1·h-1泵入右美托咪定可以降低血中应激激素的浓度,稳定开颅术后延迟拔管患者的血流动力学,对自主呼吸无抑制作用。
[1] Barr J,Fraser G L,Puntillo K,et al.Clinical practice guidelines for the management of pain,agitation,and delirium in adult patients in the intensive care unit[J].Crit Care Med,2013,41(1):263-306.
[2] Gehlbach B K,Kress J P.Sedation in the intensive care unit[J].Curr Opin Crit Care,2002,8(4):290-298.
[3] Epstein J,Breslow M J.The stress response of critical illness[J].Crit Care Clin,1999,15(1):17-33.
[4] Basali A,Mascha E J,Kalfas I,et al.Relation between perioperative hypertension and intracranial hemorrhage after craniotomy[J].Anesthesiology,2000,93(1):48-54.
[5] Wang X,Ji J,Fen L,et al.Effects of dexmedetomidine on cerebral blood flow in critically ill patients with or without traumatic brain injury:a prospective controlled trial[J].Brain Inj,2013,27(13-14):1617-1622.
[6] Bekker A,Sturaitis M K.Dexmedetomidine for neurological surgery[J].Neurosurgery,2005,57(Suppl 1):1-10.
[7] Huupponen E,Maksimow A,Lapinlampi P,et al.Electroencephalogram spindle activity during dexmedetomidine sedation and physiological sleep[J].Acta Anaesthesiol Scand,2008,52(2):289-294.
[8] Chen L,Xu M,Li G Y,et al.Incidence,risk factors and consequences of emergence agitation in adult patients after elective craniotomy for brain tumor:A Prospective Cohort Study[J].PLoS One,2014,9(12):e114239.
[9] Mordhorst C,Latz B,Kerz T,et al.Prospective assessment of postoperative pain after craniotomy[J].J Neurosurg Anesthesiol,2010,22(3):202-206.
[10]Fujii Y,Takeuchi S,Sasaki O,et al.Ultra-early rebleeding in spontaneous subarachnoid hemorrhage[J].J Neurosurg,1996,84(1):35-42.
[11]Ma D,Rajakumaraswamy N,Maze M.Alpha2-Adrenoceptor agonists:shedding light on neuroprotection?[J].Br Med Bull,2005,71:77-92.
[12] Nelson L E,Lu J,Guo T,et al.The alpha2-adrenoceptor agonist dexmedetomidine converges on an endogenous sleeppromoting pathway to exert its sedative effects[J].Anesthesiology,2003,98(2):428-436.
[13]Soliman R N,Hassan A R,Rashwan A M,et al.Prospective,randomized study to assess the role of dexmedetomidine in patients with supratentorial tumors undergoing craniotomy under general anaesthesia[J].Middle East J Anesthesiol,2011,21(3):325-334.
[14] Tanskanen P,Kytta J,Randell T,et al.Dexmedetomidine as an anaesthetic adjuvant in patients undergoing intracranial tumor surgery:a double-blind,randomized and placebo-controlled study[J].Br J Anaesth,2006,97(5):658-665.
[15] Venn R M,Hell J,Grounds R M.Respiratory effects of dexmedetomidine in the surgical patient requiring intensive care[J].Crit Care,2000,4(5):302-308.
[16]Siobal M S,Kallet R H,Kivett V A,et al.Use of dexmedetomidine to facilitate extubation in surgical intensive-careunit patients who failed previous weaning attempts following prolonged mechanical ventilation:a pilot study[J].Respir Care,2006,51(5):492-496.
[17]肖雪琴.右美托咪定对全身麻醉患者气管拔管期应激反应的临床观察[J].中国煤炭工业医学杂志,2013,16(12):1935-1938.
[18]周南,赵芳坤,周锦.右美托咪啶对老年颅内肿瘤手术患者麻醉诱导期血流动力学和脑电双频指数的影响[J].中国医科大学学报,2014,43(9):818-820,825.
[19]吴艳琼,孙艳玲,许克成,等.右美托咪定麻醉镇静效果评价[J].临床误诊误治,2013,26(3):92-95.

