金顶侧耳原生质体制备与再生条件的研究
张亚娇 陈淮洁 卢木造 朱 坚*
金顶侧耳原生质体制备与再生条件的研究
张亚娇1,2陈淮洁1卢木造1朱 坚1,2*
(1.福建农林大学园艺学院,福州 350002;2.福建农林大学菌物研究中心,福州 350002 )
采用单因素以及正交试验法探究金顶侧耳原生质体的制备及再生条件,结果显示:加富PDA液体培养基培养5天的菌丝,在以蔗糖为渗透压稳定剂配制2%浓度的溶壁酶条件下,30 ℃酶解2.5 h,原生质体得率为2.36×107个/mL;选择蔗糖再生培养基,再生率可达0.71%。
金顶侧耳;原生质体;制备;再生;正交试验
金顶侧耳(Sing.)隶属伞菌目、侧耳科、侧耳属,别名金顶蘑、榆黄蘑[1],具有降低血脂、滋补强壮、抑制肿瘤、抗疲劳等多种营养保健功效[2]。原生质体的研究在食用菌育种中具有重要意义,有关金顶侧耳的研究目前大多集中在栽培方法、子实体蛋白质和多糖的提取、液体菌种应用、深加工等方面,对其原生质体的制备与再生研究少见报道。而笔者则较为系统地研究了金顶侧耳原生质体制备与再生的适宜条件,为今后新品种的选育、原生质体融合及遗传转化等研究工作奠定了基础。
1 材料与方法
1.1 供试菌株
供试菌株为金顶侧耳Pl.c0001,由福建省食用菌种质资源保藏与管理中心提供。
1.2 培养基配方
试管斜面培养基(PDA):马铃薯20%,葡萄糖2%,琼脂2%。PDA液体培养基:马铃薯20%,葡萄糖2%。加富PDA液体培养基:马铃薯20%,葡萄糖2%,蛋白胨 0.2%,MgSO4·7H2O 0.05%,KH2PO40.05%,维生素B10.001%。MYG培养基:葡萄糖1%,麦芽糖 0.5%,酵母粉 0.5%。再生培养基:马铃薯20%,葡萄糖2%,酵母粉0.3%,蛋白胨0.2%,KH2PO40.3%,MgSO4·7H2O 0.15%,维生素B10.001%,琼脂2%,稳渗剂0.6 mol/L。以上均为质量分数。
1.3 试剂
溶壁酶由广东省微生物研究所提供,溶壁酶液和稳渗液分别用蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl配制。
1.4 方法
(1)稳渗液的配制。分别精确称取相应质量的蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl溶于去离子水中,用容量瓶定容至终浓度为0.6 mol/L,高压灭菌后备用。
(2)酶液配制。用0.6 mol/L的稳渗剂溶解适量的溶壁酶,分别配成酶浓度(/)为1%、1.5%、2%、2.5%、3%的溶壁酶液,0.22 μm微孔滤膜过滤除菌后备用。
(3)菌丝培养。首先将试管母种在斜面培养基(PDA)上进行活化,28 ℃培养7~8天后转接到含有碎玻璃的液体培养基中静置培养,每天摇床培养0.5 h(28 ℃,150 r/min),获得纯菌丝片断。
(4)原生质体制备与计数。按试验设计的菌龄,吸取相应培养天数的菌丝至无菌的带盖离心管中,6 500 r/min离心15 min后去上清液,再用无菌水和相应的稳渗剂先后洗涤菌丝1次。每100 mg湿菌丝加1 mL酶液,在相应水浴温度下酶解一定时间。反应过程中每15 min轻微振荡一次离心管,待酶解完毕时,吸取少量酶解液进行显微镜观察并用血球计数板计数。
(5)原生质体纯化。将制备的原生质体悬液用厚0.5 cm的无菌脱脂棉过滤,去除未酶解充分的菌丝,再经离心去除酶液。将离心后的原生质体沉淀用稳渗液洗涤2次,重新悬浮在等体积的稳渗液中,即得到纯化的原生质体悬液。
(6)原生质体制备条件的单因素试验设计。将上述菌丝液体培养基分别设为PDA液体培养基、加富PDA液体培养基、MYG培养基。酶浓度设1%、1.5%、2%、2.5%、3%,酶解时间设1 h、2 h、3 h、4 h、5 h,酶解温度设26 ℃、28 ℃、30 ℃、32 ℃、34 ℃,菌龄设3天、5天、7天、9天、11天,稳渗剂为蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl,进行单因素试验。
(7)原生质体制备条件的正交试验设计。在单因素试验的基础上选取酶解时间、菌龄和稳渗剂3个因素,以金顶侧耳原生质体产量为指标,按照L9(34)正交表做正交试验,对原生质体制备条件进行进一步的优化,水平因素见表1。

表1 原生质体制备条件优化试验因素水平
(8)原生质体再生。取100 μL纯化的原生质体悬液涂布于含有不同种类稳渗剂的固体再生培养基上进行培养。为了减少残存菌丝片断再生形成的菌落所产生的误差,将原生质体用无菌的蒸馏水进行稀释,待胀破后再涂平板培养作为对照。每10皿为一个处理。以上平板均放置于28 ℃恒温培养箱培养,待3~4天菌落形成时进行统计。
(9)原生质体再生率的计算。参考王谦等的计算方法[3]。
2 结果与分析
2.1 不同单因素对原生质体产量的影响
(1)培养基。本实验采用PDA液体、加富PDA液体,以及MYG3种培养基对供试菌株进行培养。经观察发现,金顶侧耳菌丝最先在MYG培养基中萌发,培养至5天时,加富PDA液体培养基中菌丝量最多。以甘露醇为稳渗剂,用2%的溶壁酶在30 ℃下酶解3 h时,加富PDA液体培养基得到的原生质体数目最多,MYG培养基为次,PDA液体培养基最少(图1)。
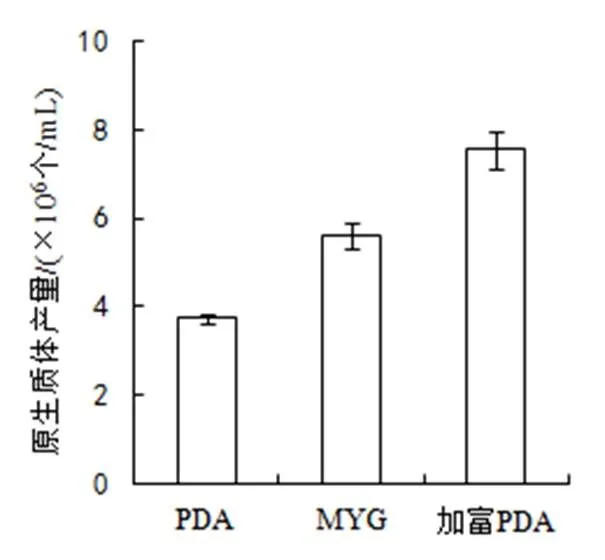
图1 培养基对原生质体产量的影响
(2)酶浓度。选择加富PDA液体培养基培养5天的菌丝,以甘露醇为稳渗剂,用不同浓度的酶溶液在30 ℃下酶解3 h,结果如图2。其中,溶壁酶浓度在2.0%时产量最高,达到7.99×106个/mL,3.0%时最低,为1.23×106个/mL。由此看出,酶浓度过低或过高原生质体产量都较低,2%为较佳酶解浓度。
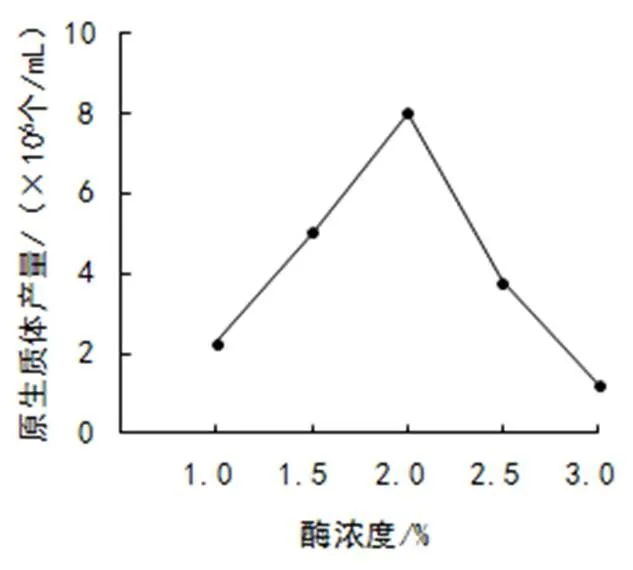
图2 酶浓度对原生质体产量的影响
(3)酶解时间。选择2%酶浓度,加富PDA液体培养基培养5天的菌丝,以甘露醇为稳渗剂,30 ℃下酶解不同时间,结果如图3:酶解时间为2 h时,原生质体表现出最大释放量,此时产量为9.83×106个/mL,之后随着酶解时间的增加,产量开始下降。因此,确定2 h为金顶侧耳较佳酶解时间。

图3 酶解时间对原生质体产量的影响
(4)酶解温度。选择加富PDA液体培养基培养5天的菌丝,以甘露醇为稳渗剂,2%浓度的酶在不同酶解温度下酶解2 h,结果如图4:在温度低于30 ℃时,随着温度的升高酶解反应加快,原生质体的数目呈现出先迅速增加后趋于平缓增加的态势;当温度超过30 ℃后,原生质体产量开始降低。这可能是由于温度过高,造成酶失活,破坏原生质体膜的结构,使其活性降低,甚至变形、裂解。因此,确定30 ℃为酶解反应的较佳温度。

图4 酶解温度对原生质体产量的影响
(5)菌龄。选择2%酶浓度,加富PDA液体培养基培养数天的菌丝,以甘露醇为稳渗剂,30 ℃下酶解2 h,结果如图5:菌丝培养5天时,原生质体数目最多,达到1.03×107个/mL。之后随着培养天数的增加,菌丝开始老化,原生质体产量降低。当菌丝长到11 天时,原生质体的产量降低到105数量级。
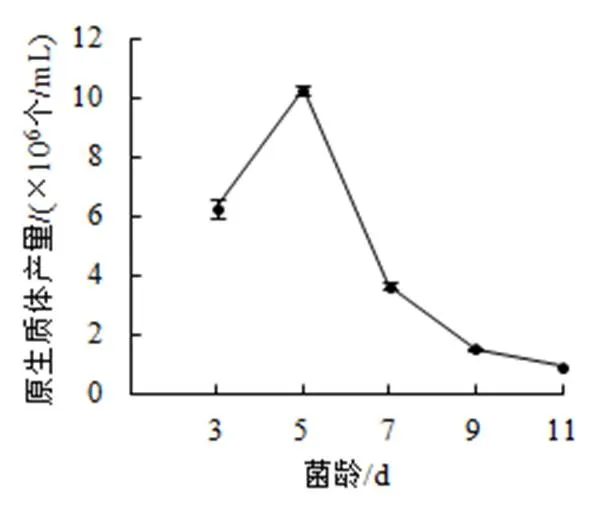
图5 菌龄对原生质体产量的影响
(6)稳渗剂。原生质体在分离、再生及融合过程中都离不开渗透压稳定剂的保护。由图6可以看出,有机糖醇类的稳渗剂比无机盐更适合金顶侧耳原生质体的制备,其中,以蔗糖为稳渗液制备出的原生质体产量最高,为1.87×107个/mL,明显高于其他4种稳渗剂,KCl最低。

图6 稳渗剂种类对原生质体产量的影响
2.2 复合因素对原生质体产量的影响
运用DPS7.05软件对正交试验结果进行统计分析。各处理平均数间的多重比较采用邓肯式新复极差测验(Duncan,s New Multiple Range Test),差异显著性水平定为α=0.05,差异极显著水平定为α=0.01进行分析,结果见表2。
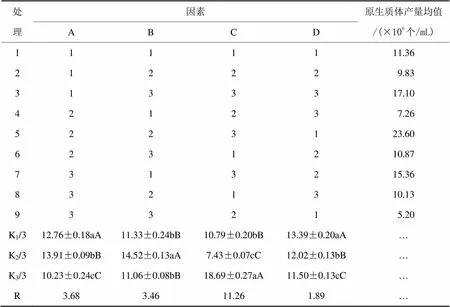
表2 原生质体制备条件正交试验及结果
注:K为制备均值、R为制备极差。
由表2可知,各因素对原生质体制备结果产生影响的大小顺序依次为稳渗液(C)>酶解时间(A)>菌龄(B),最优组合为A2B2C3。稳渗液(C)为蔗糖时,差异达到极显著,这可能是蔗糖相比其他稳渗剂提供了更多的能源物质,为原生质体的稳定存在创造了更有利的环境。酶解时间(A)为2.5 h时,差异极显著。菌龄(B)为5天的菌丝释放的原生质体数目最多,差异达到极显著,3天和7天的差异不显著,可能是3天时菌龄过小,生成的菌丝量少,形成率低;7天时菌龄过大,由于营养等原因,菌丝对外界的抵御能力增强,而不利于原生质体的制备。因此最优组合为以蔗糖为稳渗液,酶解2.5 h,培养5天,此时菌丝释放的原生质体数目最多。
2.3 再生培养基种类对原生质体再生率的影响
据部分文献报道[4~6],选择有机糖醇类的物质作为反应的稳渗剂比无机盐类更适合原生质体的再生。所以本实验并没有就无机盐类稳渗剂对再生的影响做深入研究。由表3可知,本实验甘露醇作为稳渗剂时,金顶侧耳的再生率很低,仅0.43%;蔗糖较高,为0.71%。
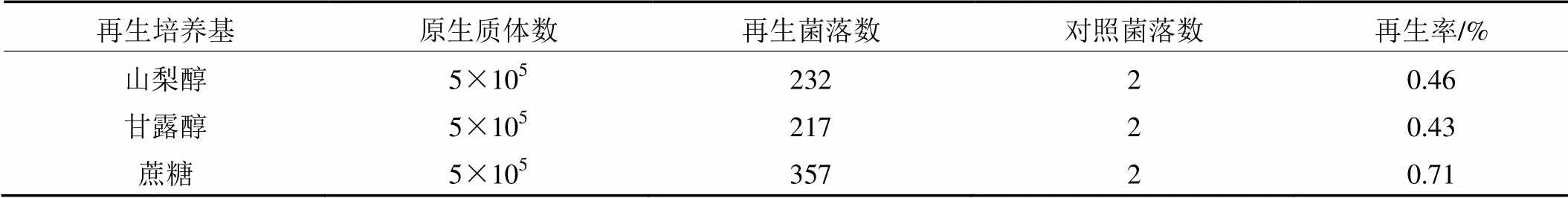
表3 不同再生培养基原生质体的再生率
注:以上结果均为10次重复的平均值。
3 讨 论
本研究表明,金顶侧耳原生质体最佳制备条件为:以0.6 mol/L蔗糖为稳渗剂,配制浓度为2%的酶液,在30 ℃条件下对加富PDA液体培养基中培养5天的菌丝酶解2.5 h,原生质体产量可高达2.36×107个/mL。其在蔗糖培养基上的再生率较高,达0.71%。
成功制备出原生质体以及保证其正常的再生是对其进行遗传操作的关键。本实验采用了单一酶即溶壁酶,通过酶解法制备原生质体,运用单因素和正交试验,分别从多个相关因素进行优化,得到了较高数量的原生质体,以满足其用于融合、再生及诱变育种、遗传转化等后续实验的浓度要求。另外,在原生质体纯化时,过滤介质的选择,以及洗涤原生质体沉淀时转速的控制也明显影响其最终得率。本实验还用2~4层擦镜纸作为过滤介质进行了实验,发现原生质体损失率也较高,而离心洗涤原生质体时,转速过低,不利于其有效沉淀,转速过高又会造成其大量破裂。因此,选择有效的过滤介质并优化适合试验菌株的离心转速尚待进一步探究。
[1] 朱坚. 食用菌品种特性与栽培[M]. 福州: 海峡出版发行集团, 2011: 292.
[2] 薛冰. 榆黄蘑的抗氧化性和榆黄蘑饮料的抗疲劳作用研究[天]. 延吉: 延边大学, 2011.
[3] 王谦, 刘敏, 王亚从. 大球盖菇原生质体制备及紫外诱变[J].河北大学学报(自然科学版), 2011, 31(4): 413-417.
[4] 韩丽华, 郭成金. 黄伞原生质体制备与再生条件研究[J]. 天津师范大学学报(自然科学版), 2008, ,28(4): 9-12.
[5] 孙露, 姚方杰, 方明. 原生质体制备与再生条件的研究[J]. 中国食用菌, 2012, 31(3): 35-37.
[6] 周继阳, 王勇, 祝长青. 原生质体制备与再生条件的建立[J]. 食品研究与开发, 2012, 33(3): 152-155
Study on preparation and regeneration conditions ofprotoplasts
Zhang Yajiao1,2Chen Huaijie1Lu Muzao1Zhu Jian1,2*
(1.College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, 350002;2.Mycological Research Center of Fujian Agriculture and Forestry University, Fuzhou, 350002)
Theprotoplasts preparation and regeneration conditions were studied by single factor and orthogonal experiment. The highest protoplasts yield with 2.36×107mL-1could be obtained on these conditions:mycelium were cultured in the enriched PDA liquid medium for 5 days, then digested at 30 ℃ for 2.5 h by 2% lywallzyme enzyme that dissolved in 0.6 mol/L sucrose. And the best regeneration rate was 0.71% using sucrose as osmotic pressure stabilizer.
; protoplast; preparation; regeneration; orthogonal experiment
S646
A
2095-0934(2015)01-39-04
国家星火计划重大项目食用菌产业升级与可持续发展技术体系示范(编号:3011GA720008)
张亚娇(1989—),在读硕士研究生,主要从事食用菌育种研究。E-mail:yajiao1010@126.com
朱坚(1964—),硕士生导师,教授,主要从事食用菌栽培、育种和加工方面的教学科研。E-mail:zhujian6469@126.com

