离子液体的结构与其物理性质之间的关系
吴琼,张恒强,王晓忠
(河北民族师范学院化学系,河北承德067000)
离子液体的结构与其物理性质之间的关系
吴琼,张恒强,王晓忠
(河北民族师范学院化学系,河北承德067000)
离子液体阴阳离子的结构决定着离子液体的物理化学性质。本文主要对离子液体的结构与熔点、溶解性、热稳定性、酸碱度、密度、粘度、导电性和电位窗、表面张力和极性等物理性质的关系进行综述。
离子液体;结构;物理性质
室温离子液体是指熔点在室温或接近室温的液态有机盐,不同的种类和结构的阴阳离子构成的离子液体,其物理化学性质也有着很大的差异。也就是说其阴阳离子的结构决定着离子液体一系列特殊的特物理化学性质。正是由于离子液体具有这些特性才使得它在催化化学、有机合成、电化学、无机材料合成等方面发挥着巨大的作用。因此,通过研究离子液体结构和物性之间的关系,可以预测其宏观性质,进而可以指导我们设计和合成具有特殊性质和功能的离子液体。
本文就组成离子液体的阴阳离子的种类和结构与其表现出的物理性质之间的关系进行相关的研究和讨论。
1 熔点
评价离子液体的一个关键参数就是其熔点,因此研究离子液体的组成与熔点的关系将非常具有意义。在多种离子液体中,咪唑盐熔点较其它同碳数的铵盐要低。咪唑盐阳离子的大小、对称性及不同碳数的取代基以及取代基链长的改变都会影响离子液体的熔点。从表1.1中可以看出,阳离子的对称性越差,熔点越低,对称性最高的M5I阳离子的熔点高达213℃[1],1-烷基-3-甲基咪唑六氟磷酸盐和四氟硼酸盐离子液体的熔点都有随着烷基链长增加,其熔点先降后升的变化趋势[2]。
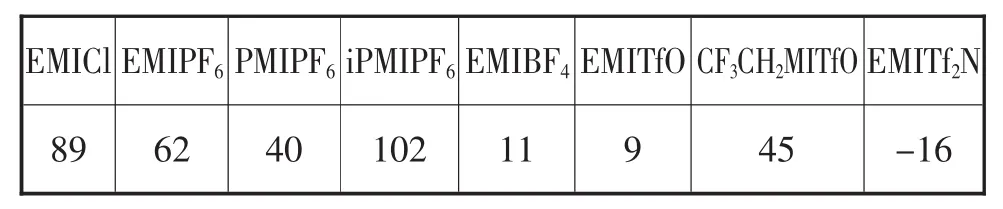
表1 不同咪唑类离子液体的熔点比较Tab.1 Comparison of melting points of different imidazole
阴阳离子之间的氢键对熔点的影响比较复杂。对于阳离子结构相同的TfO-和Tf2N-,后者的熔点比较低,主要是由于Tf2N-电荷离域效应以及不能与咪唑环上的质子形成氢键,特别是C-2上的质子。当2位上的氢被甲基化后,像1-丁基-2,3-二甲基咪唑盐氯盐,根据它的晶体结构[3],阴阳离子之间不存在氢键作用力,但熔点却比未甲基化的1-丁基-3-甲基咪唑盐酸盐还要高。
对比表1.1中离子液体的熔点,可以发现阴离子电荷数为-1时,大多数离子液体的熔点随着阴离子体积的增大而降低[4]。但是这种规律在阴离子体积特别大时并不适用[5,6]。阴离子的对称性也会影响离子液体的熔点,Tatsumi[7]报道了[C1mim][CF3BF3]的熔点为15℃,而[C1mim][BF4]的熔点为103℃,阴离子对称性降低,熔点降低。
由此可见,熔点和阴阳离子之间的相互作用有关,也就是离子的大小、几何结构和电荷分布。一般来说,低熔点的离子液体的阳离子具备下述特征:低对称性、弱的分子间作用力和阳离子电荷的均匀分布[4]。
2 溶解性
离子液体的溶解性质在催化、萃取及电化学应用中有重要的意义,它能够溶解有机物、无机物和聚合物等不同物质,是很多化学反应的优良溶剂。成功地使用离子液体,需要系统地研究其溶解特性。离子液体的溶解性主要与阴离子有关,比如水溶性,对Bmim+阳离子,其(CN)2N-盐是溶于水的,而、草酸硼盐是疏水的。阳离子对水溶性也有影响,如[Cnmim][BF4]离子液体,水溶性与阳离子上链的长短有关,当n<4时是亲水的,n>4就会和水形成两相体系[8];阳离子上引入-OH官能团,可以增加离子液体的亲水性,[C2OHmim][PF6]就可以与水互溶[9]。当然亲水与疏水只是一个相对的概念,疏水离子液体如暴露在空气中也会吸潮,经IR光谱测定,阴离子与水分子形成氢键的能力强弱顺序为[10]:。
3 热稳定性

4 密度
密度是相分离技术中一个非常重要的参数,也是离子液体一个非常重要的性质。目前所测试的大部分离子液体的密度都超过了水。离子液体的密度与阴阳离子都有关系。比较1-烷基-3-甲基Tf2N离子液体,发现密度与烷基链的长度呈线形关系,随着烷基链增大而降低,咪唑环上二位上的H被取代后,密度减小。这样,可以通过阳离子结构的轻微调整来调节离子液体的密度。阴离子对密度的影响更加明显,随着阴离子分子量的增大,密度增大。因此,设计不同密度的离子液体,首先选择相应的阴离子来确定大致范围,然后再选择阳离子对密度进行微调。
5 酸碱度
离子液体的酸性主要是由阴离子所决定的。将Lewis酸如AlCl3加入到离子液体[Bmim]Cl中,当AlCl3的摩尔分数x(AlCl3<0.5时,离子液体呈碱性;当x=0.5时,为中性,阴离子仅为AlClCO-4;当x> 0.5时,呈酸性,有和等阴离子存在,离子液体表现为强酸性[52-53]。

图13 -二烷基咪唑氯铝酸盐离子液体的酸碱性调节Fig.1 pH adjustment of 3-dialkylimidazolium chlorine ionic liquid
离子液体还具有“潜酸性”和“超酸性”[10,11]。当碱金属氯盐(MCl)加入到酸性的氯酸铝离子液体中,可按方程式反应(1)使体系呈中性。

如果此体系再加入弱碱,比如N,N-二甲基苯胺、吡咯或二茂铁,离子液体就表现出明显的“潜酸性”。
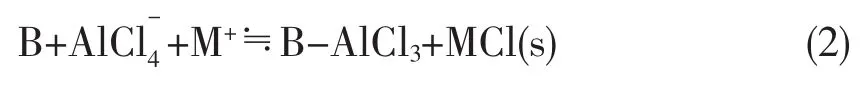
当把强的无机酸加入到酸性的氯铝酸离子液体中,可观察到离子液体的“超强酸”性。与传统的超酸体系相比,超酸性离子液体处理起来更安全。
离子液体的阳离子对酸性也有影响,咪唑阳离子本身就是较弱的Lewis酸[12],在Diels-Alder反应中,咪唑溴盐的催化效果就与这种酸性有关;更特别的是咪唑2位上的H具有BrΦnsted酸性,在碱的存在下,会形成卡宾络合物。Howarth[13]证明了在Diels Alder反应中,反应速率和endo-选择性的提高是由于2位上的H与甲基丙烯酸盐之间生成了H键的缘故。
6 粘度
根据粘度与剪切速率的关系,离子液体可分为牛顿体和非牛顿体,如[Cnmim][BF4](n=4,6,8)是牛顿体(特点是粘度只与温度有关,不受切变速率的影响),而[C12mim][BF4]是非牛顿体[14](粘度与切变速率有关)。范德华力、氢键[15]、阴离子的对称性[16]等因素都可能影响离子液体的粘度。比较20℃时不同离子液体的粘度,见表2。
氢键对粘度的影响非常明显,例如,比较含不同组分的氯铝酸盐的粘度发现,当X(AlCl3)<50%时,随着AlCl3的减少,离子液体的粘度会随之增加,这是由于咪唑阳离子中氢原子和碱性氯原子之间形成氢键的结果;当X(AlCl3>50%时,在酸性混合离子液体中,由于较大的的存在,使形成的氢键较弱,粘度自然降低[7]。当咪唑阳离子上含有-OH官能团时[7],会导致离子液体粘度的增加,主要是氢键的作用。
另外,比较含[Bmim]+阳离子不同离子液体的粘度,发现氢键和范德华力的相互作用决定离子液体的粘度[7]。从[CF3SO3]-到[C4F9SO3]-、从[CF3COO]-到[C3F7COO]-,粘度明显升高,主要是由于[C4F9SO3]-和[C3F7COO]-的离子液体较强的范德华力导致了离子液体的粘度增加。而[(CF3SO2)2N]-与[CF3SO3]-的粘度反而降低,主要是由于较弱的氢键抵消了由范德华力引起的粘度增加。
阴离子的结构对粘度也有影响。对同一阳离子,阴离子对粘度的影响顺序为:[PF6]->[SbF6]->[BF4]->[CF3SO3]->[CF3SO2)2N]-[10],[PF6]-的粘度比较大,主要是因为阴离子是对称的八面体结构,和它周围的离子有较强的作用力,导致粘度增加,其它对称性高的离子和粘度也比较高。Tatsumi[4]最近报道了降低阴离子的对称性可以降低离子液体的粘度,[C3mim][CF3BF3](25℃)的粘度是43cP,而[C3mim][BF4](25℃)的粘度是103cP。

表2 不同离子液体的粘度(20℃)Tab.2 The viscosities of different ionic liquid(20℃)
7 导电性和电位窗
离子液体的离子导电性是其电化学应用的基础。离子液体的室温离子电导率一般在10-3S/cm,其大小与离子液体的粘度、分子量、密度、离子大小及几何形状有关[7]。其中粘度对电导的影响最明显,粘度越大,离子导电性越差。相反,密度越大,导电性越好。应该注意离子大小和重量的影响,尽管[Emim] [Tf2N]和1-丁基-3-乙基Tf2N粘度接近,但前者电导是后者的两倍,就是因为[Emim]+的分子量小而使其电导率高[17]。对于给定阴离子的离子液体,电导与阳离子的几何结构关系为[18]:1-烷基-3-甲基咪唑>N,N-二烷基吡咯>四烷基铵盐,阳离子越趋于平面化,其离子传导率越高。离子液体的电导随温度的升高而增大,且在低温下,符合Arrhenius曲线。目前电导最大的离子液体就是Hagiwara等制备的[EMIm] F-2.3HF[18],在25℃时可达1.0×10-2S.cm-1。
离子液体电化学稳定电位窗口对其电化学应用也非常重要。电化学稳定电位窗口就是离子液体开始发生氧化反应的电位和开始发生还原反应的电位差值。大部分离子液体的电化学稳定电位窗口为4.0-6.0V[18],这与一般的有机溶剂相比是比较宽的电位窗口,这也是离子液体的优点之一。离子液体的氧化电位与阴离子有关,对目前常用的离子液体,像,它们之间氧化电位变化不大,一般在0.5V的范围内。而还原电位因阳离子的不同而有差异,1-烷基-3-甲基咪唑阳离子比N,N-二烷基吡咯和四烷基铵不稳定,主要与其2位上的H的酸性有关,2位上的H被烷基化后形成的离子液体,电化学窗口加宽[19]。
8 表面张力
目前认为,离子液体应用于多相均相催化体系中,催化反应是发生在离子液体和有机相的界面,催化速率取决于催化剂与表面的接触程度及反应物越过界面的速率。因此,研究离子液体的表面张力有重要的意义。离子液体的表面张力要大于传统的有机溶剂,但没有水的大。离子液体的表面张力和其组成、结构有关。对1-烷基-3-甲基咪唑盐,烷基链增长,表面张力降低;对给定的阳离子,阴离子越大,表面张力越大。
9 极性
目前对离子液体的极性还没有统一的结论,因为用不同的溶剂化显色探针得到不同的结果。以Nile red溶剂化显色探针为例[20,21],发现1-烷基-3-甲基咪唑的离子液体其极性接近于短链醇,对[Bmim]+阳离子,其极性与阴离子的大小及有效的电荷密度有关,影响大小顺序为[NO2]->[NO3]->[BF4]->[NTf2]->[PF6]-,[NTf2]-比较特别是因为阴离子内部的部分电荷离域;在咪唑上引入官能团-OH或OR,离子液体的极性增大[22]。
小结
综上所述,离子液体的结构,如阴阳离子的种类、质量、大小、取代基结构、对称性等结构指标,决定着熔点的高低,粘度、溶解性、密度、表面张力、及极性的大小。通过改变离子液体的结构,可以获得具有特殊性质和功能的离子液体。为离子液体的合成和应用提供重要的理论基础。因此研究离子液体结构和物性之间的关系,对离子液体课题的长足发展有着重要的意义。
[1]N go H L,LeCompte K,H argens L,M cEw en A B.Thermal properties of imidazolium ionic liquids.Thermochimica A cta.2000;357–358:97-102.
[2]D.H olbrey J,R.Seddon K.The phase behaviour of 1-alkyl-3-methylimidazoliumtetrafluoroborates; ionic liquids and ionic liquid crystals.Journal of theChemicalSociety,D altonTransactions.1999:2133-2140.
[3]K olle P,D ronskow ski R.H ydrogen Bonding in the CrystalStructuresoftheIonicLiquidCompounds Butyldimethylimidazolium H ydrogen Sulfate,Chloride, and Chloroferrate(II,III).Inorganic Chemistry.2004; 43:2803-2809.
[4]W asserscheid P,K eim W.Ionic Liquids—N ew“Solutions”forTransitionM etalCatalysis.A ngew andteChemie International Edition.2000;39:3772-3789.
[5]D upontJ,SuarezPA Z,D eSouzaRF,Burrow RA, K intzinger J-P.C?H-π Interactions in 1-n-Butyl-3 -methylimidazolium TetraphenylborateM oltenSalt:Solid and Solution Structures.Chemistry A European Journal.2000;6:2377-2381.
[6]Larsen A S,H olbrey JD,Tham FS,Reed CA.D esigning Ionic Liquids:Imidazolium M elts w ith Inert Carborane A nions.JournaloftheA merican ChemicalSociety. 2000;122:7264-7272.
[7]ZhouZ-B,M atsumotoH,TatsumiK.Low-M elting, Low-V iscous,H ydrophobic Ionic Liquids:1-A lkyl(A lkyl Ether)-3-methylimidazoliumPerfluoroalkyltrifluoroborate.ChemistryA EuropeanJournal.2004;10:6581-9651.
[8]BrancoLC,RosaJN,M ouraRamosJJ,A fonsoCA M. Preparation and Characterization of N ew Room Temperature Ionic Liquids.Chemistry A European Journal. 2002;8:3671-3677.
[9]M acFarlane D R,Forsyth SA,G olding J,D eacon G B.Ionic liquids based on imidazolium,ammonium and pyrrolidinium salts of the dicyanamide anion.G reen Chemistry.2002;4:444-448.
[10]D zyuba SV,Bartsch RA.Influence of Structural V ariationsin1-A lkyl(aralkyl)-3-M ethylimidazolium H exafluorophosphatesandBis(trifluoromethylsulfonyl)imides on PhysicalProperties oftheIonic Liquids.Chemphyschem.2002;3:161-166.
[11]Q uarmby IC,M antz RA,G oldenberg LM,O steryoung RA. StoichiometryofLatentA cidityinBuffered Chloroaluminate Ionic Liquids.A nalytical Chemistry. 1994;66:3558-3561.
[12]Q uarmbyIC,O steryoungRA.Latentacidityin buffered chloroaluminate ionic liquids.Journal of the A merican Chemical Society.1994;116:2649-2650. [13]H ow arth J,H anlon K,Fayne D,M cCormac P.M oisture StableD ialkylimidazolium SaltsasH eterogeneous and H omogeneous Lew is A cids in the D iels-A lder Reaction.Tetrahedron Letters.1997;38:3097-3100.
[14]A ggarw al A,Lancaster N L,Sethi A R,W elton T.The role of hydrogen bonding in controlling the selectivity ofD iels-A lder reactions in room-temperature ionic liquids.G reen Chemistry.2002;4:517-520.
[15]Bonhote P,D ias A-P,Papageorgiou N,K alyanasundaram K,G ratzel M.H ydrophobic,H ighly Conductive A mbient-Temperature M olten Salts.Inorganic Chemistry. 1996;35:1168-1178.
[16]Seddon K enneth R,Stark A,Torres M-J.Influence of chloride,w ater,and organic solvents on the physical propertiesofionicliquids.PureandA pplied Chemistry2000.p.2275.
[17]Fannin A A,Floreani D A,K ing LA,Landers JS,Piersma BJ,Stech D J,et al.Properties of 1,3-dialkylimidazolium chloride-aluminum chloride ionic liquids.2. Phase transitions,densities,electrical conductivities,and viscosities.The Journal of Physical Chemistry.1984;88:261426-21.
[18]M a M,Johnson K E.Carbocation Formation by Selected H ydrocarbonsinTrimethylsulfoniumBromide-A l-Cl3/A lBr3-H BrA mbientTemperatureM oltenSalts. JournaloftheA merican ChemicalSociety.1995; 117:1508-1513.
[19]Buzzeo M C,Evans RG,Compton RG.N on-H aloaluminate Room-TemperatureIonicLiquidsinElectrochemistry—A Review.Chemphyschem.2004;5:1106-1120.
[20]Law G,W atson PR.Surface Tension M easurements of N-A lkylimidazolium Ionic Liquids.Langmuir.2001;17:6138-6141.
[21]U e M,Takeda M,Toriumi A,K ominato A,H agiw ara R, Ito Y.A pplication of Low-V iscosity Ionic Liquid to the Electrolyte of D ouble-Layer Capacitors.Journal of the Electrochemical Society.2003;150:A 499-A 502.
[22]Carmichael A J,Seddon K R.Polarity study ofsome 1-alkyl-3-methylimidazoliumambient-temperature ionic liquids w ith the solvatochromic dye,N ile Red. JournalofPhysicalO rganicChemistry.2000;13:591-595.
Relationship Between Structure and Physical Properties of Ionic Liquid
WU Qiong,ZHANG Heng-qiang,WANG Xiao-zhong
(Department of Chemistry,Hebei Normal University for Nationalities,Chengde,Hebei067000 China)
The structure of the ionic liquid determines its physical and chemical properties.Relationship between structure and physical properties of ionic liquid was reviewed in the paper such as melting point,solubility, thermal stability,pH,density,viscosity,conductivity and potential window,surface tension and polarity.
ionic liquid;structure;physical properties
O4
A
2095-3763(2015)02-0065-05
2014-12-14
吴琼(1983-),安徽六安人,河北民族师范学院化学系讲师,硕士,研究方向为有机电化学。
2012年度河北省科技计划项目“离子液体中限域制备新型纳米碳-氧化物复合材料及其在水处理中的应用研究”(12211502);2014年度河北教育厅项目“新型β双酮类希夫碱配合物的合成、表征及其抗肿瘤活性研究”(Z2014054)。

