乙肝相关肝细胞肝癌血清蛋白标志物的筛选
康华 田亚琼 张磊 王宇凡 刘树业
肝细胞肝癌(hepatocellular carcinoma,HCC)系 流行性恶性肿瘤,是世界范围内引起癌症死亡的第五大常见原因[1],全球每年约有 59.8万人死于HCC。我国HCC是位列第二的癌症“杀手”,每年死亡人数占世界HCC死亡人数的一半以上[2,3],其5年生存率仅为5%~6%,80%以上的HCC患者就诊时已属晚期,无法手术切除,即使可以手术切除,2年复发率依然高达50%,严重影响治疗效果。因此,HCC的早期诊断尤为重要。目前,血清甲胎蛋白(alpha-fetoprotein,AFP)检测和肝脏超声检查是检测和筛查HCC的标准方法,然而,这些方法的灵敏度和特异性均不高。蛋白质组学是医学检验界高度活跃的研究领域之一[4]。近年来,蛋白质组学技术已经成功筛选出一些在 HCC 组织[5,6]、细胞[7]、血清[8,9]中具有潜在应用价值的蛋白标志物,用于肝脏疾病的诊断和预后判断,同时发现了一些新的药物治疗靶点,为肝脏疾病的诊断和治疗带来了新的机遇。本文研究采用胰蛋白酶酶解HCC患者血清蛋白质,并以强阳离子交换与反相C18二维一体色谱柱对多肽液进行分离并进行质谱检测,鉴定并筛选HBV相关性HCC特异血清蛋白标志物,为该病的诊断及治疗提供新的实验室依据。
1 资料与方法
1.1 临床资料 选取2013年3月至2014年6月在我院肝胆外科进行根治性手术切除的HBV相关性HCC患者20例。所有患者均经病理组织切片诊断为HCC,按照巴塞罗那肝癌临床分期均为Stage A1期,术前均未接受过任何抗肿瘤治疗。纳入标准:①病理确诊为HCC患者;②术前未接受化疗或放疗等抗肿瘤治疗;③无内分泌疾病和代谢性疾病;④肝、肾功能、血常规正常,水电解质酸碱维持平衡;⑤无严重感染并均未用胃肠外营养(HCC的诊断标准依据2011年卫计委颁发原发性肝癌诊疗规范)。同期选取30例健康志愿者、20例慢性乙肝患者、20例HBV肝硬化患者(均为Child pugh A级)作为对照组。所有血液标本的采集和临床资料收集均取得患者本人及家属知情同意,并经我院伦理委员会批准。
1.2 标本采集 抽取研究对象清晨空腹外周静脉血5 ml置于分离胶促凝管中,3500 g离心30 min后取血清于-80℃保存待测。
1.3 仪器与试剂 Surveyor纳升级高效液相色谱仪及LTQOrbitrap XL超高分辨生物质谱仪均购自美国 Thermo Fisher Scientific公司;乙腈(HPLC 纯)、甲酸(HPLC纯)、丙酮(HPLC纯)均购置于德国默克公司;蒸馏水经 Milli-Q 系统(Millipore Co.,USA)过滤后使用,低温高速离心机(Thermo Fisher,USA),恒温水浴箱(Thermo Fisher,USA),反相 C18 毛细管色谱柱及强阳离子交换与反相C18二维一体毛细管色谱柱购置于北京谱之源生物科技有限公司,10KDa超滤管(Millipore,USA),REAX control振荡器(Heidolph,GER)、匀质器(Silentcrusher,USA),耐受性喷针(New Objective,USA)。质谱级胰蛋白酶(Trypsin)购置于美国Promega公司,二维一体色谱柱及专用pH梯度洗脱缓冲液均购置于北京华利世生物科技有限公司。
1.4 方法
1.4.1 样本预处理 1)血清与丙酮按体积比为1∶4混合,4℃放置12 h后10 000 g离心30 min,弃上清取蛋白沉淀;2)蛋白沉淀加细胞裂解液溶解;3)将2)中所述蛋白溶液以非干扰性蛋白测定试剂盒测定蛋白浓度;4)等蛋白质量提取2)中所述蛋白溶液进行蛋白质二级结构固定化修饰处理;5)3 KDa超滤管超滤,12 000 g离心1 h,留取膜上蛋白;6)用碳酸氢铵溶液反复吹吸膜上蛋白,每次200μl,吸至新的Ep管中;7)以质量比1∶100加入胰蛋白酶进行酶解,37 ℃水浴 18 h;8)10 kDa超滤管超滤,12 000g离心1 h,留取膜下肽段;9)冻干制成干粉冷冻保存直至上机分析;10)以pH=2.5洗脱缓冲液溶解干粉,取100μl上机检测。
1.4.2 样本分析 色谱条件:液相色谱为Thermo Fisher公司的Surveyor纳升级高效液相色谱系统,该系统备有二元溶剂梯度洗脱系统及自动上样系统。色谱柱为纳升级强阳离子交换与C18反相二维一体色谱柱。色谱洗脱方式为pH梯度结合二元溶剂梯度洗脱,血清样本分离pH梯度为pH=2.5、3、3.5、4、4.5、5、5.5、6、7、8 十阶 pH 梯度,每阶 pH 梯度经120 min水与乙腈二元溶剂梯度洗脱,二元溶剂流动相为 A相0.1%甲酸水溶液,B相0.1%甲酸乙腈溶液,每阶pH值洗脱过程为120 min,进样量为10 μl,流速设定在 200 μl/min(分流后进入质谱检测,实际流量为200 nl/min),自动进样器温度设定在4℃,柱温设定在20℃。起始梯度为5%B维持20 min,至70 min B线性增加至35%,随后在20 min内将B快速增加至90%,保持90%B相5 min后迅速将B降至5%,维持5%B 25 min以平衡色谱柱。
质谱条件:质谱为Thermo公司的LTQOrbitrap XL系统,配有nano电喷雾离子源(ESI),正离子模式下进行检测。其条件为:毛细管电压8 V、锥孔电压100 V、离子源电压2.4 kV;数据采集范围m/z 400~1800;采用棒状(centroid)模式扫描,分辨率为60 000。二级质谱检测采取线性离子阱动态排除扫描模式,Orbitrap一级全扫配合10个最强信号的LTQ二级扫描,20 s内出现相同质荷比信号进行二级扫描动态排除,二级扫描碎裂模式为碰撞诱导解离(CID)模式,碰撞气为高纯氦气(99.99%He),碰撞标准化能量控制在35%。质量轴校正使用厂家提供的校正液(包括咖啡因、Ultramark 1621及tetrapeptide MRFA)。样品分析的先后顺序由Excel自带函数随机产生。
1.4.3 数据分析 本研究以 Thermo Fisher公司出品基于Sequest原理的Proteome Discovery软件进行蛋白质鉴定及相对表达含量分析。蛋白质鉴定过程人类全蛋白氨基酸序列数据库由国际蛋白质索引(International Protein Index)提供。鉴定过程基本参数设定为:一级质谱质荷比偏差低于10 ppm,二级质谱检测质荷比偏差低于0.8 Da。
1.5 统计学处理 采用SPSS17.0统计软件对数据进行统计学分析,各对照组与HCC组蛋白质相对表达量比较采用非参数秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 超高分辨质谱仪检测结果 实验结果经Proteome Discovery软件进行蛋白质鉴定,在各组血清样本中共鉴定出3578种蛋白质,对比所有检出蛋白质在各组中的相对表达量,从中筛选出7种在HBV相关性HCC组与其他对照组中相对表达量有显著差异的蛋白质,分别为富组氨酸糖蛋白(histidinerich glycoprotein,HRG)、血红蛋白β亚基、血红蛋白α 亚基、铜蓝蛋白(ceruloplasmi,CP)、α-1B-糖蛋白(alpha-1B-glycoprotein,A1BG)、 抗凝血酶Ⅲ(antithrombin-Ⅲ,ATⅢ)和AFP。图A、图B为健康志愿者与HBV相关性HCC患者的血清多肽液总离子流图(TIC)。
2.2 各组中7种蛋白相对表达量检测结果比较蛋白相对表达量以离子阱质谱动态排除扫描过程检测到的特异性肽段个数表示。HBV相关性HCC组与HBV肝硬化组相比,A1BG及AFP相对表达量增加,ATⅢ相对表达量减少;与慢性乙肝组相比,CP及AFP相对表达量增加,血红蛋白α亚基相对表达量减少;与健康对照组相比,AFP相对表达量增加,HRG及血红蛋白β亚基相对表达量减少,差异均有统计学意义(P均<0.05),见表1。
3 讨论
表1 各组中7种蛋白相对表达量检测结果比较(±s,个)
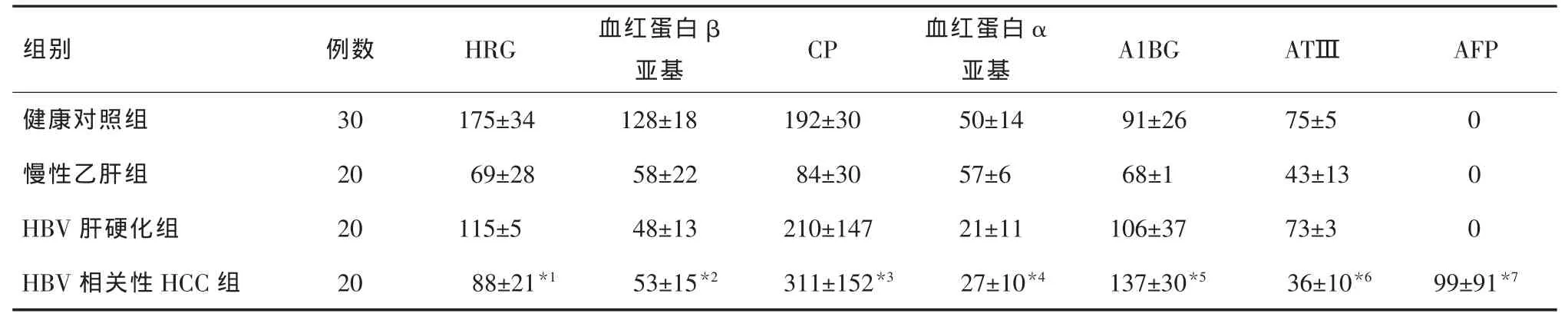
表1 各组中7种蛋白相对表达量检测结果比较(±s,个)
注:*1与健康对照组比较,Z=-2.47,P=0.012;*2与健康对照组比较,Z=-2.47,P=0.012;*3与慢性乙肝组比较,Z=-3.00,P=0.001;*4与慢性乙肝组比较,Z=-2.33,P=0.019;*5与HBV 肝硬化组比较,Z=-2.20,P=0.029;*6与HBV 肝硬化组比较,Z=-2.47,P=0.012;*7与其他三组比较,Z均=-3.00,P均=0.001
?
HRG是位于第3号染色体上的抑癌基因,相对分子质量为67~75×103,为一单链α2血浆糖蛋白。大多数HRG在肝脏实质细胞中合成,储存于血小板的α颗粒中,受凝血酶启动释放[10]。此蛋白有调节纤维蛋白生成、抑制可溶性免疫复合物形成、极化M2型肿瘤相关巨噬细胞向M1型转化、清除凋亡细胞和坏死细胞、抗异常血管新生、抑制肿瘤生长和具有抗菌活性等作用[11]。Liu 等[12]认为血液 HRG 水平可作为诊断早期HCC的分子标志物。HRG表达降低会减少巨噬细胞极化及血管正常化趋势,降低机体对肿瘤的抑制及抗转移能力。本文研究结果显示,HRG在HBV相关性HCC患者中的表达呈下调趋势,导致此结果的原因可能是由于肝细胞受损影响HRG的分泌[13]。对于HBV相关肝脏肿瘤疾病,其发生发展过程均伴随不同程度的肝细胞损害,因此对于该蛋白应作进一步的研究,探寻其肿瘤标志性的同时分析其与肝细胞损害之间的关系。
人体内的血红蛋白由四个亚基构成,分别为两个α亚基和两个β亚基。本文研究中发现血红蛋白α亚基和血红蛋白β亚基在HBV相关性HCC组中均成下调趋势。有研究[14]显示,血红蛋白β亚基在应激性溃疡、腺瘤性息肉和结直肠癌等非肝脏疾病患者的血清中表达呈上调趋势,在HCC、肝纤维化患者及HepG2细胞中均呈表达下降趋势,与本文研究结果相符。由此可见,对该蛋白进行深入研究有利于肝脏肿瘤的鉴别诊断。
图A 健康志愿者血清肽段总离子流图

图B HBV相关性HCC患者血清肽段总离子流图
CP又名铜氧化酶,是一种含铜的α2糖蛋白,是细胞色素氧化酶的组分。CP的生理功能包括参与铜转运和铁代谢、抗氧化、参与急性期反应。另外有研究[15]表明CP可作为肿瘤标志物。本文研究发现,HBV相关性HCC组CP表达水平显著增加,原因是CP具有AFP特性,肝细胞发生恶性变化时,细胞的癌基因被启动,使肝细胞合成CP的能力增强,以致其含量在HCC患者体内明显增高。临床上对于CP的检测技术已经相对成熟,本文研究结果提示CP配合AFP进行肝脏肿瘤诊断具有较高的临床应用价值,应给予高度重视。本文研究结果显示AFP在HBV相关性HCC组中呈特异性高表达,进一步印证了其作为肝脏肿瘤临床诊断标志物的高度灵敏性。AFP依然是目前HCC定性诊断的最佳标志物,对HCC的确诊、预后推测、疗效判断及复发转移的监测均具有良好的临床应用价值[16]。
A1BG是在血液样本中发现的功能有待进一步探索的蛋白质,属于免疫球蛋白家族,其在正常成人血浆中浓度为22 mg/dL[17],但生物学功能尚未明确。A1BG在急性心梗、子宫内膜异位症、肺癌及糖尿病等疾病中均呈现表达差异。本文研究结果显示,与HBV肝硬化组比较,HBV相关性HCC组血清A1BG表达上调,但其参与致癌作用的机制有待进一步研究。
ATⅢ由肝脏、血管内皮细胞和巨核细胞合成,是抗凝血系统的重要组成部分。Bechmann等[18]研究发现抗因子Xa活性与肝脏疾病的严重性呈负相关,和ATⅢ水平呈正相关,抗凝血酶本身与肝脏疾病严重程度呈负相关。Saray等[19]通过对慢性病毒性肝炎、早期肝硬化、代偿性肝硬化以及失代偿性肝硬化患者的蛋白组学研究发现,ATⅢ水平在代偿性肝硬化和失代偿性肝硬化组中下降,ATⅢ和蛋白C与慢性肝脏疾病严重程度的相关系数分别为r=-0.931,r=0.789(P<均 0.01)。本文研究发现,HBV 相关性HCC患者血清ATⅢ表达水平下调。肝癌患者ATⅢ降低的主要原因是肝癌患者严重肝损害导致其获得性合成减少,同时也与肝癌患者癌组织崩解、坏死,释放促凝物质、破坏凝血及纤溶系统的动态平衡有关系。
综上所述,本文研究找寻的7种HCC血清蛋白标志物全部由肝脏合成,与肝癌的发病机制密切相关。虽然单个血清标志物的检测没有肝癌特异性,但是多个蛋白标志物联合检测配合蛋白标志物指纹图谱变化水平可以做为肝癌诊断的依据。
1 Parkin DM,Bray F,Ferlay J,etal.Global cancer statistics,2002.CA Cancer JClin,2005,55:74-108.
2 Parkin DM.Pisani P,Ferlay J,etal.Global cancer statistics.CA Cancer JClin,1999,49:33-64.
3 Yang L,Parkin DM,Ferlay J,etal.Estimates of cancer incidence in China for 2000 and projections for 2005.Cancer Epidemiol Biomarkers Prey,2005,14:243-250.
4 Sun S,Lee NP,Poon RT,etal.Oncoproteomics of hepatocellular carcinoma:from cancer markers'discovery to functional pathways.Liver Int,2007,27:1021-1038.
5 Luk JM,Liu AM.Proteomics of h epatocellular c arcinoma in c hinese p atients.OMICS,2011,15:261-266.
6 Lee YY,McKinney KQ,Ghosh S,etal.Subcellular tissueproteomics of hepatocellular carcinoma for molecular signature discovery.JProteome Res,2011,10:5070-5083.
7 Ai J,Huang H,Lv X,etal.FLNA and PGK1 aretwopotential markersfor progression in hepatocellular carcinoma.Cell Physiol Biochem,2011,27:207-216.
8 Chen XL,Zhou L,Yang J,etal.Hepatocellular carcinoma-associated protein markers investigated by MALDI-TOF MS.Mol Med Rep,2010,3:589-596.
9 Sarvari J,Mojtahedi Z,Taghavi SA,etal.Differentially Expressed Proteins in Chronic Active Hepatitis,Cirrhosis,and HCC Related to HCV Infection in Comparison With HBV Infection:A proteomics study.Hepat Mon,2013,13:e8351.
10 Karrlander M,Lindberg N,Olofsson T,etal.Histidine-rich glycoprotein can prevent development of mouse experimental glioblastoma.PLOSOne,2009,4:e8536.
11 Rolny C,Mazzone M,Tugues S,etal.HRG inhibits tumor growth and metastasis by inducing macrophage polarization and vessel normalization through downregulation of PlGF.Cancer Cell,2011,19:31-44.
12 Liu Y,He J,Li C,etal.Identification and confirmation of biomarkers using an integrated platform for quantitative analysis of glycoproteins and their glycosylations.JProteome Res,2010,9:798-805.
13 武彩萍,刘欣,李庆伟,等.富组氨酸糖蛋白(HRG)的结构与功能.中国生物和化学与分子生物学报,2012,28:1-8.
14 Yu C,Xu C,Xu L,etal.Serumproteomic analysis revealed diagnostic valueof hemoglobin for nonalcoholic fatty liver disease.JHepatol,2012,56:241-247.
15 陈嬿,蒋雨平.铜蓝蛋白的代谢和低铜蓝蛋白血症的临床表现.中国临床神经科学,2006,14:86-87.
16 Zhu J,Jiang F,Ni HB,etal.Combined analysisof serum γ-glutamyl transferase isoenzyme II,α-L-fucosidase and α-fetoprotein detected using a commercial kit in the diagnosis of hepatocellular carcinoma.Exp Ther Med,2013,5:89-94.
17 Piyaphanee N,Ma Q,Kremen O,etal.Discovery and initial validation ofα 1-B glycoprotein fragmentation as a differential urinary biomarker in pediatric steroid-resistant nephrotic syndrome.Proteomics Clin Appl,2011,5:334-342.
18 Bechmann LP,Sichau M,Wichert M,etal.Low-molecular-weight heparin in patients with advanced cirrhosis.Liver Int,2011,31:75-82.
19 Saray A,Mesihovic R,Vanis N,etal.Clinical significance of haemostatic tests in chronic liver disease.Med Arch,2012,66:231-235.

