分离自婴儿粪便的嗜酸乳杆菌和长双歧杆菌的常温保存探究
黄魁英 ,肖安吉,卢志鹏,楚品品,杜少平,明飞平,夏枫耿,黄朝远,杨军,蔡海明,马苗鹏,张玲华
1.华南农业大学 生命科学学院,广东省农业生物蛋白质功能与调控重点实验室,广东 广州 510642;2.广州市微生物研究所,广东 广州 510663
人体消化道内存在的微生物总数达1014个[1],菌体总重量1000~1500 g,占人体总重的1/70~1/50[2]。双歧杆菌在成人肠道中占肠道总菌数的3%~10%,在婴儿肠道占到91%以上[3]。随着年龄的增长,体内有效的有活性的乳酸菌和双歧杆菌的数量会逐渐下降,为了保持肠道菌数,需要进食能提高相关益生菌活性的食物,最常见的添加益生菌是乳杆菌和双歧杆菌2个属[4-5]。益生菌具有如下特点:活性强,在体内不易被杀死;数量多,只有大量摄入并且大量存活在体内才能发挥功效;对正常的菌群结构产生显著影响,使有益菌繁殖从而抑制有害菌的生长;产生其他一些促进健康的作用,如免疫调节、抗氧化、抗肿瘤、降胆固醇等[6]。研究表明,维持益生菌功能的最低活菌浓度应高于107CFU/mL[7]。
目前我国益生菌产品面临的关键问题是工业、胃肠道胁迫对菌株的各种破坏效应,如产品的制造、贮存、销售、食用过程。双歧杆菌、嗜酸乳杆菌等益生菌多为厌氧菌或兼性厌氧菌,生长过程中不形成芽孢,抗性较差,生命活动中还会产生一些危及自身繁殖的乳酸和乙酸等代谢物,故在液体条件下难以长期保存;另外,益生菌产品的贮存和运输均要求冷链,货架期较短[8]。
为了寻找活性较好的益生菌,并探究在常温下保持其较高活性的可行方法,我们采用均匀实验设计方案,摸索分离自婴儿粪便的嗜酸乳杆菌和长双歧杆菌的保护剂成分最佳比例,为这类益生菌在日常生活中实现简单的常温保存、利于实际生产过程中的运输和保存提供实验依据。
1 材料和方法
1.1 材料
乳酸菌原培养基(500 mL):蛋白胨5 g,酵母膏2.5 g,葡萄糖10 g,磷酸二氢钾0.5 g,磷酸氢二钾0.5 g,醋酸钠2 g,琼脂7.5 g,水500 mL。121℃高温湿热灭菌22 min。
双歧杆菌原培养基(500 mL):蛋白胨5 g,酵母膏10 g,葡萄糖10 g,西红柿汁166 mL,吐温80 1 mL,琼脂7.5 g,水333 mL。121℃高温湿热灭菌22 min。
1.2 获取菌源及乳酸菌和双歧杆菌的分离
收取婴儿粪便约0.1 g,置于盛有10 mL无菌水的试管中,充分摇匀后吸取1 mL 稀释液加至9 mL无菌水中,重复相同操作便可得到1/10 梯度稀释的粪便稀释液。选择1/103、1/104、1/105梯度的稀释液,用涂布法培养于乳酸菌筛选培养基中,用滚管法培养于双歧杆菌筛选培养基中,在37℃培养箱中培养36 h,最后鉴别并挑选乳酸菌和双歧杆菌的单菌落,并编号。
1.3 菌株的纯化即优良菌种筛选
在无菌条件下,用接种环挑取鉴定培养基上初步确定的革兰阳性菌落,在MRS平板培养基上划线分离,37℃倒置厌氧培养24~48 h,挑取单菌落进行镜检,直至确定所得菌株已经纯化。然后接种到液体培养基中保存,其中一部分菌液用甘油于4℃保存,作为菌种。
对各菌种进行耐温、耐盐和产酸检测,挑出综合性能较好的菌种。
1.4 探索菌株保存条件
将嗜酸乳杆菌的保护剂成分[9]和长双歧杆菌的保护剂成分[10]按照均匀设计方法调配(表1、2)。
1.5 添加菌种保存
用磷酸缓冲液将表1、2中不同浓度的保护剂配制成不同配方的复合保护剂10 mL,分别取500 μL复合保护剂加入450 μL 菌液和50 μL 甘油的混合液,预先放在4℃中保存10 min,待菌液充分低温,用离心干燥机干燥,每隔10 min称重,干燥到2次称量质量差少于0.01 g时即干燥完成。
1.6 37℃加速常温存放
将干燥后的菌种于37℃恒温箱中存放,1 d 相当于常温下4 d(加速4倍时间)。
1.7 检测保存后菌种活性
每10 d取出样品进行活菌数检测,对收集的数据进行适当处理,调配出最佳配方。
1.8 重新保存
用最佳配方重复保存菌种,记录数据,观察保存效果。
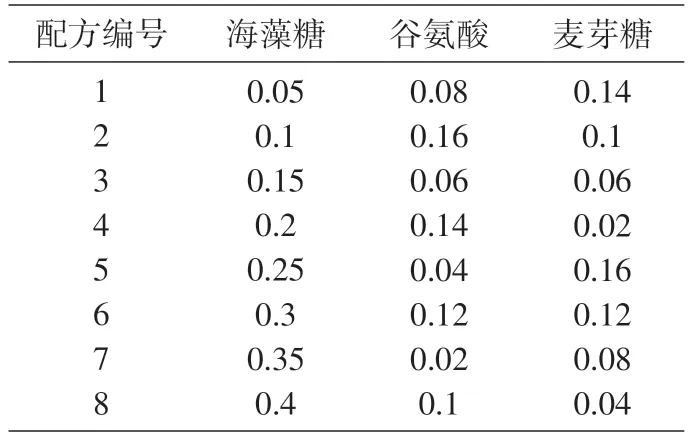
表2 长双歧杆菌的保护剂配方(g/L)
2 结果
2.1 菌种的分离鉴定
分离获得一株革兰阳性菌,形态呈细长杆状,最适生长温度为35~38℃,20℃以下不生长,耐热性差;最适pH 值为5.5~6.0,耐酸性强,能在其他乳酸菌不能生长的环境中生长繁殖;能利用葡萄糖、果糖、乳糖、蔗糖进行同型发酵,发酵产生DL型乳酸;蛋白质分解力弱。最终确定该菌种为嗜酸乳杆菌(Lactobacillus acidophilus),命名为10A31。属乳杆菌科的乳杆菌属细菌广泛存在于人及一些动物的肠道中,是有益微生物菌群,对维持胃肠道的生理功能有重要作用。
分离到的另一株菌为严格厌氧型革兰阳性菌,细胞通常为分叉形状,最适生长温度为37~41℃,起始生长pH 值为6.7~7.0,pH 值低于4.5 和高于8.5 时不生长;卵磷脂酶反应、过氧化氢酶反应、硝酸盐还原试验、明胶液化试验、吲哚试验、联苯胺反应、葡萄糖产气试验均呈阴性;不分解鼠李糖、甘油、纤维二糖、甘露醇、淀粉,能分解阿拉伯糖、木糖、核糖、乳糖、海藻糖、棉子糖、蔗糖、麦芽糖、葡萄糖、果糖、半乳糖,对山梨糖分解迟缓;代谢产物产生乙酸和乳酸,不产生甲酸、丙酸、丁酸等挥发性脂肪酸。最终确定该菌种为长双歧杆菌(Bifidobacterium longum),命名为11A11。
经培养,嗜酸乳杆菌10A31 菌落数能达到的最大数量为2.40×1010CFU/mL,长双歧杆菌11A11菌落数能达到的最大数量为7.20×109CFU/mL。经过筛选的菌种除了具有比较高的活性外,还有较高的耐温、耐盐、产酸性质。
2.2 嗜酸乳杆菌10A31的保存配方优化
实际菌落数按下式计算:
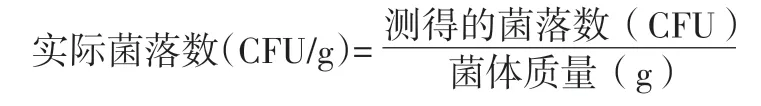
按照上述公式的计算结果见表3。可以看出,添加了保护剂,的确可以增强嗜酸乳杆菌10A31 在常温下的保存效果。为了避免正交试验所需大量试验次数,我们采用简单方便的均匀设计实验。3 因素8 水平,用均匀设计实验需要做8 次平行,而用正交试验却需要做84次平行。在前4 次计数中,干燥后的菌落数都稳定地保持在109CFU/g水平。
用软件Excel分析表3数据,由卡方分析可知麦芽糖对嗜酸乳杆菌10A31 的保存存在不相关关系,因此可忽略保护剂配方中麦芽糖这一因素。由回归分析可得:
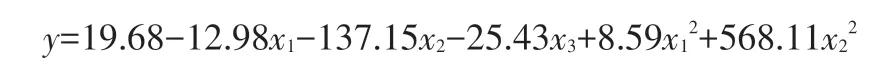
其中,y为每克嗜酸乳杆菌10A31中含有的细菌菌落总数(CFU/g),x1为海藻糖的浓度(g/L),x2为谷氨酸的浓度(g/L),x3为天冬氨酸的浓度(g/L)。
计算得出嗜酸乳杆菌10A31保护剂最佳配方及浓度为:海藻糖0.05 g/L,谷氨酸0.24 g/L,天冬氨酸0.24 g/L。即,保护剂最佳配方比例为海藻糖∶谷氨酸∶天冬氨酸=5∶24∶24。
2.3 长双歧杆菌11A11的保存配方优化
同样根据上述公式计算,结果见表4。干燥后的菌落数在第3 次计数时仅为108CFU/g,且活性不稳定。在第40 d计数时,活菌数达不到106CFU/g。
用软件Excel分析表4,由回归分析可得:
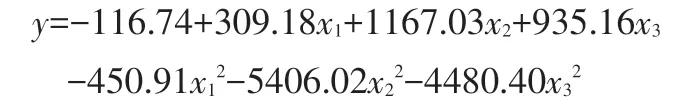
其中,y为每克长双歧杆菌11A11中含有的细菌菌落总数(CFU/g),x1为海藻糖的浓度(g/L),x2为谷氨酸的浓度(g/L),x3为麦芽糖的浓度(g/L)。
同样按照嗜酸乳杆菌数据处理方法,得出长双歧杆菌11A11 的保护剂最佳配方及浓度为:海藻糖0.34 g/L,谷氨酸0.11 g/L,麦芽糖0.24 g/L。即,保护剂最佳配方比例为海藻糖∶谷氨酸∶麦芽糖=34∶11∶10。
2.4 最佳配方保存试验
采用嗜酸乳杆菌10A31 保护剂最佳配方(海藻糖0.05 g/L,谷氨酸0.24 g/L,天冬氨酸0.24 g/L)重新用于菌株保存,在第5 次实验(相当于常温下的200 d)时,最终菌落数为3.87×109CFU/g。
采用长双歧杆菌11A11 保护剂最佳配方(海藻糖0.34 g/L,谷氨酸0.11 g/L,麦芽糖0.24 g/L)重新用于菌株保存,第4次实验(相当于常温下的160 d)时菌落数为1.53×109CFU/g,而第5 次实验时为6.80×107CFU/g。与之前实验数据比较,可以看出优化后最佳配方的活菌数明显比优化前有所提高。
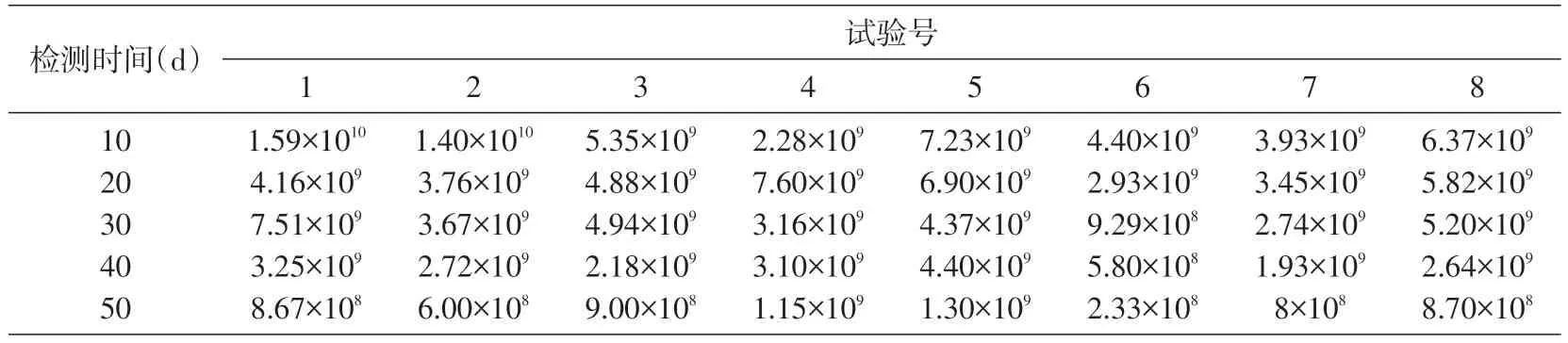
表3 嗜酸乳杆菌10A31的菌落数(CFU/g)

表4 长双歧杆菌11A11的菌落数(CFU/g)
由图1 可知,嗜酸乳杆菌10A31 在最佳配方保护剂条件下,200 d时仍然可以保持较高的菌活性,菌落数水平在109CFU/g 以上;长双歧杆菌11A11在160 d时菌落数水平可达109CFU/g,但在200 d时菌落数急剧下降。2种益生菌的菌落数都随着时间的延长而逐渐减少,菌活性也随之降低。嗜酸乳杆菌由于厌氧要求比长双歧杆菌低,因此保存难度相对简单。在最佳保护剂保存下,这2 类益生菌能在160~200 d内保持较高的活菌水平。
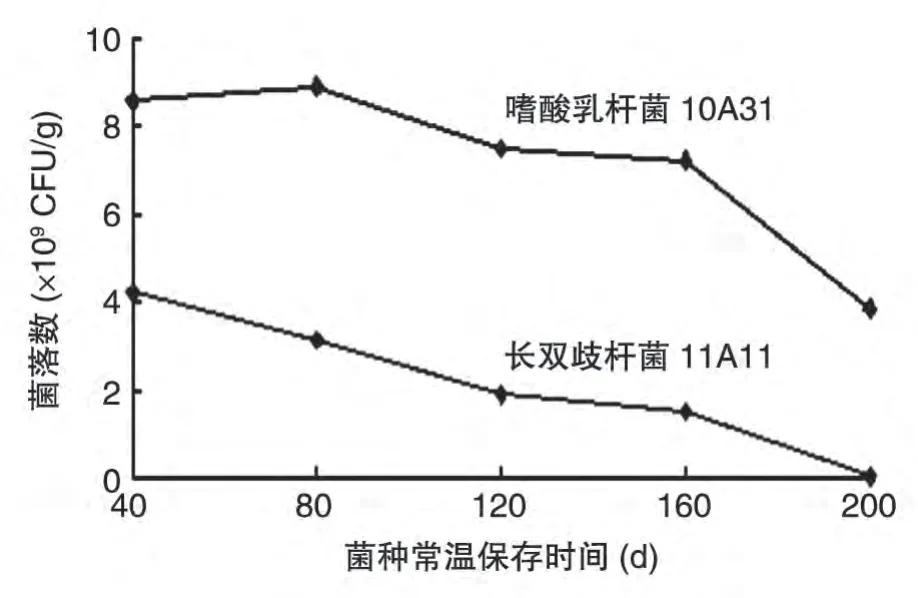
图1 益生菌采用最佳保护剂配方的常温保存菌落计数
3 讨论
从实验结果可以看出,2 种保护剂成分都是具有一定黏性的物质,能在菌表面形成一定的覆盖膜,使菌体远离空气中氧气的毒害作用。其中,海藻糖的比例都比较高,可见海藻糖对于菌种保存具有不可忽视的作用。
本实验所得保护剂能把益生菌在较长时间(嗜酸乳杆菌200 d,长双歧杆菌160 d)内保护在109CFU/g 水平。通过均匀设计实验方法探究保护剂的成分最佳配方,相比于正交试验,大大缩减了实验次数和复杂程度,且简单有效。后续拟针对不通过37℃加速培养,延长菌株活性检测时间,扩大保护剂的成分进行探索,以完善常温保存益生菌的最佳保护剂配方。
[1]Guarner F,Malagelada J R.Gut flora in health and disease[J].Lancet,2003,361:512-519.
[2]梁金钟.益生菌研究进展及在食品工业中的应用[J].中国食品添加剂,2007,G00:429-435.
[3]Kiviharju K,Leisola M,Eerikainen T.Optimization of a Bifidobacterium longum production process[J].J Biotechnol,2005,117:299-308.
[4]周蕊,白瑶.食品工业用益生菌安全性评价研究进展[J].卫生研究,2012,41(3):511-514.
[5]尹胜利,杜鉴,徐晨.乳酸菌的研究现状及其应用[J].食品科技,2012,37(9):25-29.
[6]任大勇.益生乳酸杆菌的黏附及免疫调节作用研究[D].长春:吉林大学,2013.
[7]Homayouni A,Azizi A,Ehsani M R,et al.Effect of microencapsulation and resistant starch on the probiotic survival and sensory properties of synbiotic ice cream[J].Food Chem,2008,111:50-55.
[8]田芬.抗胃肠道胁迫益生菌的筛选及产品开发[D].哈尔滨:东北农业大学,2012.
[9]雷欣宇.乳酸菌活性干燥剂制备工艺的研究[D].重庆:西南大学,2013.
[10]胡曼.两歧双歧杆菌培养及冻干保护剂的研究[D].西安:陕西科技大学,2012.

