抗FKBP52人源单链抗体的筛选及其完整抗体真核表达载体的构建
丁立,熊丽娟,王欲晓,吴成林,付凯飞,周丽君
1.南方医科大学 第三临床医学院,广东 广州 510630;2.海军总医院 中心实验科,北京 100048
FK506结合蛋白52(FK506 binding protein 52,FKBP52)属于免疫抑制剂FK506 结合蛋白(FKBP)家族,主要存在于细胞核内,也有一部分存在于胞质中。FKBP52由459个氨基酸残基组成,其编码基因FKBP4定位于染色体12p13.33,全长10 482 bp。已知FKBP52 在调控甾体激素受体信号通路及中枢神经系统神经元微管功能中发挥重要作用[1]。研究发现FKBP52 与多种癌症、生殖与神经系统相关疾病的发生发展密切相关。如在前列腺癌(雄激素相关)病人前列腺穿刺活检中可检测到高表达的FKBP52,在反复自然流产病人(孕激素相关)中FKBP52蛋白表达水平则显著降低;基因敲除实验还发现FKBP52可与病理性Tau蛋白相互作用介导神经系统退行性变[2]。值得一提的是,FKBP52 的小分子配体已被认为是潜在的营养神经药物[3]。以上均提示FKBP52或可成为多种疾病的早期诊断标志物及潜在治疗靶点[4]。因此,我们拟运用噬菌体抗体库技术,通过自行构建的大容量噬菌体抗体库,以FKBP52为抗原,筛选特异性人源抗FKBP52单恋抗体(scFv),并进一步通过同源重组技术构建完整抗体的真核表达载体,为实现抗FKBP52人源抗体的应用奠定基础。
1 材料与方法
1.1 材料
大肠杆菌XL-1Blue、HB2151 菌株,辅助病毒VCSM13 由本实验室保存;大容量噬菌体抗体库及含有轻、重链恒定区的pCMV-L 和pCMV-H 抗体真核表达载体由本实验室构建;FKBP52 蛋白、亲环素A 由美国科罗拉多州丹佛大学卡尔·K·爱德华教授惠赠;卵清蛋白(OA)和铁蛋白(Fer)购自Sigma 公司;HRP 标记的抗M13 小鼠单抗购自GE 公司;HRP标记的抗V5 小鼠单抗购自Invitrogen 公司;同源重组试剂盒购自南京诺唯赞生物科技有限公司;质粒抽提试剂盒购自promega 公司;免疫管(Immunotube)购自NUNC公司;ELISA板购自CORING公司。
1.2 大容量噬菌体抗体工作库的制备及抗FKBP52噬菌体抗体的筛选
筛选所用大容量噬菌体抗体工作库由本实验室保存的原始抗体库制备,具体实验方法见文献[5]。抗FKBP52 人源抗体的筛选采用酸洗脱方法[6],实验步骤主要包括:将FKBP52 蛋白用包被液(0.1 mol/L NaHCO335 mL,0.1 mol/L Na2CO315 mL,H2O 50 mL)稀释至50 μg/mL,包被免疫管,4℃过夜后用5%的脱脂奶粉37℃封闭3 h,加入1 mL 制备好的噬菌体抗体库,37℃孵育3 h,用含1‰ Tween 的PBS 洗15 次,加入1 mL 甘氨酸盐酸(pH2.2)洗脱(37℃10 min),Tris 碱中和后加入1 mL XL-1Blue,37℃、15 min,转入锥形瓶并取10 μL铺含氨苄西林(Amp)的培养盘测定菌落形成单位(CFU),锥形瓶于37℃摇床培养约1 h 后补足含Amp 的SB 培养基至100 mL,37℃、200 r/min 培养5 h 后加入VCSM13,30℃培养过夜,次日离心收集上清,PEG、NaCl 沉淀后得级次噬菌体抗体库,加入免疫管进行第2轮筛选,如是筛选4 轮。计算每轮获得的噬菌体抗体库的滴度,通过计算每轮抗体库投入和产出比(富集率),评价抗FKBP52噬菌体抗体的筛选是否有富集。
1.3 噬菌体抗体的筛选及特异性鉴定
分别从第3、4轮筛选的含Amp的培养盘中随机挑取单克隆,置于含Amp 的LB 培养液中,于37℃摇床培养至对数生长期后加入VCSM13 诱导感染,30℃培养过夜后离心取上清即得到噬菌体抗体。
噬菌体抗体特异性鉴定采用ELISA 方法:稀释FKBP52 抗原至5 μg/mL,50 μl/孔包被ELISA 板,4℃过夜,用5%脱脂奶粉于37℃封闭3 h后加入噬菌体抗体,37℃孵育2 h,用含1‰ Tween 的PBS 洗后加入二抗(HRP 抗M13 小鼠单抗),37℃孵育2 h,洗涤后加入TMB底物显色液显色,用酶标仪读取D450nm值,根据读数选出阳性克隆,再以OA、Fer 为抗原包被ELISA板,以测定噬菌体抗体的特异性。
1.4 噬菌体抗体可变区基因DNA序列测定
挑选出经上述步骤筛选到的特异性阳性克隆送诺赛公司测序,运用相关软件对获得的阳性克隆进行序列分析。
1.5 抗FKBP52-scFv的可溶性表达及检测
将序列分析后基因型不同的噬菌体抗体按照文献[7]所述步骤感染新鲜培养的HB2151 菌后,挑选单克隆于37℃培养至对数生长期,经异丙基-β-D-硫代半乳糖苷(IPTG)(1 mmol/L)于30℃诱导培养过夜后离心收取上清,获得可溶性FKBP52-scFv。采用ELISA 方法对对可溶性抗体进行特异性检测,无关抗原除OA、Fer 外增加亲环素A。实验中一抗为可溶性上清,二抗为HRP 抗V5小鼠单抗(针对载体上含有的14个氨基酸残基的V5标签:Gly-Lys-Pro-Ile-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr),其余步骤同噬菌体抗体特异性测定。
1.6 抗体的亲和力测定
抗体-抗原亲和力检测采用生物膜干涉(biolayer interferometry,BLI)法[8],由北京拓普百奥科技公司用ForteBio公司的RED96型生物分子相互作用仪进行测定,所得结合动力学曲线采用FortebBio 数据分析软件以1∶1 模型拟合获取结合常数(Kon)、解离常数(Kd)和亲和常数(KD)。
1.7 完整抗体轻、重链真核表达载体的构建及鉴定
1.7.1 完整轻、重链真核表达载体的构建 采用同源重组的方法[9]。根据筛选获得的scFv 轻、重链可变区设计相应上、下游引物,PCR 分别扩增轻、重链可变区基因,用同源重组试剂盒分别与轻、重链真核表达载体pCMV-L 和pCMV-H 进行同源重组,将重组产物转化大肠杆菌DH5α感受态,铺卡那霉素(Kan)抗性盘,37℃孵育过夜,获得完整抗体真核表达载体。
1.7.2 完整轻、重链真核表达载体的阳性克隆的鉴定 采用常规菌液PCR 方法,随机挑选Kan 盘上单克隆菌为模板,扩增可变区及完整抗体片段,选择经PCR方法鉴定为阳性的克隆送诺赛公司测序。
2 结果
2.1 实际工作库的制备
用原始库超感染BS1365 菌后得到的次级库滴度为1.26×1013,再用其感染对数期XL-1Blue菌后得到的工作库滴度为5.0×1014,用于下步抗体筛选。
2.2 抗FKBP52噬菌体抗体的筛选及鉴定
经4轮筛选,抗FKBP52噬菌体抗体的回收率达千倍富集(表1),分别从3、4轮随机挑选500个克隆制备噬菌体抗体,ELISA结果表明其中126个克隆可与FKBP52 结合,进一步的特异性测定表明其中45个克隆与OA、Fer蛋白等无关抗原不结合,其特异性克隆占35%。
2.3 噬菌体抗体可变区基因DNA 序列分析及可溶性表达
对获得的特异性克隆测序后对可变区DNA 进行序列分析,发现46个阳性克隆具有15种不同基因型。将15种阳性噬菌体抗体上清感染HB2151菌获得可溶性表达,进一步进行特异性测定,其中7种获得可溶性表达(图1)。对这7 种单链抗体可变区进行分析,其轻链可变区分属VκⅠ、VκⅢ、VλⅠ亚群,而重链可变区则分属VHⅠ、VHⅢ、VHⅣ亚群。
2.4 噬菌抗体的亲和力测定
从7种可溶性表达活性较高的阳性克隆中挑选4种进行亲和力测定,结果见表2。
2.5 完整轻重链真核表达载体的构建及鉴定
选择亲和力较好的克隆3,用同源重组方法分别构建轻、重链真核表达载体,经转化,各挑取10个克隆PCR鉴定,其中轻、重链阳性克隆分别为9和10个,阳性率分别为90%和100%;进一步挑选2 个阳性克隆进行DNA测序,结果显示全部正确,图2为其中一个阳性克隆的PCR鉴定结果。说明已构建成表达完整轻、重链的真核表达载体。
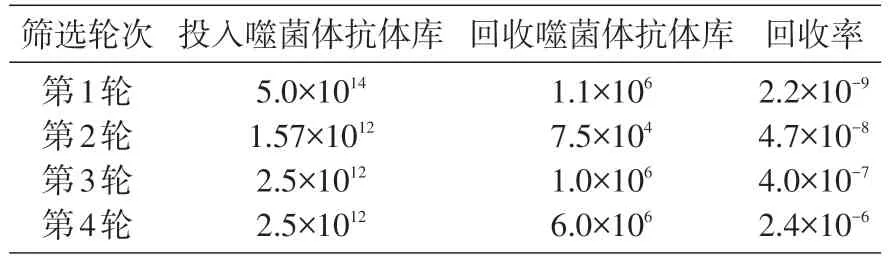
表1 抗FKBP52噬菌体抗体筛选各轮回收率
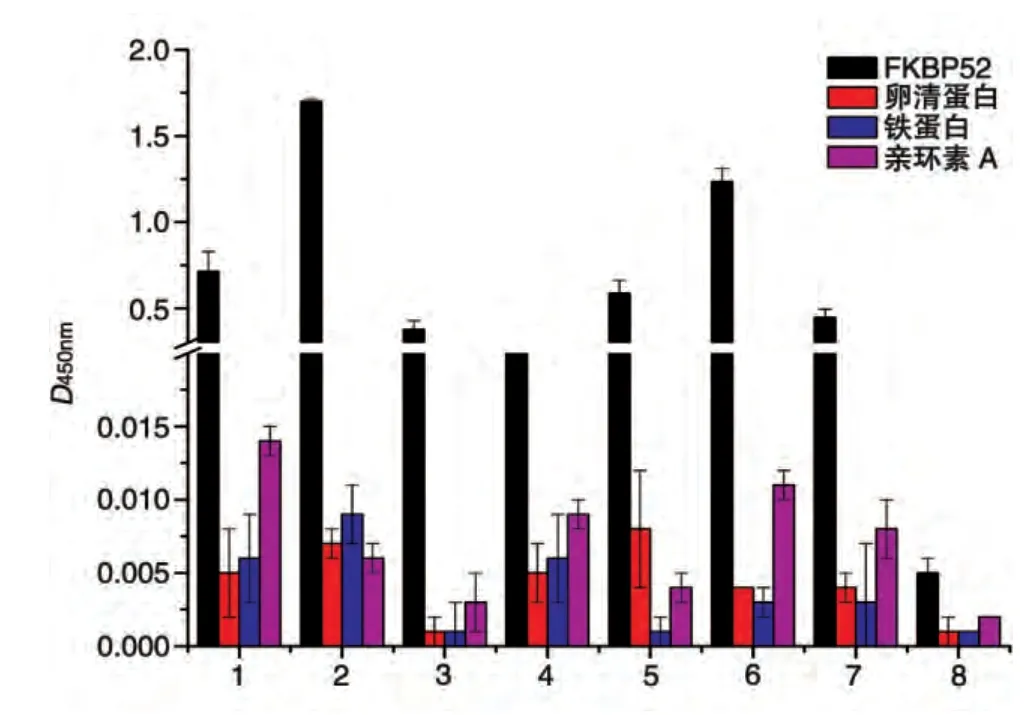
图1 可溶性抗体的特异性检测
3 讨论
FKBP52 因其特征性的对甾体激素受体及中枢神经系统神经元微管的调控功能而被证实与多种疾病存在关联。最新研究发现,其在前列腺癌、乳腺癌、肝癌中均有着显著的高表达[10-11],而在反复自然流产(RSA)、先兆子痫(PE)及胎儿宫内生长受限(IUGR)等生殖疾病中亦有着明显异常的表达[12-13]。另外,其还在一定程度上介导Tau蛋白病的发生,且被认为参与了花青素潜在预防阿尔兹海默病(AD)的作用机制[14]。种种研究均表明FKBP52 可作为前列腺癌、乳腺癌、肝癌的早期诊断标志,且有望成为上述癌症及生殖相关疾病的治疗靶点。此外,对FKBP52 表达水平早期测定有助于预测AD 的发生,而针对提高FKBP52 活性的药物还可能成为预防及治疗AD的有效手段[15]。故研制针对FKBP52的人源化抗体有着非常实际的应用价值及发展前景,同时也有助于更好地深入评价其功能。
噬菌体抗体库技术是起源于上世纪90 年代的一种人源抗体制备技术,因其操作简便、快速等特点,在早期针对新型治疗靶点人源抗体的制备及评价方面有良好的应用前景。为进一步探讨FKBP52作为自身免疫性疾病治疗靶点的潜质,我们使用本室自行构建的大容量噬菌体scFv抗体库,通过吸附、扩增、洗脱过程筛选抗FKBP52 的噬菌体抗体,经ELISA测定、DNA序列分析,获得了多株具有不同基因型的抗FKBP52 人源scFv。基于以往研究经验,为了避免噬菌体抗体基因Ⅲ蛋白对scFv结构的影响造成的假阳性,我们进一步对获得的噬菌体抗体进行了可溶性表达,最终获得了7 株基因型不同的特异性抗体。同时,我们挑选特异性结合活性高的4株进行了亲和力测定,结果显示亲和力均在10-8范围内,尚未达到可用的10-9,符合噬菌体抗体筛选的普遍特性,可能与scFv同抗原结合单价相关,有待表达完整抗体后再进行亲和力测定,相关工作正在进行中。

表2 不同克隆的亲和力测定

图2 完整抗体轻、重链表达载体的PCR测定
噬菌体抗体技术作为一种成熟的工程抗体制备技术,已被广泛用于特异性抗体片段的制备中,但由于制备的仅是抗体功能片段,半衰期短,加上多为原核表达载体,抗体片段蛋白没有经过蛋白翻译后修饰,很难满足治疗性抗体需要,因此必须将筛选获得的抗体片段转换为真核表达的完整抗体分子。以往进行真核表达载体构建时多采用酶切的方法,但往往耗时长、连接效率不高。在本研究中,我们选择亲和力较好的一株scFv,采用同源重组方法进行了完整抗体真核表达载体的构建,并通过了PCR 验证及测序确证。重组方法操作简便、快速且成功率高,为将抗体库筛选获得的小分子抗体转换为完整抗体提供了新方法。目前我们已在HEK293-F细胞中表达了完整抗FKBP52 人源抗体,正在对获得的抗体进行分离纯化及功能测定,结果将后续报道。
[1]Cioffi D L,Hubler T R,Scammell J G.Organization and function of the FKBP52 and FKBP51 genes[J].Curr Opin Pharmacol,2011,11(4):308-313.
[2]Giustiniani J,Chambraud B,Sardin E,et al.Immunophilin FKBP52 induces Tau-P301L filamentous assembly in vitro and modulates its activity in a model of tauopathy[J].Proc Natl Acad Sci USA,2014,111(12):4584-4589.
[3]Utuk A,Sarikcioglu L,Demirel B M,et al.The immunosup-pressive agent FK506 prevents subperineurial degeneration and demyelination on ultrastructural and functional analysis[J].Curr Neurovasc Res,2009,6(4):252-258.
[4]Storer C L,Dickey C A,Galigniana M D,et al.FKBP51 and FKBP52 in signaling and disease[J].Trends Endocrinol Metab,2011,22(12):481-490.
[5]乔媛媛,王琰,陈晓穗,等.大容量噬菌体抗体库的构建及鉴定[J].中华微生物学和免疫学杂志,2004,24(3):194-197.
[6]秦海艳,王建锋,熊颖,等.鼠源E型肉毒毒素免疫噬菌体单链抗体库的构建及筛选[J].生物技术通讯,2015,26(1):59-63.
[7]刘启刚,代云见,张勇侠,等.抗IgE单链抗体在大肠杆菌中可溶性高效表达条件的研究[J].中国生物工程杂志,2012,32(11):23-28.
[8]张晟,罗弟祥,刘怡,等.抗体含量检测的生物膜干涉技术、HPLC及ELISA的比较[C].2012年中国药学大会暨第十二届中国药师周,南京,2012.
[9]Zu Y,Tong X,Wang Z,et al.TALEN-mediated precise genome modification by homologous recombination in zebrafish[J].Nat Methods,2013,10(4):329-331.
[10]Sivils J C,Storer C L,Galigniana M D,et al.Regulation of steroid hormone receptor function by the 52-kDa FK506-binding protein(FKBP52)[J].Curr Opin Pharmacol,2011,11(4):314-319.
[11]李传伟,王雪迪,张智,等.FKBP12 和FKBP52 在肝细胞癌中的表达及临床意义[J].中国癌症防治杂志,2014,(2):138-142.
[12]Chen H Y,Li O Y,Pang L H,et al.Expression of FK506-binding protein 52(FKBP52) in chorionic villi with early recurrent spontaneous abortion[J].J Matern Fetal Neonatal Med,2015,28(10):1165-1169.
[13]Acar N,Ustunel I.Expression of 52-kDa FK506-binding protein(FKBP52) in human placenta complicated by preeclampsia and intrauterine growth restriction[J].Anal Quant Cytopathol Histpathol,2015,37(2):87-95.
[14]Hung T C,Chang T T,Fan M J,et al.In silico insight into potent of anthocyanin regulation of FKBP52 to prevent Alzheimer's disease[J].Evid Based Complement Alternat Med,2014,2014:450592.
[15]Giustiniani J,Sineus M,Sardin E,et al.Decrease of the immunophilin FKBP52 accumulation in human brains of Alzheimer's disease and FTDP-17[J].J Alzheimers Dis,2012,29(2):471-483.

