短发夹RNA 载体稳定抑制端粒相关蛋白TERF2IP1 表达的HCT116细胞的构建
廉沈沂,孟麟,杨永勇,寿成超
北京大学肿瘤医院暨北京市肿瘤防治研究所 生物化学与分子生物学实验室,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
染色体不稳定和端粒末端结构的异常是导致多种肿瘤发生的重要因素之一,也是多种肿瘤癌前病变的标志事件[1-2]。端粒相关蛋白TERF2IP1(端粒结合蛋白2相互作用蛋白1)是端粒末端Shelterin 复合物成员之一,主要发挥维持基因组稳定,调节端粒长度的功能[3-4]。近年有研究报道提示,TERF2IP1作为保守的核蛋白,不仅可以通过与TRF2 的结合,在端粒末端发挥抑制同源重组修复和非同源重组修复的作用,还可以通过与胞浆蛋白的结合转位至细胞浆中,参与NF-κB信号通路的活化[5]。同时,TERF2IP1蛋白也可作为转录因子,通过与染色质的非端粒位点的结合,参与下游多种信号通路的调控[5-8]。为避免短发夹RNA(short hairpin RNA,shRNA)的脱靶效应,提高获得稳定干扰细胞系的成功率,我们设计并合成了分别针对TERF2IP1基因不同位点的4 对寡核苷酸序列,克隆至pGP-H1/Hygro 载体,瞬时转染结肠癌细胞系,通过抗性筛选,获得稳定低表达TERF2IP1基因的结肠癌HCT116 细胞系,为后续研究TERF2IP1 蛋白在结肠癌发生发展中的作用提供了技术平台,对研究TERF2IP1在肿瘤进展中的功能具有重要意义。
1 材料和方法
1.1 材料
结肠癌细胞系HCT116及载体pGP-H1/Hygro均由北京大学肿瘤医院暨北京市肿瘤防治研究所实验室保存。
1.2 重组质粒的构建
将合成的TERF2IP1shRNA正义和反义寡核苷酸序列退火形成双链DNA,与经BamHⅠ/HindⅢ双酶切的pGP-H1/Hygro 载体混合,用T4DNA 连接酶4℃连接过夜,转化大肠杆菌BL21感受态细胞,挑取单克隆菌种进行扩增,并大量提取质粒,质粒送北京华大基因公司测序。
1.3 纯阳性干扰细胞的筛选
转染前一日将HCT116 细胞按5×106/孔铺到6孔板。用LipofectAMINE 2000 转染质粒:稀释要转染的质粒4 μg 到400 μL 无血清培养基中,同时稀释LipofectAMINE 2000 10 mL到400 mL无血清培养液中,5 min内将质粒和转染液轻轻混合均匀,室温放置30 min;弃去培养液,用无血清DMEM 培养液漂洗细胞2次,加上述混合物至六孔板细胞中,继续培养4~6 h,换完全培养基培养;2 d后用400 μg/mL 的潮霉素筛选抗性克隆,每隔2~3 d 换液(含400 mg/mL潮霉素);12~15 d后细胞克隆开始形成,并有一定的细胞数量,用无菌小滤纸片蘸取消化液,将细胞克隆消化后转移到24孔板中继续培养,在这一过程中,注意不要使各个克隆之间有相互污染;24孔板长满后,消化转移至6 孔板中继续培养;6 孔板培养4~6 d,将各个细胞克隆消化,其中1/3 部分继续培养,剩余2/3 部分进行后续检测;将检测为阳性的克隆转到10 cm皿中继续培养,同时冻存保种。
1.4 实时荧光定量RT-PCR 检测TERF2IP1 mRNA的表达
为检测shRNA 干扰HCT116 细胞后TERF2IP1mRNA 的表达情况,按TRIzol 说明书提取HCT116-control-shRNA 组 和HCT116-TERF2IP1-shRNA 组细胞的总RNA,反转成cDNA,取1 μL cDNA 进行PCR扩增。将1 OD的Real-Time PCR上、下游引物分别用TE配成1 mg/mL的储液,37℃溶解,上、下游引物各取1 μL混匀稀释至10 μL,取1 μL进行Real-Time PCR 反应(94℃初始变性4 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,循环40 次),最后用2-ΔΔCT对结果进行分析。
1.5 Western印迹检测TERF2IP1的表达
用本实验室自制的细胞裂解缓冲液[50 mmol/L Tris-Cl(pH7.5),150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS],新鲜加入蛋白酶抑制剂及DTT,裂解干扰的细胞,4℃、12 000 r/min 离心15 min,收取裂解上清作为样品,用BCA 法测定样品蛋白浓度,取等量上清液进行SDS-PAGE,将蛋白转移至硝酸纤维素膜上,用含5%脱脂奶粉的PBST液于室温封闭1.5 h,加入TERF2IP1鼠单抗(1∶1000稀释),GAPDH作为内参,4℃反应过夜,PBST洗膜3次,5 min/次,加入HRP标记的羊抗鼠二抗(1∶2000)室温反应45 min,PBST 洗膜3 次,5 min/次,暗室内用ECL 发光法显色5 min,检测目的条带,压片显影定影,以GAPDH作为内参分析结果。
2 结果
2.1 TERF2IP1 shRNA序列的设计
根据文献报道的TERF2IP1基因小干扰RNA(siRNA)序列,按照shRNA 表达载体的构建原则重新设计TERF2IP1shRNA基因的正义和反义寡核苷酸序列。为提高干扰效率,共设计4对TERF2IP1基因的shRNA序列。TERF2IP1shRNA和对照shRNA序列由北京赛百盛公司合成(表1)。
2.2 重组shRNA质粒载体的测序鉴定
测序结果显示,对照shRNA 和4 条TERF2IP1shRNA 序列均已正确插入pGP-H1/Hygro 载体(图1)。
2.3 shRNA 干扰HCT116 细胞后TERF2IP1 基因的表达

表1 构建用oligo DNA序列
图1 shRNA质粒载体的测序结果
提取转染空载体组和转染干扰序列组的HCT116 细胞总RNA,采用实时荧光定量PCR 检测各组细胞的TERF2IP1相对表达量。结果见图2,转染对照组和转染干扰序列组中可见TERF2IP1基因的阳性表达,TERF2IP1干扰质粒转染组中其表达量明显降低,TERF2IP1基因的表达抑制率分别为43%、27%、17%和53%。
2.4 HCT116 细胞的干扰和Western 印迹分析TERF2IP1蛋白的抑制效果
对实时荧光定量PCR检测为有效干扰的单克隆进行扩大培养,提取细胞总蛋白行Western 印迹检测,结果如图3。与转染对照相比,转染TERF2IP1-shRNA-1321 的细胞中TERF2IP1 蛋白的表达抑制率最高为48.6%,转染TERF2IP1-shRNA-1037 和TERF2IP1-shRNA-1112后TERF2IP1蛋白的表达抑制率分别为63.1%和73.8%。实验结果表明稳定干扰TERF2IP1基因的HCT116细胞系构建成功。

图2 实时荧光定量PCR检测shRNA对HCT116细胞中TERF2IP1 mRNA表达的影响
3 讨论
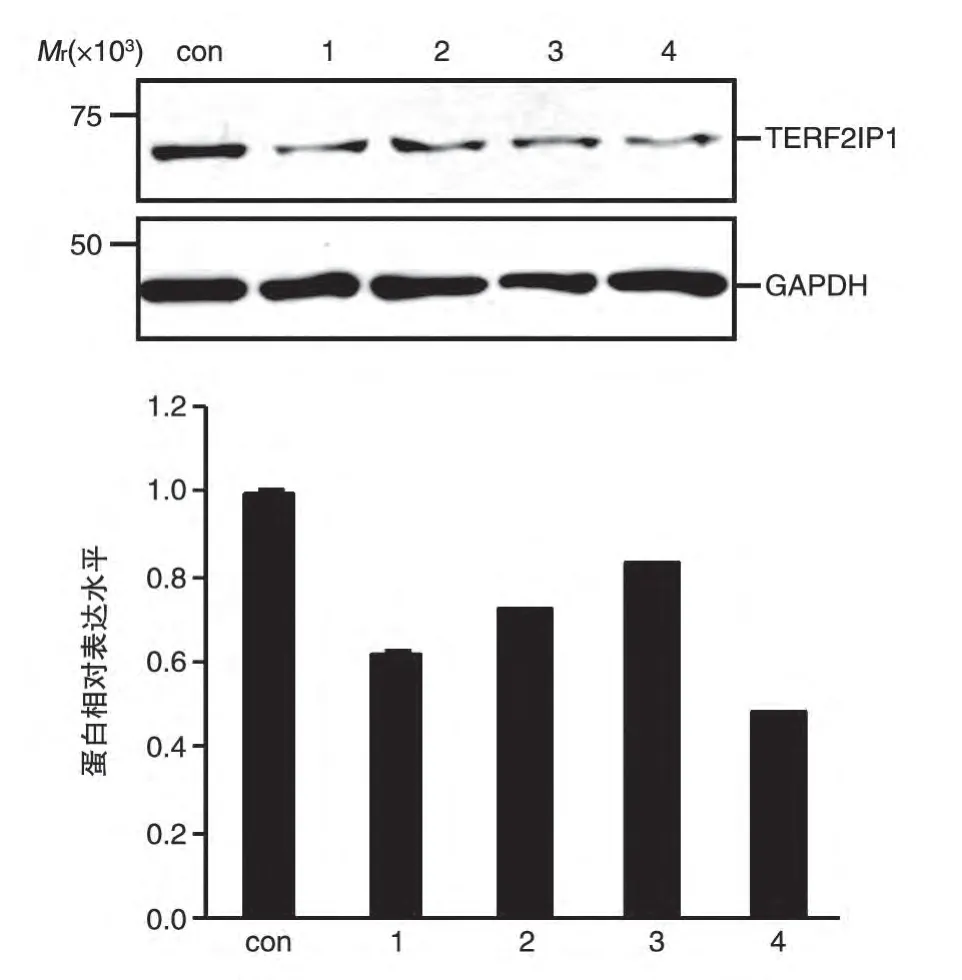
图3 Western印迹检测shRNA对HCT116细胞中TERF2IP1蛋白表达的影响
迄今为止,关于TERF2IP1的功能和机制研究均证实TERF2IP1在维持端粒稳定、抑制基因组不稳定中发挥重要作用,同时在端粒外发挥基因调控的功能。近年研究表明,在乳腺癌细胞中敲低TERF2IP1基因的表达,可以抑制乳腺癌细胞的迁移侵袭[5]。实验证实TERF2IP1 与TERF2 协同与非端粒位点的DNA 结合,参与多通路基因的转录调控,包括细胞骨架调节蛋白、钙离子通道调节蛋白及DNA损伤修复通路[6]。因此,我们可以推测TERF2IP1基因参与人类生理和病理状态下多个过程,探索TERF2IP1在不同疾病尤其是肿瘤中的功能将会成为研究热点。
RNA 干扰(RNAi)技术是通过双链RNA 介导同源靶mRNA 的特异性降解,导致转录后基因的表达沉默,是一种高效、特异的基因调节技术,最初在1998 年的秀丽新小杆线虫研究中被发现[9-10]。在RNAi技术实际应用中,shRNA/siRNA的适宜作用浓度、最佳作用时间及转染试剂都是影响基因沉默的关键因素,所以实验的稳定性和一致性较难控制。将shRNA靶序列克隆至含H1/U6启动子和真核抗性筛选标签的载体中,进行瞬时转染后的细胞抗性筛选,为获得稳定的特定基因沉默的细胞系提供了有力的实验手段。
HCT116细胞具有在裸鼠体内成瘤的能力,因此是研究结肠癌发生发展和转移的有力工具。肿瘤的发生发展是一个多因素、多步骤的复杂过程,癌基因的激活是肿瘤发生的始动因素之一,癌基因激活后,除可导致细胞增殖和侵袭能力增强等生物表型外,也可导致染色体结构不稳定进而引起DNA 双链断裂等分子表型。因此,研究和探索肿瘤发生和转移过程中的染色体和端粒相关分子事件,一直是研究人员持续关注的热点问题[11-12]。为了更好地探讨TERF2IP1在结肠癌中的功能和作用,我们根据短发夹RNA 的设计原则和要点,设计合成了4 对shRNA寡核苷酸序列,克隆至pGP-H1/Hygro 载体中,瞬时转染HCT116 细胞后,利用潮霉素进行细胞抗性的筛选,获得稳定干扰TERF2IP1基因表达的结肠癌细胞系。实时荧光定量PCR 和Western 印迹检测结果均提示经潮霉素筛选后稳定干扰了HCT116 细胞中TERF2IP1基因的表达。该细胞模型的建立,为深入研究TERF2IP1基因的功能提供了有效的生物学工具,也为研究TERF2IP1基因与肿瘤的关系提供了技术支持。
[1]Hanahan D,Weinberg R A.Hallmarks of cancer:the next generation[J].Cell,2011,144:646-674.
[2]Halazonetis T D,Gorgoulis V G,Bartek J.An oncogene-induced DNA damage model for cancer development[J].Science,2008,319:1352-1355.
[3]Palm W,de Lange T.How shelterin protects mammalian telomeres[J].Annu Rev Genet,2008,42:301-334.
[4]Li B,Oestreich S,de Lange T.Identification of human TERF2IP1:implications for telomere evolution[J].Cell,2000,101:471-483.
[5]Teo H,Ghosh S,Luesch H,et al.Telomere-independent TERF2IP1 is an IKK adaptor and regulates NF-kappaB-dependent gene expression[J].Nat Cell Biol,2010,12:758-767.
[6]Martinez P,Thanasoula M,Carlos A R,et al.Mammalian TERF2IP1 controls telomere function and gene expression through binding to telomeric and extratelomeric sites[J].Nat Cell Biol,2010,12:768-780.
[7]Platt J M,Ryvkin P,Wanat J J,et al.TERF2IP1 relocalization contributes to the chromatin-mediated gene expression profile and pace of cell senescence[J].Genes Dev,2013,27:1406-1420.
[8]Yeung F,Ramírez C M,Mateos-Gomez P A,et al.Nontelomeric role for Rap1 in regulating metabolism and protecting against obesity[J].Cell Rep,2013,3(6):1847-1856.
[9]Fire A,Xu S,Montgomery M K,et al.potent and specific genetic interference by double-strand RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[10]Napoli C,Lemieux C,Jorgensen R.introduction of a chimeric chalcone synthase gene into petunia results in reversible cosuppression of homologous gene in trans[J].Plant Cell,1990,2(4):279-289.
[11]Feldser D M,Greider C W.Short telomeres limit tumor progression in vivo by inducing senescence[J].Cancer Cell,2007,11:461-469.
[12]Suram A,Kaplunov J,Patel P L,et al.Oncogene-induced telomere dysfunction enforces cellular senescence in human cancer precursor lesions[J].EMBO J,2012,31:2839-2851.

