常压室温等离子体诱变选育微生物絮凝剂高产菌株
郝建安,杨波,姜天翔,张爱君,张晓青,司晓光,杜瑾,张雨山,王静
国家海洋局 天津海水淡化与综合利用研究所,天津 300192
微生物絮凝剂(microbail flocculant)是一类由微生物产生的,可使液体中固体悬浮颗粒、菌体细胞及胶体凝集、沉淀的特殊高分子代谢物。其具有安全无毒、无二次污染,作用对象广泛、净化效果明显,来源广泛、预期成本低等优点,已成为絮凝剂领域研究的新热点[1]。
微生物絮凝现象的研究起步很早,1876年,Louis Pasteur 就发现酵母菌可产生絮凝现象[2]。1976年,Junji Nakamura 等分离到可产絮凝活性物质的酱油曲 霉(Aspergillus sojae)AJ 7002[3];1986 年,Ryuichiro Kurane 等采用从自然界分离出的红平红球菌制成絮凝剂NOC-1,并把它用于畜产废水处理、膨胀污泥处理、砖场生产废水处理及废水的脱色处理,都取得了很好的处理效果,被认为是目前发现的最好的生物絮凝剂[4];1991 年,Kazuki Toeda 等发现一株可产微生物絮凝剂的协腹产碱杆菌(Alcaligenes cupidus)KT201[5];2002年,Zhang Jianfa等自纤维堆囊菌(Sorangium cellulosum)NUST06 中分离到一种胞外多糖类絮凝剂[6];2010年,Satish V.Patil等自印度固氮菌(Azotobacter indicus)ATCC 9540 中也发现了胞外多糖类絮凝剂[7]。截止目前,科学家已经陆续从陆地、海洋与其他环境中分离出多种絮凝活性微生物,涵盖数十个种属[8-11]。
常压室温等离子体(atmospheric room-temperature plasma,ARTP),利用氦气辉光放电产生的等离子体射流作用于微生物,引起微生物的突变。氦气辉光放电的主要优点包括:温度低,射流的温度可以维持在40℃以下;放电均匀;等离子体射流的活性粒子种类丰富,主要包括He*(氦的激发态),以及氮离子、氧离子等。等离子体射流的活性粒子可以作用于细胞内的DNA 物质上,引起DNA 物质的损伤,并通过不完全的修复过程引起基因位点突变。该方法首次应用在链霉菌(Streptomyces avermitilis)的选育中,获得高产除虫菌素的突变株[12],目前用于绿色糖单胞菌(Saccharomonospora viridis)[13]、茂源链轮丝菌(Streptoverticillium mobaraense)[14]、圆红冬 孢酵母(Rhodosporidum toruloides)[15]等30 多种生物的诱变选育中。
目前,微生物絮凝剂在工业化中的应用受到生产成本过高的制约[16],因此,选育微生物絮凝剂的高产菌株,开展适合工业生产的菌株诱变育种,提高微生物絮凝剂的产量是非常必要的。在本研究中,我们利用常压室温等离子体诱变系统对产絮凝剂的海洋地衣芽孢杆菌(Bacillus licheniformis)DHS-40 进行诱变,筛选微生物絮凝剂高产菌株,并对突变株产微生物絮凝剂的遗传稳定性进行研究,获得了遗传稳定性良好的高产突变菌株。
1 材料与方法
1.1 材料
产微生物絮凝剂菌株海洋地衣芽孢杆菌DHS-40 为本实验室从天津塘沽海河入海口的污泥中筛选并保存。
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH7.0(固体培养基添加1.5%~2%琼脂粉),121℃灭菌30 min。
1.2 菌悬液的制备
取斜面保存的菌种,接种于LB 固体培养基中,30℃恒温培养2 d,挑取单菌落转接到LB 液体培养基中,30℃振荡培养2 d,取10 mL对数生长期菌液,4℃、6000 r/min 离心5 min,收集菌体,用10 mL 生理盐水冲洗2~3 次,将菌体悬浮于无菌生理盐水中制备菌悬液,并将菌悬液浓度调整到D600nm为0.5~0.7(106~108个/mL)。
1.3 ARTP诱变方法
采用北京思清源生物科技有限公司生产的ARTP-Ⅱ型常压室温等离子体诱变系统。吸取10 μL 制备好的菌悬液,涂布在已灭菌的金属载片上,将载片置于载物台上,调整载物台高度,设定好处理时间后进行照射。本实验以氦气为载体,照射功率100 W,工作气流量10 SLPM,照射距离2 mm。照射处理后将载片转移到装有1 mL 无菌生理盐水的EP管中,振荡1~2 min,使附着在载片上的菌体洗脱到生理盐水中,形成新的菌悬液。将新的菌悬液稀释至10-4、10-5、10-6共3个梯度,每个梯度涂布3块平板,将涂布后的平板放置培养箱中进行培养。
分别考察照射时间为30、60、90、120、150、180、210、240、270、300 s时的活菌数,以未处理样品为参照,通过菌落计数计算致死率,确定最佳照射时间。

1.4 絮凝活性筛选
取6个大烧杯,每个烧杯中加入1 L调好浊度的水,其中1 个为空白对照,另5 个烧杯添加絮凝剂样品。絮凝搅拌分两阶段控制:第一阶段为快速混合阶段,搅拌转速200 r/min,持续2 min;第二阶段为反应阶段,搅拌转速30 r/min,持续25 min。絮凝过程结束后,停止搅拌,收起搅拌桨,静置沉淀15 min,沉淀结束后于距离上清液顶部2 cm 处取部分上清液,测量剩余浊度。
1.5 筛选方法
1.5.1 突变株初筛 选取经絮凝试验后,处理水样剩余浊度<25 NTU的诱变菌。
1.5.2 突变株复筛 选取经絮凝试验后,处理水样剩余浊度<20 NTU的诱变菌。
1.5.3 突变株终筛 将突变株与原始菌株进行同步培养,观察同期絮凝活性变化,选取絮凝活性高于原始菌株的突变株。
1.6 遗传稳定性分析
为了检验突变株的遗传稳定性,对筛选到的高产突变株进行传代培养,测定不同传代次数下突变株发酵液的表面张力。
2 结果
2.1 ARTP诱变致死率曲线
在常压室温等离子体诱变育种中,影响菌株诱变效率的主要因素有照射距离、气流量、放电功率和照射时间。为保证等离子体温度低于40℃,设定照射功率100 W、工作气流量10 SLPM、照射距离2 mm,在此条件下,等离子体诱变强度取决于照射时间的长短[12,17]。当照射时间从30 s上升到300 s时,菌株致死率如图1 所示。可以看出,等离子体与海洋地衣芽孢杆菌DHS-40致死率之间有明显的剂量累积效应,随着照射时间的增加,菌体的致死率不断升高。照射时间>60 s,DHS-40 致死率>60%;照射时间>240 s,致死率近100%。因此,选择60~240 s为菌株DHS-40的最佳诱变照射时间。
等离子体诱变为非定向,具随机性。据文献报道[18],选择菌株致死率在90%以上时,菌株突变率较高,且平板上菌落分散性较好,便于单菌落挑选。因此,选取致死率在90%以上平板的单菌株进行高产菌株的筛选。
2.2 絮凝剂高产菌株的筛选
共分离得到396 株诱变株,经过初筛、复筛,共计筛选得到8 株絮凝活性较高的诱变菌。将DHS-40突变菌株与原始菌株同步培养,其生长状态与絮凝活性同步曲线见图2、3。
由图2 可见,所有突变株的生长都比原始菌株要好,生长速率较快,尤其是90-102 与120-24 菌株的生长最为迅速,同期生长速率达到原始菌株的1.5倍以上。
由图3 可见,除90-102 与120-24 株外,其他突变株同期絮凝活性低于原始菌株,这2 株突变菌株的同期絮凝活性达到原始菌株的1.5倍以上。
2.3 突变株遗传稳定性分析
诱变菌株遗传稳定性对发酵生产非常重要,由于突变菌株在传代过程中可能会出现表型延迟现象,导致高产菌株传代后出现生产性衰退[19],因此必须对菌株传代过程中遗传稳定性进行研究。为验证突变株遗传稳定性,对突变株进行6 代连续发酵培养,并检测每一代发酵液絮凝活性,结果如图4 所示。可以看出,突变株有较好的遗传稳定性,连续传代6 次,突变株处理后水样的剩余浊度一直在30 NTU左右。
3 讨论

图1 海洋地衣芽孢杆菌DHS-40在不同照射时间下的致死率曲线
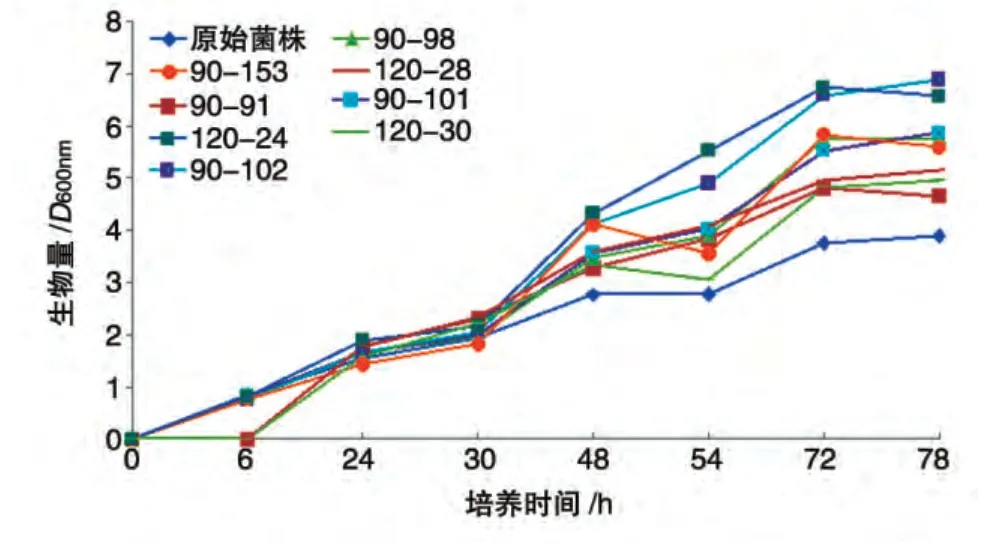
图2 原始菌和突变株同步生长曲线
微生物絮凝剂是具有絮凝活性的生物大分子物质,与化学絮凝剂相比,具有无毒、能生物降解等优点,未来在环保、农业、医药等领域具有较好的应用前景。目前微生物絮凝剂的主要问题是产量太低,导致生产成本过高,限制了其应用推广。选育高产微生物絮凝剂菌株,是提高微生物絮凝剂产量的方法之一,在发酵工业中,大部分都采用诱变菌株作为生产菌株。
本研究采用一种新的诱变育种方法,该方法产生的等离子体射流活性粒子种类丰富、放电均匀,与传统的诱变技术相比,具有操作简单、安全性高等优点,被广泛应用于微生物诱变育种中。杨颖[13]等对绿色糖单胞菌进行快速诱变,筛选出木聚糖酶高产菌株酶活比原始菌株提高17 倍;夏书琴[14]等利用ARTP 诱变茂原链轮丝菌(Streptoverticillium mobaraense),谷氨酰胺转氨酶酶活达2.73 U/mL,比原始菌株提高82%。等离子体作用于微生物,导致其DNA 物质的损伤,但部分微生物会通过自身的修复系统修复存活,使微生物基因序列和代谢网络发生显著变化,导致微生物的突变[20-21]。本实验中,菌株经过等离子体诱变后,最终筛选出2 株高产的突变株90-102 与120-24。这2 株突变株生长速率提高了近1.5倍,同期絮凝活性也提高了近1.5倍。因此,ARTP育种能有效提高菌株微生物絮凝剂产量,筛选出微生物絮凝剂的高产诱变株。

图3 原始菌和突变株同步絮凝曲线

图4 突变株遗传稳定性
综上,我们利用常压室温等离子体诱变海洋地衣芽孢杆菌DHS-40,通过摇瓶筛选微生物絮凝剂的高产菌株,获得2 株高产的突变株90-102 与120-24,与原始菌株相比,生长速率提高了近1.5倍,同期絮凝活性也提高了近1.5倍,且传代试验证实该突变株具有良好的遗传稳定性。
[1]周云,刘英,张志强,等.微生物絮凝剂制备的研究新进展[J].环境污染与防治,2014,36(4):80-85.
[2]Pasteurl.Etudes sur la Biere[M].Paris:Gauthier villars,1876.
[3]Nakamura J,Miyashiro S,Hirose Y.Purification and chemical-analysis of microbial cell flocculant produced by Aspergillus sojae AJ7002[J].Agric Biol Chem,1976,40(3):619-624.
[4]Ryuichiro K,Kiyoshi T,Tomoo S.Screening for and characteristics of microbial flocculants[J].Agric Biol Chem,1986,50(9):2301-2307.
[5]Toeda K,Kurane R.Microbial flocculant from Alcaligenes cupidus KT201[J].Agric Biol Chem,1991,55(11):2793-2799.
[6]Zhang J F,Wang R Y,Jiang P J,et al.Production of an exopolysaccharide bioflocculant by Sorangium cellulosum[J].Lett Appl Microbiol,2002,34(3):178-181.
[7]Patil S V,Salunkhe R B,Patil C D,et al.Bioflocculant exopolysaccharide production by Azotobacter indicus using flower extract of Madhuca latifolia L[J].Appl Biochem Biotechnol,2010,162(4):1095-1108.
[8]李婵娟,严鹤松.微生物絮凝剂产生菌的筛选及其絮凝特性研究[J].湖北农业科学,2014,14:3283-3286.
[9]韩宴秀,莫创荣,周云新,等.絮凝剂产生菌克雷伯氏杆菌的筛选、鉴定及培养条件优化[J].科学技术与工程,2014,18:177-182.
[10]Ahmad H R A,Azni I,Hamid H R A,et al.Flocculation behavior and mechanism of bioflocculant produced by Aspergil-lus flavus[J].J Environ Manage,2015,150:466-471.
[11]Sanjukta S,Neha B,Mihirjyoti P,et al.Bioflocculant production and biosorption of zinc and lead by a novel bacterial species,Achromobacter sp.TERI-IASST N,isolated from oil refinery waste[J].Chemosphere,2014,113:116-124.
[12]Wang L Y,Huang Z L,Li G,et al.Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J].J Appl Microbiol,2010,108(3):851-858.
[13]杨颖,玉王宁,金一,等.常压室温等离子快速诱变绿色糖单孢菌筛选木聚糖酶高产菌株及其酶学性质研究[J].微生物学通报,2013,40(5):905-915.
[14]夏书琴,刘龙,张东旭,等.大气压辉光放电低温等离子体诱变选育谷氨酰胺转氨酶高产菌株[J].微生物学通报,2010,37(11):1642-1649.
[15]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[16]刘立凡,聂锦旭.中国微生物絮凝剂的生产研究现状[J].环境污染与防治,2007,29(4):276-279.
[17]Li G,Li H P,Wang Y L,et al.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J].Appl Physics Lett,2008,92(22):221504.
[18]Hua X F,Wang J,Wu Z J,et al.A salt tolerant Enterobacter cloacae mutant for bioaugmentation of petroleum-and salt-contaminated soil[J].Biochem Eng J,2010,49(2):201-206.
[19]周德庆.微生物学教程[M].2 版.北京:高等教育出版社,2002:213-216.
[20]Pompl R,Jamitzky F,Shimizu T,et al.The effect of low-temperature plasma on bacteria as observed by repeated AFM imaging [J].New J Physics,2009,11(11):115023.
[21]Morfill G E,Kong M G,Zimmermann J L.Focus on plasma medicine[J].New J Physics,2009,11(11):115011.

